一氧化氮對豚鼠耳蝸外毛細胞L-型鈣通道電流影響的實驗研究
曹玲 黎萬榮
最近研究表明耳蝸中有大量的一氧化氮合酶(nitric oxide synthease,NOS)存在[1],提示一氧化氮(NO)在耳蝸內有生物作用。耳蝸內的NO與耳蝸血流調節、內淋巴液離子穩定性和神經傳導等生理過程有關,還影響內耳多種疾病的病理生理過程[2]。目前人們對內耳NO及NOS的研究大多仍集中在正常生理情況下的分布和功能特征方面,而對其在內耳病理生理與藥理條件下的研究報道尚少見,如NO是否可以通過影響耳蝸外毛細胞表面的鈣通道,從而調節外毛細胞的功能狀態,影響某些內耳疾病的發生和發展等。本實驗應用全細胞膜片鉗技術觀察NO供體之一L-精氨酸(L-Arg)對豚鼠耳蝸外毛細胞L型鈣通道電流(ICa-L)的影響,以探討NO能否通過耳蝸外毛細胞鈣通道途徑調節外毛細胞及內耳的功能。
1 材料與方法
1.1耳蝸外毛細胞分離 實驗動物為40只雜色或白色豚鼠(由瀘州醫學院實驗動物中心提供),體重325±22 g,雌雄不拘。動物快速斷頭處死,取出顳骨,迅速打開聽泡,置入已充氧的冷Hanks液中;解剖顯微鏡下仔細剔除耳蝸骨殼,盡量保持膜迷路完整;斷開蝸軸,將耳蝸輕移入含膠原酶Ⅳ的D’Hanks液中消化10~20分鐘;輕移入含鈣的Hanks液中終止消化5分鐘;輕移入預先用多聚賴氨酸處理過的浴槽中,解剖顯微鏡下微鑷撕除螺旋韌帶,剪碎基底膜,輕輕吹打后靜置10分鐘,使單離的外毛細胞貼附于浴槽底部;小心更換新鮮的浴液。選擇貼壁良好、立體感強、表面光滑、胞核接近底部、胞內無布朗運動顆粒、胞膜完整有雙折射現象的單離外毛細胞進行觀察和實驗。
1.2實驗材料 電極液(mM):CsCl 119.8, MgCl24.0,EGTA 5.0,CaCl20.06,HEPES 10.0,Na2ATP 3.1, NaGTP 0.42,CsOH調pH至 7.25~7.3。浴液(mM):NaCl 107.1,CsCl 30.0,MgCl21.8,CaCl21.8, NaHCO34.0, Glucose 5.0,Sodium pyravate 5.0,HEPES 10.0,NaH2PO4·2H2O 0.8,NaOH調pH至7.3~7.4。Hanks液(mM):KCl 5.4,KH2PO4 0.5 ,NaCl 137.0,NaHCO34.2,Na2HPO40.3, MgCl20.5,MgSO40.4, CaCl21.3,Glucose 5.0,NaOH調pH至7.3~7.4。 D Hanks液(mM):KCl 5.4,KH2PO4 0.5 ,NaCl 137.0,NaHCO34.2,Na2HPO40.3,NaOH調pH至7.3~7.4。鹽橋液同電極液。膠原酶Ⅳ(collagenase Ⅳ):0.5 mg/ml以上試劑中,HEPES、EGTA、Na2ATP、NaGTP、CsOH、Sodium pyravate、膠原酶Ⅳ均購自美國Sigma公司,L-精氨酸(L-Arg):C6H14N4O2,Japan,余為國產分析純。
玻璃微管電極制備:選用內徑1.0 mm、壁厚0.25 mm、長度75.0 mm的軟質毛細玻璃管 (美國Drummond scientific 公司生產),置于微管電極拉制儀上,經兩步拉制而成,第一步拉制參數設置為58.4 mA,第二步拉制參數設置為53.5 mA,通過兩步拉制后的電極尖端直徑約為0.7 mm ,充灌電極液后電極阻抗約為5~8 MΩ。將拉制成的微管電極置于拋光儀垂直推進架上,在低倍鏡(×60)下找到電極尖端和加熱電阻絲,然后換成高倍鏡(×495),將加熱電阻絲和電極尖端調整至一個平面內,進行瞬間高溫加熱,待電極尖端微微回縮后,立即停止加熱,完成電極拋光。
1.3ICa-L的記錄 采用膜片鉗全細胞記錄方式(AXOPA TCH-200B Axon instrument,USA)記錄不同濃度L-Arg對L型鈣通道電流的影響,根據溶液中加入的L-Arg濃度,分為0.5×10-6mol/L組(A組)、1.0×10-6mol/L組(B組)及1.5×10-6mol/L組(C組),分別觀察各組用藥后5分鐘內 ICa-L峰值電流密度增幅。選擇鉗制電壓(VH)為-60 mV,刺激持續時間為200~300 ms的測試電壓,10 mV為一個階躍,從-50 mV除極到+50 mV,激活鈣通道,記錄ICa-L。實驗中全細胞電流信號經膜片鉗放大器放大后,引入記憶示波器及12位A/D、D/A轉換器,再輸入計算機用于電流信號采集,采樣頻率為20 kHz。所記錄的電流數據采用P-Clamp9.0專用軟件進行分析處理,分析電流幅值(current amplitude,Am)、電流密度(current density)和電流-電壓關系曲線(I-V)。記錄在屏蔽防震工作臺上進行。

2 結果
2.1ICa-L的特性及鑒定 圖1為豚鼠耳蝸外毛細胞在細胞外液游離鈣離子濃度為1.8 mmol/L和Cs+內液時,膜片鉗全細胞記錄方式下記錄到的電流圖形。本實驗鉗制電壓(VH)設置為-60 mV,以10 mV為一個階躍,改變指令電壓(VT)(-50 mV~+50 mV),刺激持續時間為200~300 ms,可記錄到一電壓依賴性的內向電流。此內向電流的激活電壓大于-40 mV~-30 mV,激活范圍在-50 mV~+50 mv電壓范圍內。當VT為0 mV時電流幅值Am達峰值,反轉電位約為+60 mV,I-V曲線為鐘型。此內向電流具有明顯的衰減現象,可被維拉帕米完全阻斷。以上結果均提示該內向電流為電壓依賴性L型鈣通道電流。

圖1 膜片鉗全細胞記錄方式記錄到的豚鼠耳蝸外毛細胞ICa-L
2.2L-Arg對耳蝸外毛細胞ICa-L的影響 VH為-60 mV、VT為0 mV時(圖2)觀察L-Arg對通道電流的影響。通道電流在L-Arg濃度為0.5×10-6mol/L ~1.5×10-6mol/L(低濃度)表現為濃度依賴性抑制,電流幅值和峰值電流密度隨L-Arg濃度的增大而減小(圖3~5),洗脫后通道電流部分恢復。用藥后5分鐘內各組ICa-L峰值電流密度增幅最大值分別為:A組從3.78±1.40 pA/pF降至3.70±1.22 pA/pF,增幅為-2.12%,A組用藥前后比較,ICa-L增幅差異無統計學意義(P=0.35,t=1.06);B組從3.78±1.40 pA/pF降至2.62±0.85 pA/pF,增幅為-30.69%,用藥前后比較,ICa-L增幅差異有極顯著統計學意義(P=0.003,t=6.58);C組從3.78±1.40 pA/pF降至1.32±0.17 pA/pF, 增幅為-65.08%, 用藥前后相比,ICa-L增幅差異有極顯著統計學意義(P=0.001,t=6.35);A與B、B與C、A與C組之間比較,ICa-L的增幅差異均有極顯著統計學意義(均為P<0.01)。
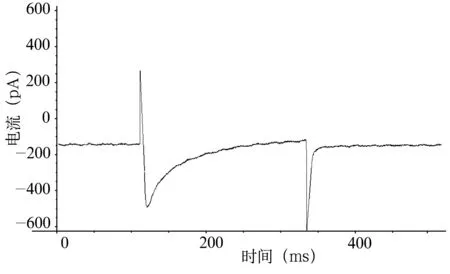
圖2 VH為-60 mV,VT為0 mV時浴液內未加L-Arg時豚鼠耳蝸外毛細胞ICa-L

圖3 VH為-60 mV,VT為0 mV時浴液內加入L-Arg 0.5×10-6mol/L時豚鼠耳蝸外毛細胞ICa-L
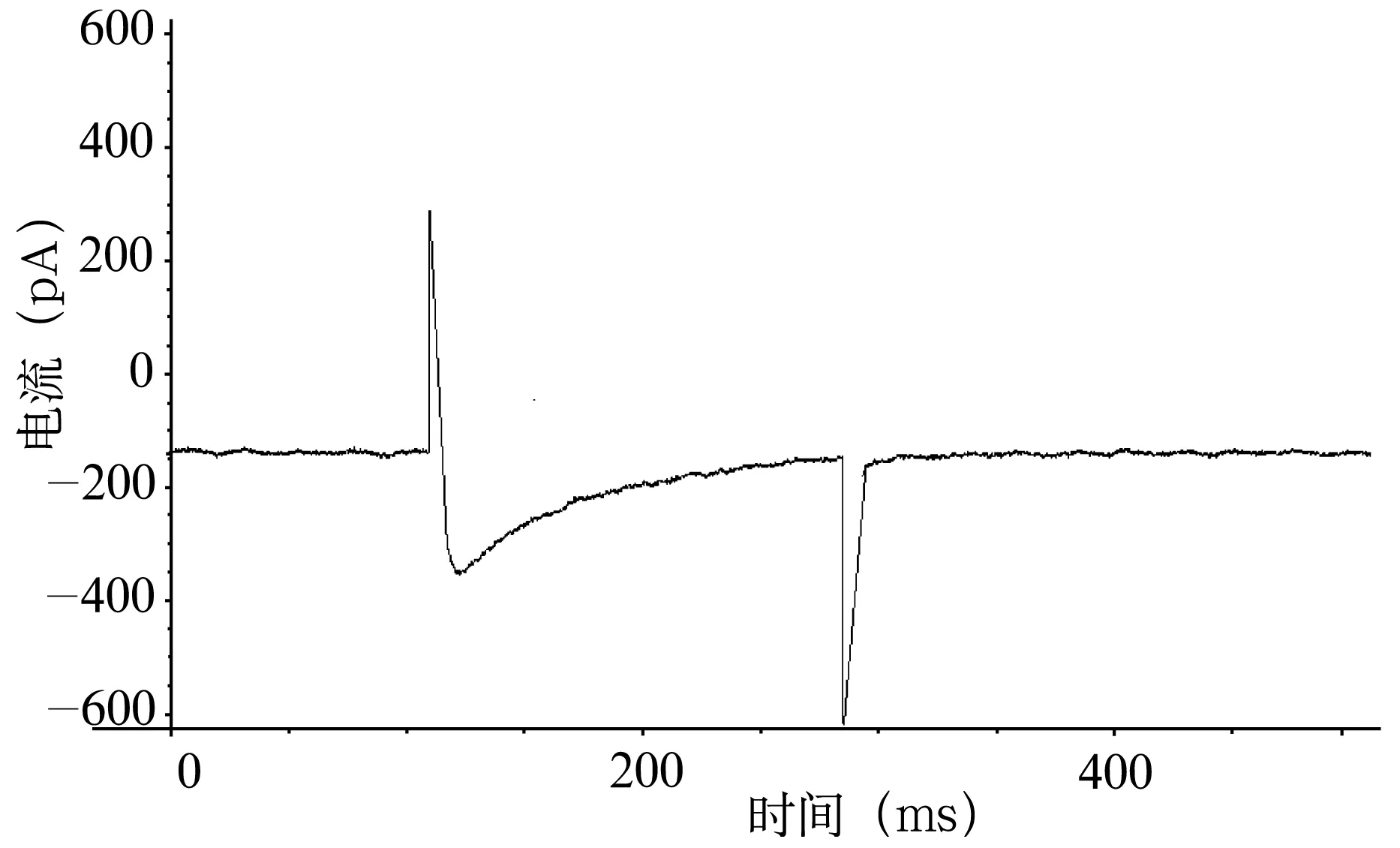
圖4 VH為-60 mV,VT為0 mV時浴液內加入L-Arg 1.0×10-6mol/L時豚鼠耳蝸外毛細胞ICa-L
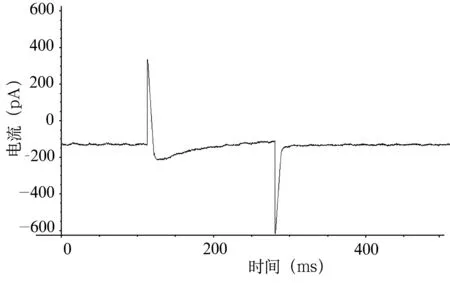
圖5 VH為-60mV,VT為0mv時浴液內加入L-Arg1.5×10-6mol/L時豚鼠耳蝸外毛細胞ICa-L

圖6 L-Arg對豚鼠單個耳蝸外毛細胞ICa-LI-V曲線的影響
2.3L-Arg對ICa-L作用的I-V關系 在低濃度狀態下,L-Arg可使ICa-L減小,I-V曲線上抬(圖6),并且隨指令電壓的變化而發生規律性的變化,在鋒電流電壓下作用最明顯,對反轉電位無明顯影響。
3 討論
在耳蝸水平,鈣通道主要是控制突觸部位神經遞質的釋放,也可調節毛細胞中一些依賴Ca2+的細胞功能活動,包括適應慢收縮過程的調節。內毛細胞的鈣通道與鉀通道互相配合,參與感受器電位的調節。前庭感受器II型毛細胞的L型鈣通道的特點與內毛細胞的相似,而對耳蝸外毛細胞和前庭感受器I型毛細胞鈣通道研究資料較少。外毛細胞的L型鈣通道在膜電位去極化至-30 mV時激活,與其靜息膜電位-70 mV~-80 mV相距甚遠,故生理意義尚不清楚。前庭感受器I型毛細胞L型鈣通道的生物物理特性與前庭感受器II型毛細胞的差別不大,其功能可能是參與感受器電位的調節及突觸部位遞質的釋放。
電壓門控L型鈣通道位于內毛細胞突觸前膜,控制鈣離子內流和內耳傳入突觸的遞質釋放[3],對聽覺產生有重要意義。耳蝸內的NO與耳蝸血流調節、內淋巴液離子穩定性和神經傳遞有關。生理條件下,NO維持內耳功能并與耳蝸蝸內電位(EP)、復合動作電位(CAP)、微音電位(CM)的產生有關[4]。基于L型鈣通道和NO在耳蝸外毛細胞活動中的重要作用,本實驗研究NO供體L-Arg對ICa-L的影響,結果可見在全細胞膜片鉗記錄方法下,L-Arg濃度為0.5×10-6mol/L ~1.5×10-6mol/L時,對L型鈣通道電流表現為濃度依賴性抑制,電流幅值和峰值電流密度隨L-Arg濃度的增大而減小,I-V曲線上抬,洗脫后通道電流部分恢復。
周建波等[5]指出,在生理條件下,體內的NO對耳蝸外毛細胞的保護作用可能是通過阻斷外毛細胞L型鈣通道電流的內流,從而抑制胞內Ca2+超載來發揮作用的,這也可能是病理生理過程初期階段的一種保護機制。有文獻報道應用低濃度L-Arg活體灌流耳蝸,可以部分拮抗H2O2對毛細胞的損傷[6],也支持上述機制存在的可能性。本實驗研究結果顯示低濃度L-Arg抑制ICa-L的機制與上述文獻報道一致。
通過本實驗和既往實驗研究結果[6]推測NO對L型鈣通道的影響可以通過激活鈣激活鉀通道(KCa)的負反饋機制使K+外流,促使膜向超極化方向變化,使Ca2+通道關閉,降低胞內Ca2+水平。基于上述推測,NO生成過多或L型鈣通道功能異常及病理條件下,耳蝸內氧自由基等代謝產物大量增加,可能造成外毛細胞胞內Ca2+增加,胞內鈣超載,致細胞死亡,導致內耳疾病的產生和發展。臨床上應用鈣拮抗劑治療內耳疾病有一定效果的實踐,也從另一方面支持上述機制存在的可能性[7]。
綜上所述,認為在調節豚鼠耳蝸外毛細胞的活動中存在NO/ICa-L途徑。然而,NO在內耳的作用可能是多方面的,其作用機理十分復雜,簡單的電生理研究僅能揭示NO在內耳作用的部分機制,并不能反映其全部的生理過程。今后有待于利用其它先進技術進一步研究,深入探索NO與ICa-L的詳細作用機制。
(致謝:本研究實驗部分在瀘州醫學院心肌電教研室完成,曾曉榮教授、李妙齡老師給予大力幫助,在此表示衷心的感謝!)
4 參考文獻
1 Dulon D,Zajic G,Aran JM, et al.Aminoglycoside antibiotics impair calcium entry but not viability and motility in isolated cochlear outer hair cells [J].J Neurosci Res,1989,24:338.
2 Aran JM ,Erre JP,Lima da Costa D,et al.Acute and chronic effects of aminoglycosides on cochlear hair cells[J].Ann N Y Acad Sci,1999,884:60.
3 Catterall WA.Strueture and regulation of voltage-gated Ca2+channels[J].Annu Rev Cell Dev Bio1,2000,16:521.
4 李興啟,賈學斌,曹效平,等.一氧化氮-環磷酸鳥苷通路對耳蝸靈敏度的調節[J].中華耳鼻咽喉頭頸外科科雜志,2006,41:532.
5 周建波,孔維佳.硝普納對豚鼠耳蝸外毛細胞全細胞鈣電流作用的實驗研究[J].中華耳鼻咽喉科雜志,2003,38:259.
6 賴丹,黎萬榮,李興啟.一氧化氮對過氧化氫所致聽力損失的保護作用[J].生理學報,2004,56:237.
7 Mann W,Beck C,Beck C.Calcium antagonists in the treatment of sudden deafness[J].Arch Otorhinolaryngol,1986,243:170.

