利用CO2開采海底天然氣水合物影響因素分析
任德剛
(中國電力工程顧問集團公司)
利用CO2開采海底天然氣水合物影響因素分析
任德剛
(中國電力工程顧問集團公司)
通過介紹氣體水合物的晶體結構,從熱力學方面論證了利用CO2開采海底天然氣水合物的可行性,并分析了鎧甲效應、溫度、壓力、晶體結構、晶穴充滿度、多孔介質、鹽度、添加劑及乳化等多種因素對CO2與CH4水合物置換反應的影響,最后指出今后研究的重點應為采取各種措施強化反應過程。該研究成果為CO2封存和海底天然氣開采研究提供了一種新思路。
CO2;開采;天然氣水合物;影響因素
0 引言

隨著CO2捕集項目的不斷投運,捕集的CO2除了少量可用于工業生產和油田回注外,大部分需要以液態形式進行地質封存和海底封存。直接進行海底封存存在影響海洋生態環境和CO2可能逸散回大氣等問題[1]。氣體水合物是在一定溫度和壓力下由氣體分子填充水分子產生的晶格而形成的一種白色籠形晶體[2],是由主體分子即水分子間以氫鍵相互結合形成籠形空隙,并將客體分子即氣體分子包絡在其中所形成的非化學計量的包絡化合物[3]。主、客體分子之間的作用力為范德華力[2]。 目前已知 100 多種氣體如 CH4,C2H6,CO2,N2和O2等均可形成氣體水合物[3]。形成天然氣水合物的主要氣體為CH4,通常將CH4分子含量超過99%的天然氣水合物稱為甲烷水合物(Methane Hydrate)。CH4水合物的構成表達式為CH4·nH2O,其中n為H2O分子和CH4分子的摩爾比,其理論最小值為5.75[4]。理論上1 m3的CH4水合物在標準條件下,可釋放出164 m3的 CH4氣體和 0.8 m3的水[5]。 海底存在大量天然氣水合物,含量高達 1.2×1017m3[6]。因此,利用CO2開采海底天然氣水合物,不僅可以解決CO2封存問題,而且可以緩解人類面臨的能源危機。
1 利用CO2開采海底天然氣水合物的熱力學可行性
天然氣水合物的形成需要具備3個基本條件:首先,溫度不能太高,在0℃以上就可生成,以0~10℃為宜,而高于20℃就會分解;第二,壓力要夠,但也不能過大,在0℃的溫度和3.03 MPa的壓力下就可以生成;第三,要有足量的天然氣氣源[7]。因此,天然氣水合物在深度為300~500 m、溫度為2~4℃的海洋陸架斜坡和深海盆地沉積物中廣泛存在。天然氣水合物的賦存條件易于模擬,為實驗研究利用CO2開采海底天然氣水合物提供了條件。
1.1 熱平衡
水合物的生成反應為放熱反應,分解反應為吸熱反應。當n=6.15時,CH4水合物的分解熱為54.49 kJ/mol,CO2水合物的合成熱為 57.98 kJ/mol[8]。 因此,CH4水合物分解所需的熱量,完全可以由形成CO2水合物所釋放出的熱量提供,此時,置換反應將會自發進行。
1.2 相平衡
圖1為CH4-CO2水合物相平衡及CO2的V-L關系曲線[9]。 從圖 1可看出,在同一溫度下,CH4平衡壓力明顯高于CO2平衡壓力,二者間的壓力差就是CO2與CH4水合物置換反應的推動力;V-L曲線則表示在某一溫度下進行置換反應時,以液態或氣態CO2與CH4水合物進行反應必須維持的壓力下限或上限。
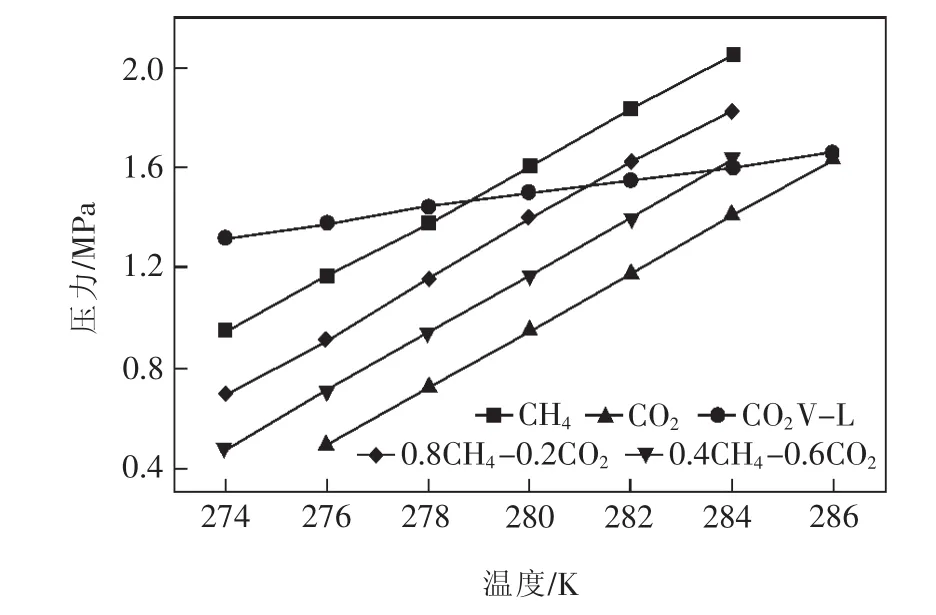
圖1 CH4-CO2水合物相平衡及CO2的V-L關系曲線(據文獻[9]略有修改)Fig.1 CH4-CO2hydrate phase equilibrium and CO2V-L curve
1.3 實驗驗證
Sivaraman[8]用實驗證明了 CO2置 換 CH4水 合物的可行性。通過氣相色譜分析,實驗68 h后,氣相中的CO2摩爾比例由100%下降到72.33%,CH4的摩爾比例由0上升到27.67%。Ohgaki等[9]發現,當置換實驗在某條件下達到相平衡時,水合物中CH4的摩爾比例下降到48%,而氣相中CH4的摩爾比例達到70%,即CH4在氣相和水合物相中的分配系數為 1.458。 Komal[10]在精確控制壓力倉中壓力為3.5 MPa、溫度為276±0.5 K的條件下,發現置換反應1h后,反應產物中CO2水合物和CH4水合物的比例分別為40%和45%,而且隨著時間的推移,CO2水合物的比例越來越高;12 h后,置換反應基本完成。
2 影響置換反應的主要因素分析
2.1 鎧甲效應
由于氣體水合物為冰狀晶體,因此,當CO2分子與位于晶體表面的CH4水合物接觸時,置換反應的速度會變得很快。隨著反應不斷進行,生成的CO2水合物在晶體表面形成一層鎧甲,使CO2分子向晶體內部的運動越來越困難,置換反應速度逐漸變慢。王金寶等[11]通過實驗研究發現,在置換反應開始的2 h內,置換出的CH4量及進入水合物相的CO2量都會迅速增加。此后二者變化趨于平緩,置換反應速度變慢,進入平穩發展階段,驗證了鎧甲效應的存在。
2.2 溫度
溫度對置換過程的影響十分明顯,溫度越高,越有利于置換反應的進行。例如,在壓力為3.5MPa、置換時間為104 h的條件下,置換溫度為276.15 K時的置換效率為6.90%,而置換溫度為278.15 K時的置換效率為8.54%,后者比前者的置換效率提高了1.64%,如圖2所示。
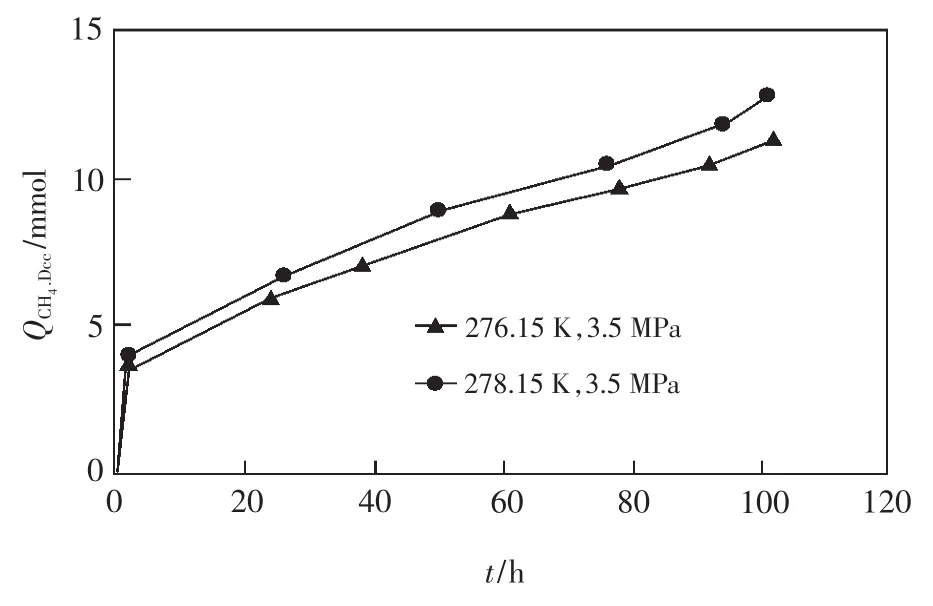
圖2 不同溫度條件下CH4被置換量隨時間的變化(據文獻[11]略有修改)Fig.2 Amount of CH4replaced change with time at different temperature
2.3 壓力
壓力越高,越有利于置換反應的進行,但其影響比溫度要小。例如,在溫度為276.15 K、置換時間為104 h的條件下,壓力為3.5 MPa時的置換效率為6.90%,而壓力為3.8 MPa時的置換效率為8.03%,后者比前者的置換效率提高了1.13%,如圖3所示。
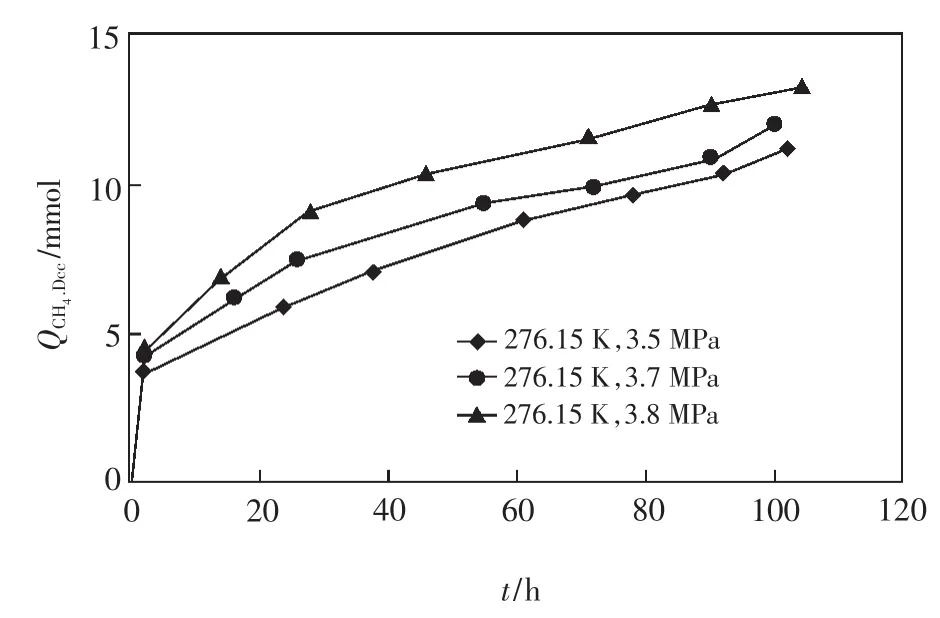
圖3 不同壓力條件下CH4被置換量隨時間的變化(據文獻[11]略有修改)Fig.3 Amount of CH4replaced change with time at different pressure
2.4 晶體結構
CH4與CO2水合物單晶均為結構Ⅰ型,由2個小晶穴和6個中晶穴組成。小晶穴為五邊形十二面體(512),直徑為0.510 nm;中晶穴為12個五邊形和2個六邊形組成的十四面體(51262),直徑為0.586 nm。CH4分子的范德華直徑為0.436 nm,能夠填充在小晶穴和中晶穴中,而CO2分子的范德華直徑為0.512nm,只能填充在中晶穴中[12]。水合物為了維持自身的穩定性,部分分解出的CH4分子重新占據小晶穴,致使CH4水合物小晶穴的分解速率遠低于中晶穴的分解速率。即使CO2全部占據中晶穴,將仍有1/4的CH4分子殘留在水合物晶體中[13],造成能源資源的浪費。
2.5 晶穴充滿度
自然界中的甲烷水合物平均只有大約1/3的晶穴被氣體分子占據,發生置換反應時有部分CO2分子會進入水合物的空晶穴,同時也有部分CO2分子會進入游離水中形成水溶液,因此,置換反應中CO2的消耗量會大于CH4的產量。實驗證明,CO2消耗量和CH4產量的摩爾比最高可達到5.6[11]。
2.6 多孔介質
海底的天然氣水合物存在于海底沉積帶中。海底沉積帶特定的溫度和壓力范圍以及多孔介質特性會影響置換反應的熱力學特性。多孔介質特性如孔徑、介質材料和表面結構對置換反應均有影響,其中孔徑的影響最大。孔徑越小,其對置換反應的影響越大。例如,在孔徑為10 nm的多孔介質中,CO2水合物的平衡溫度降低5 K;在孔徑為4 nm的多孔介質中,CO2水合物的平衡溫度降低12 K[13]。由于多孔介質會降低CO2的擴散速度,因此,在多孔介質中置換反應速率只有大容積反應器中置換反應速率的1/2~1/4[14]。 孔徑越小,CO2和 CH4的反應熱差值就越大,越有利于反應進行。
2.7 鹽度
鹽度隨海洋深度的增加而升高。鹽度越高,水合物平衡溫度越低。陽離子對置換反應的影響程度由大到小依次為 Mg2+,Ca2+,Na+,K+,其中只有 Mg2+影響顯著。陰離子對置換反應的影響程度由大到小依次為這 3 種陰離子濃度對水合物相平衡點的影響均較顯著[15]。當鹽度低于4%時,其對水合物晶穴充滿度的影響不明顯;當鹽度高于4%時,晶穴充滿度會隨鹽度的升高而降低[16]。
2.8 添加劑
CO2在靜態系統純水體系中的形成速率非常緩慢,而注入添加劑可以提高水合物的生成速率。常見的添加劑有表面活性劑、水溶性聚合物添加劑和不溶于水的液態烴添加劑。例如,在添加質量分數為0.1%的Silwet L277后,在相同時間內CO2水合物的生成速率是純水體系的5.3倍[17]。0.3%的十二烷基硫酸鈉 (SDS)、0.3%的SDS和4%的四氫呋喃(THF)的混合物也能對CO2水合物的生成起到顯著的改善效果[18]。
2.9 乳化
為了提高反應速率,McGrail等[19]提出了一種所謂強化氣體水合物的回收法(EnhancedGasHydrate Recovery,簡稱EGHR)。該方法的要點是:首先通過一定的方法制成以液態CO2為分散相、水為連續相的乳化液,其中CO2占總體積的50%~70%;然后,在一定的壓力下,將乳化液注入事先在砂層中形成的CH4水合物層,使之與水合物接觸,置換出水合物中的CH4。這樣充分利用了H2O-CO2混合物體系的物理和熱力學性質,并結合了多孔介質中受控多相流、熱量和質量傳遞過程的優點,使置換反應得到強化[20-24]。通過改變乳化液的溫度、CO2與水的比例以及CO2作為分散相的粒度大小,可以實現對置換反應過程的控制。
3 結束語
利用CO2開采海底天然氣水合物,具有環保和經濟的雙重意義。從熱力學角度講,用CO2置換天然氣水合物中的CH4是完全可行的。CO2置換CH4的反應受多種因素的影響,目前對影響因素種類及影響程度的研究仍處于理論和實驗階段,置換反應速率還達不到工業應用的水平,因此,采取各種措施強化反應過程,應該成為今后研究的重點。
[1]石謙,郭衛東,韓宇超,等.二氧化碳海洋傾廢的研究進展[J].海洋通報,2005,24(2):72-78.
[2]楊曉西,丁靜,楊建平,等.水合物分離二氧化碳氣體的研究[J].東莞理工學院學報,2006,13(4):51-56.
[3]王新裘,俊紅.籠形水合物研究與應用[J].化工生產與技術,2004,11(3):19-22.
[4]Kvenvolden K A.李玉梅,譯.天然氣水合物中甲烷的地球化學研究[J].天然氣地球科學,1998,9(3/4): 9-18.
[5]蔣向明.天然氣水合物的形成條件及成因分析[J].中國煤炭地質,2009,21(12):7-11.
[6]Klauda J B,Sandler S I.Global distribution of methane hydrate in ocean sediment[J].Energy&Fuels,2005,19(2):459-470.
[7]吳后波,蘇曉波,顏文.海底天然氣水合物的微生物成因及識別[J].海洋科學,2008,32(3):96-100.
[8]Sivaraman R.The potential role of hydrate technology in sequestering carbon dioxide[J].Gas Tips,2003,9(4):4-7.
[9]Ohgaki K,Takano K,Sangawa H,et al.Methane exploitation by carbon dioxidefromgashydrates-phaseequilibriaforCO2-CH4mixed hydrate system[J].Journal of Chemical Engineering of Japan,1996,29(3):478-483.
[10]Komal T.祝斌強,譯.二氧化碳和甲烷水合物再形成與置換的動力學機制[J].海洋地質,2008,(24):33-40.
[11]王金寶,郭緒強,陳光進,等.二氧化碳置換法開發天然氣水合物的實驗研究[J].高校化學工程學報,2007,21(4):715-719.
[12]Sloan E D.Clathrate hydrates of natural gases[M].New York:Marcel Dekker,1998.
[13]羅莎莎,劉宏菊,孫也.CO2開采海底天然氣水合物的研究進展[J].中國資源綜合利用,2008,26(3):19-23.
[14]周錫堂,樊栓獅,梁德青.CO2置換開采天然氣水合物研究進展[J].化工進展,2006,25(5):524-527.
[15]宋永臣,楊明軍,劉瑜,等.離子對甲烷水合物相平衡的影響[J].化工學報,2009,60(6):1362-1366.
[17]劉妮,張國昌,羅杰斯R E.二氧化碳氣體水合物生成特性的實驗研究[J].上海理工大學學報,2007,29(4):405-408.
[18]劉妮,劉道平,謝應明.水合物法高效儲存二氧化碳氣體的實驗研究[J].中國電機工程學報,2009,29(14):36-40.
[19]McGrail B P,Zhu T,Hunter R B,et al.A New Method for Enhanced Production of Gas Hydrates with CO2[C]∥AAPG Hedberg Conference.Gas Hydrates:Energy Resource Potential and Associated Geologic Hazards.Vancouver,2004 :1-3.
[20]杜金虎,何海清,皮學軍,等.中國石油近年勘探進展及未來勘探接替領域與重點區帶[J].巖性油氣藏,2011,23(1):1-16.
[21]李武廣,邵先杰,康園園,等.油藏分類體系與方法研究[J].巖性油氣藏,2010,22(2):123-127.
[22]劉云,盧淵,伊向藝,等.天然氣水合物預測模型及其影響因素[J].巖性油氣藏,2010,22(3):124-127.
[23]王濤.鹽水層CO2埋存潛力及影響因素分析[J].巖性油氣藏,2010,22(增刊):85-88.
[24]文鋼鋒,王智,韓軍,等.地質模型反演預測隱蔽油氣藏[J].巖性油氣藏,2009,21(1):94-98.
Influencing factors of subsea natural gas hydrate exploitation with CO2
REN De-gang
(China Power Engineering Consulting Group Corporation,Beijing 100120,China)
This paper introduced the crystal structure of gas hydrate,discussed the feasibility on methane hydrate exploitation with CO2from thermodynamics,and analyzed the effects of different factors on the replacement reaction,including loricae effect,temperature,pressure,crystal structure,crystal cage fill fraction,porous media,salinity,additive and microemulsion.It is pointed out that reinforcement of the reaction procedure by multi measures is the research emphasis in the future,and the research provides a newthought for CO2subsea preservation and natural gas hydrate expoitation.
CO2; exploitation; natural gas hydrate; influencingfactor
TE133
A
2011-06-29;
2011-08-05
任德剛,1969年生,男,高級工程師,從事火力發電設計和管理工作。地址:(100120)北京市西城區安德路 65號。E-mail:dgren@cpecc.net
1673-8926(2011)06-0124-04
王會玲)

