甜菊醇及其衍生物的研究進展
胡艷秋 石 浩
(浙江工業大學,浙江 杭州 310014)
0 前言
甜葉菊又名甜菊,屬菊科、斯臺維亞屬的多年生草本植物。原產南美巴拉圭與巴西兩國交界的阿曼拜山脈中,當地土著族很早就將甜菊作為糖料使用,比如做甜茶、飲料等。
甜菊糖苷(steviol glycosides,SGs)是從甜葉菊葉片中提取出來的一類天然甜味劑,到目前為止,至少已分離出8種不同甜度的糖苷。其中Stevioside為主要成分,甜度為蔗糖的143倍,而熱量僅為蔗糖的1/300,甜味好,特別適合三高人群。通過致突變、致癌、致畸試驗及急性毒性和亞急性毒性研究表明,甜菊苷具有安全低毒的特點,已獲得了中國衛生部、中國食品添加劑協會、美國食品及藥物管理局(FDA)的認證,在全世界廣泛地用作天然甜味劑或營養食品補充劑。
甜菊醇(Steviol)為甜菊苷的苷元,分子具有對映-貝殼杉烯型四環二萜骨架結構,而對映-貝殼杉烯型二萜類化合物大多具有廣泛的生理活性,如清熱解毒、抗菌消炎、抗腫瘤等作用[1-2]。藥理研究顯示,甜菊醇可降低倉鼠腸道內的ATP含量和吸收面積,從而抑制葡萄糖的吸收,并可以降低線粒體酶的活性而不影響Na+、K+、ATP酶的活性[3]。Kelmer-Bracht等通過對甜菊中的成分對大鼠肝臟線粒體的影響研究發現,甜菊醇對氧化磷酸化具有一定的抑制作用,而其對ATP/ADP轉化和氧化磷酸化的抑制作用,可能是通過對磷酸化的解耦聯作用及對呼吸鏈酶的抑制作用實現的[4]。
1 甜菊醇的制備
1.1 化學合成法
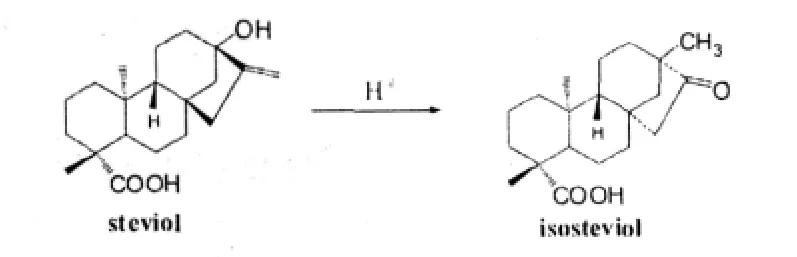
甜菊醇在酸性條件下不穩定,易發生Wagner-Meerwein重排,從而變成其同分異構體異甜菊醇,所以不能通過甜菊苷酸水解的方法制備。1963年Mosetting等人[5]首次報道確定了甜菊醇和異甜菊醇的絕對構型:
在20世紀80年代,Ogawa等[6]報道了甜菊醇的化學合成方法。甜菊醇可由甜菊苷(stevioside)經高碘酸鈉或四醋酸鉛氧化,再經堿水解得到:
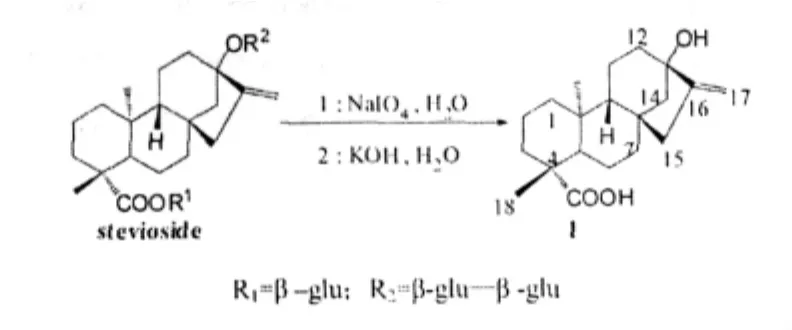
此法需要大量的高碘酸鈉將甜菊糖分子中的糖苷打成碎片,獲得的甜菊醇產率較低,且要經過多次的重結晶才能得到較純的產物。
1.2 蝸牛酶水解法
降解天然產物及多糖的方法已有很多報道,比如:化學水解法;專一性酶降解法;非專一性酶降解法。目前,國際上多采用酶法降解天然產物及多糖。我國學者劉鑄晉[7]曾報道了用蝸牛酶水解甜菊糖苷的方法。蝸牛酶中含有β-糖苷酶,在降解甜菊糖苷時以內切方式切斷β(1-4)糖苷鍵。具體的水解方法如下:

1.3 微生物發酵法
Oliveira等人[8]將甜菊糖置于含有赤霉菌Gibberella fujikuroi的培養基中培養,可得到甜菊醇。
1.4 從天然植物中提取分離得到
我國學者張巧云[9]以甜茶葉為原料,水提物經大孔樹脂吸附、75%乙醇洗脫、無水乙醇精制,得到甜茶葉總提取物。再經聚酰胺柱,硅膠柱層析和重結晶等方法從該提取物中分離得到了甜菊醇,這是首次從甜茶提取物中分得。
2 甜菊醇的結構修飾及其活性
甜菊醇的對映-貝殼杉烯型結構具有良好的生物活性,在醫藥領域有著廣闊的應用前景,因此,國內外研究人員對其進行了一系列結構修飾及活性研究。目前,對甜菊醇的結構改造大多集中在13位羥基、4位羧基以及16和17位的碳碳雙鍵部位。
2.1 13位羥基及4位羧基部位的化學結構修飾
經過多年的研究,人們認為甜菊醇C-16和C-17之間的一個雙鍵能影響細胞色素P-450傳遞的代謝活性,它能產生至今仍未被人們所認識的誘變因子。甜菊醇第13位羥基團是誘變的表現式,但在13位上的乙酰化會阻止其誘變活性。并且還發現具有代謝活性的甜菊醇在能觀察到有誘變活性的濃度范圍內是很有殺菌活力的[10]。
甜菊醇的環外雙鍵具有生物活性,但是它在酸性介質中又相當的不穩定,Khaibullin等人[11]采用了KOH-DMSO體系,對甜菊醇的4位羧基進行酯化反應,該方法有效地降低了甜菊醇在反應中發生重排的可能性。
根據生源學說,赤霉素和甜菊醇均由乙酸板塊通過甲瓦龍酸,貝殼杉烯酸等中間體次生代謝而來,它們具有同源性。在母體結構上,赤霉素和甜菊醇十分相似:
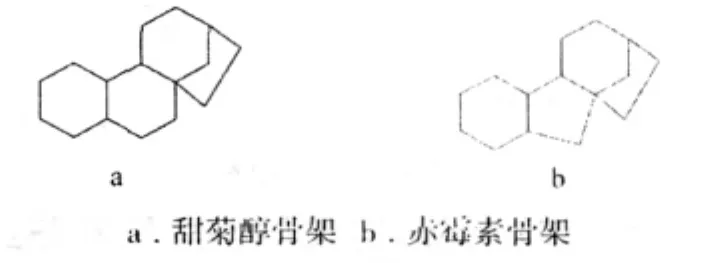
在植物體內的生物合成途徑中,凡在C-13位上具有羥基的赤霉素類似物的生物合成均可能經過了以甜菊醇為中間體的階段。因此,甜菊醇與赤霉素有著密切的關系,生物活性與赤霉素類似,能調節植物生長。甜菊醇與赤霉素的生長有關,促進赤霉素的生物合成。Bearder等[12]發現甜菊醇在赤霉菌突變體B1-14a的作用下,轉變為赤霉素GA1、HA19等。
柏正武等人[13]將一些生物活性基團和甜菊醇化合物連接合成8個化合物:
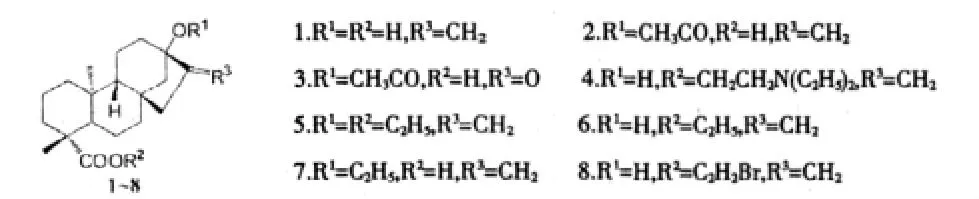
并將這些化合物和水對照,做了棉花拌種和小麥拌種試驗。其中化合物4、6、7、8對作物的生長有較好的促進作用,發芽率分別為75%、69%、69.5%、82.5%。甜菊醇對植物生長的促進作用可能是通過轉化為赤霉素而實現,以赤霉素的生理機能表現出來。
劉秀芳等人[14]以甜菊醇為起始原料,對其進行結構改造:
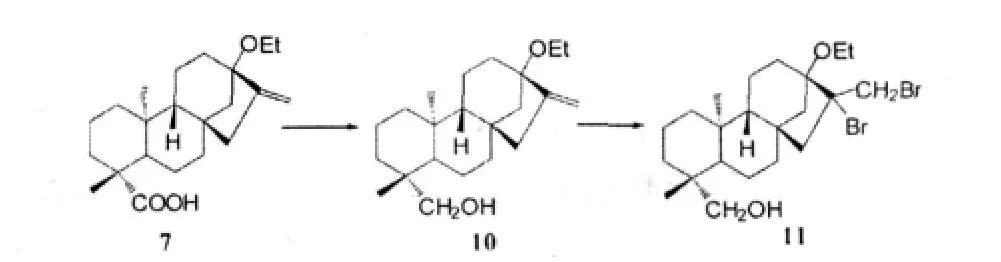
然后將這些化合物和赤霉素對照,做了水稻發芽試驗。發現在化合物10、11以及赤霉素的作用下,水稻的發芽率分別為98%、92%、100%,胚芽長為2.8cm、2.0cm、2.8cm。表明了這些化合物在促進水稻發芽、胚芽生長方面表現出與赤霉素相當的活性。
2.2 雙鍵部位的化學結構修飾
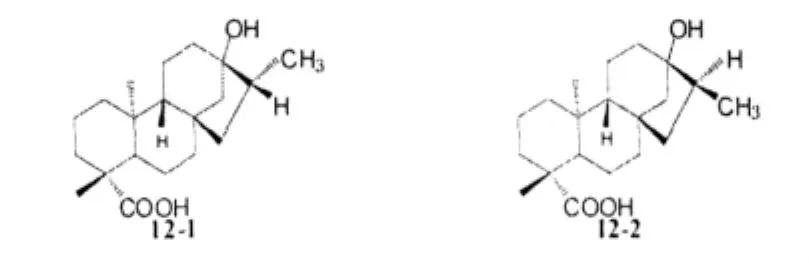
Khaibullin等人[15]采用了一種新的更為簡便的方法,對雙鍵進行氫化加成。新方法以Raney nickel為催化劑,用水合肼作為反應試劑,取代了之前用H2-Pd/C的反應體系(會產生差向異構體12-1和12-2),新的方法更經濟,而且立體選擇性強(反應只生成化合物12-1)。正如預期的一樣,反應所得化合物在濃度為20%的硫酸中加熱后,沒有發生重排。
2.3 形成二聚物
Lin L H等人[16]將甜菊醇的一系列衍生物在PyBOP和DIEA的作用下與脂肪烷基胺或脂肪烷基二胺反應,制備其酰胺二聚物,并運用MTT分析法研究了該系列化合物對癌細胞及人胚胎肺細胞的細胞毒素作用。研究結果發現化合物13對癌細胞株HL260、HepG2、H460及人胚胎肺細胞株MRC25有抑制作用。
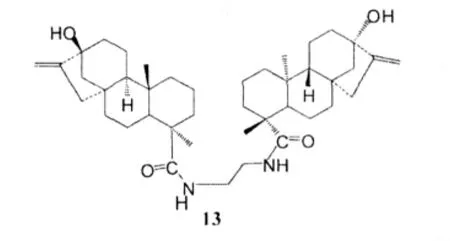
其IC50值(μmol·L-1)分別為4.3±0.3、17.9±0.3、10.7±0.65及17.0±1.2。通過對該化合物進行構效關系研究發現,二聚物對癌細胞不同的細胞毒作用與二聚物間不同的鏈長相關,這可能是由于不同的鏈長可以改變配體與受體間的相互作用,從而對生物活性產生影響。
2.4 甜菊醇的氧化
Hanson J R和Oliveira B H[17]利用黑曲霉菌和赤霉菌等真菌將甜菊醇進行了微生物轉化,生成化合物14,Yang L M等人[18]利用B.megaterium ATCC 14581,M.recurvatus MR 36,和A.niger BCRC 32720對甜菊醇進行結構修飾,得到了多個羥基代謝物(14-18)。
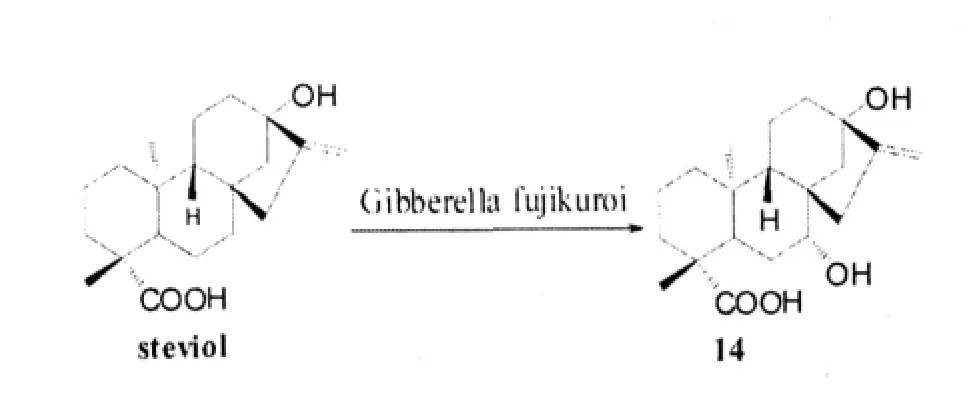
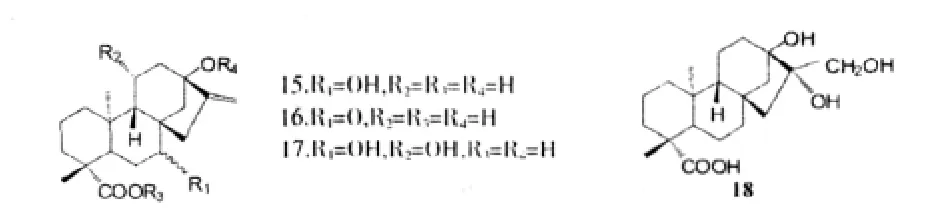
此研究證明,這種生物轉化羥基化的方法是區域選擇性和立體選擇性地引入羥基的一種非常有效的方法,也被應用于其他二萜型二萜化合物,而且,天然化合物的微生物轉化在腫瘤抑制劑的發展中具有很高的價值。
2.5 引入α-環外亞甲基環戊酮活性基團
對映-貝殼杉烯型二萜化合物具有廣泛的生理活性。其中,許多對映-貝殼杉烯型二萜化合物的抗腫瘤活性與其分子中具有α-環外亞甲基環戊酮結構有關,該結構可以與受體氨基酸的親核基團,如氨基、羥基等發生不可逆Micheal親核加成反應,從而體現出較好的抗腫瘤活性[19]。
由于具有α-環外亞甲基環戊酮結構的對映-貝殼杉烯型二萜化合物主要來自于天然產物,化合物來源有限。天然、廉價易得的甜菊醇亦具有對映-貝殼杉型結構,但因分子中沒有α-環外亞甲基環戊酮基團,抗菌、抗腫瘤活性不強。通過對甜菊醇分子的結構改造,向分子中引入α-環外亞甲基環戊酮活性基團,可獲得新的抗腫瘤先導化合物。
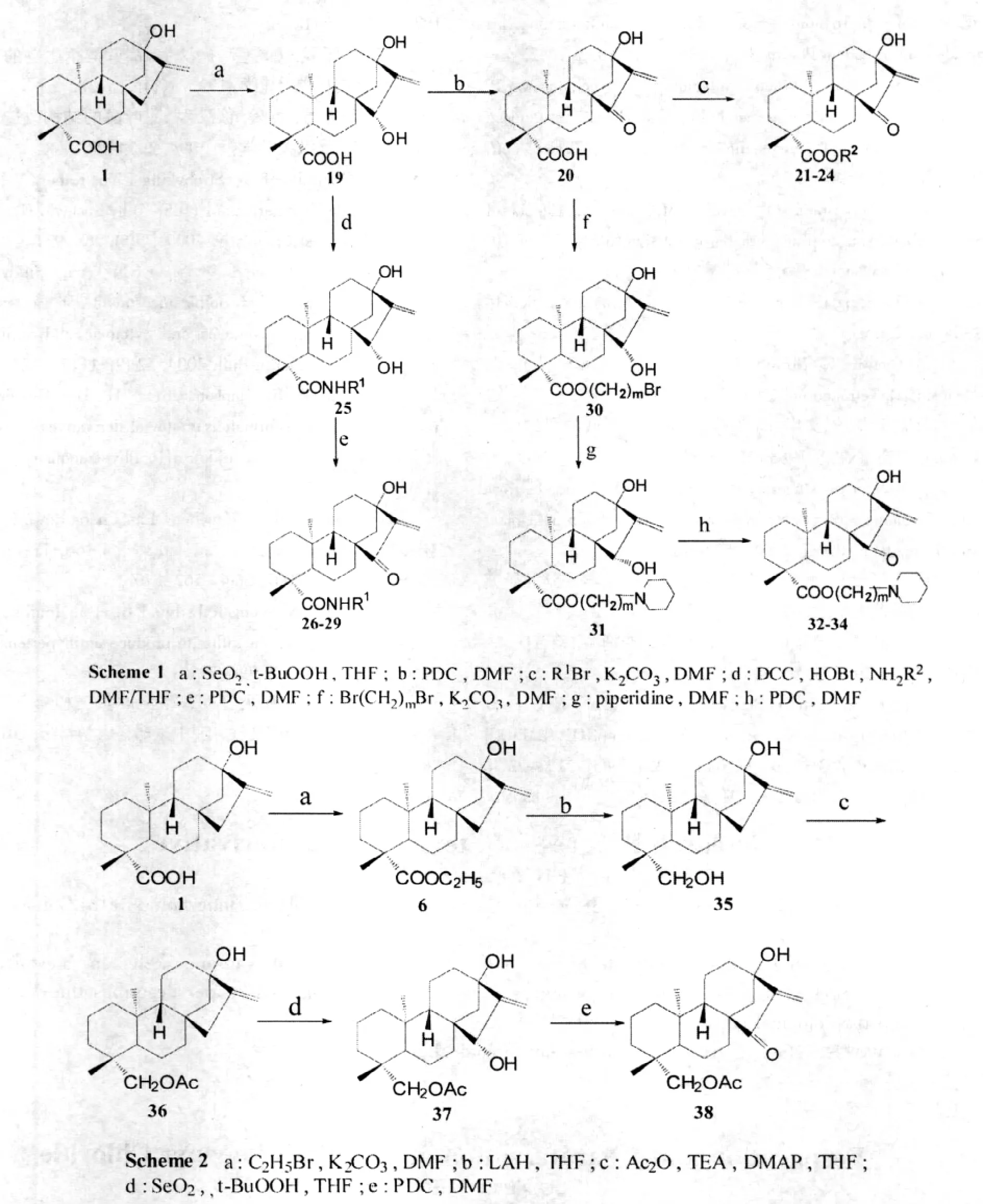
張大永等人[20]以甜菊醇為原料,向分子中引入了以α-環外亞甲基環戊酮為特征的活性基團,同時對C-4位羧基進行了修飾,以改善目標化合物的活性。因胺型二萜化合物易與α-環外亞甲基環戊酮反應,在制備含氮衍生物時,應首先進行羧酸的衍生化再構建α-環外亞甲基環戊酮基團。羥基保護時,因為位阻原因,相比C-19位羥基,C-13位羥基不易被乙酰化。目標化合物20-24、26-29、32-34(路線1)化合物38(路線2)的合成方法如下所示:
將目標化合物用人肝癌細胞系(BEL-7402),人卵巢癌細胞系(HO-8910),人乳腺癌細胞系(MCF-7)以及人急性粒細胞白血病細胞系(HL-60)進行活性測試。化合物20-24、26-29、32-34、38均表現出較好的細胞毒活性。事實證明了α-環外亞甲基環戊酮結構是關鍵的藥效基團。其中,酰胺化合物(26-29)表現出相對較好的抑制活性,可能與其較適中的油水分配系數有關。與單純酯基相比,在酯基端位上連接哌啶基的化合物(32-34)有較好的活性,判斷可能是哌啶取代基能增加水溶性,起到了增強細胞毒活性的作用。C-4位取代基類型對細胞毒活性影響較大。
3 結語
在藥物研發方面,目前臨床應用的藥物1/3以上源自天然產物。它們有的直接來自天然產物,有的是以天然產物的活性成分為先導進一步發展的衍生物、類似物或全合成產物。甜菊醇來源于甜菊苷,甜菊苷來源廣,毒副作用低,而且已實現工業化生產。因此,選擇甜菊醇作為先導化合物,利用前藥原理、拼合原理、生物電子等排原理等對其進行合理結構修飾,以改善其水溶性和脂溶性,改變其在體內的脂水分布系數,提高其生物利用度及選擇性,增強其藥理活性,進行新藥的研究與開發,將具有廣闊的應用前景。
[1]Fujita T,Takeda Y,Yuasa E,et al.Structure of inflexinol,a new cytotoxic diterpene from Rabdosia inflexa[J].Phytochemistry,1982,21(4):903-905.
[2]Fuji K,Node M,Ito N,et al.Terpenoids.L.Antitumor activity of diterpenoids from Rabdosia shikokiana var.occidentalis[J].Chem Pharm Bull,1985,33(3):1038-1042.
[3]Toskulkao C,Sutheerawattananon M,Piyachaturawat P.Inhibitory effect of steviol,a metabolite of stevioside,on glucose absorption in everted hamster intestine in vitro[J].Toxicol Lett,1995,80:153-159.
[4]Kelmer Bracht A,Alvarez M,Bracht A.Effects of Stevia rebaudiana natural products on rat liver mitochondria[J].Biochem Pharmacol,1985,34:873-882.
[5]Mosetting E,Beglinge U,et al.J.Am.Chem.Soc[J].1963,85:2305.
[6]Ogawa T,Nozaki M,Matsui M.Total synthesis stevioside[J].Tetrahedron,1980,36(18):2641-2648.
[7]劉鑄晉,周文華,高峰,等.甜葉懸鉤子葉的甜味成分研究[J].植物學通報,1983,01:33-37.
[8]Heleno de Oliveira,Bras,Ferreira da Trindade,Jose Luiz.Production of hydroxysteviol and its application as a plant growth regulator:Brazil,2004006278[P].2006-08-22.
[9]張巧云.廣西甜茶中甜茶素和其他化學成分的研究[D].廣西師范大學,2007.
[10]劉樹楷,鄭建仙.良好的天然甜味劑-甜菊苷[J].中國甜菜糖業,1992,3:50-58.
[11]Khaibullin R N,Strobykina I Yu,Kataev V E,et al.O-Alkylation of Diterpenoid Steviol in the System KOH-DMSO[J].Russian Journal of General Chemistry,2009,79(5):2197-2200.
[12]John R,Bearder J M,Colin M W.Phytochemistry,1975,14(8):1741.
[13]柏正武,劉秀芳,徐漢生.甜葉醇衍生物的合成及其生物活性[J].應用化學,1993,10(4):35-38.
[14]劉秀芳,黃曦,徐漢生.甜葉醇的結構改造及生物活性試驗[J].武漢大學學報,1994,2:74-78.
[15]Khaibullin R N,Strobykina I Yu,Kataev V E,et al.New Synthesis of Diterpenoid(16S)-Dihydrosteviol[J].Russian Journal of General Chemistry,2009,79(5):967-971.
[16]Lin L H,Lee L W,Sheu S Y,et al.Study on the stevioside analogues of steviolbioside steviol and isosteviol 19-alkyl amide dimers:synthesis and cytotoxic and antibacterial activity[J].Chem Pharm Bull,2004,52(9):1117-1122.
[17]JamesR Hanson,BrasH De Oliveira.The microbiological transformation of steviol derivatives by Rhizopus stolinifer and Gibberella fujikuroi[J].Phytochemistry,1990,29(12):3805-3807.
[18]Yang Li Ming,Hsu Feng Lin,Chang Shwu Fen,et al.Microbial metabolism of steviol and steviol 16α,17-epoxide[J].Phytochemistry,2007,68(4):562-570.
[19]Lee C N,Wong K L,Liu J C,et al.Inhibitory effect of stevioside on calcium Influx to produce antihypertension[J].Planta Med,2001,67:796-799.
[20]張大永,湯涌,王可,等.ent-貝殼杉烯型二萜化合物的合成及其抗腫瘤活性[J].中國藥科大學學報,2010,41(1):20-25.

