酪蛋白的轉谷氨酰胺酶酶促糖基化交聯條件及產物性質
姜淑娟,馮鎮,趙新淮
(東北農業大學乳品科學教育部重點實驗室,哈爾濱 150030)
酪蛋白的轉谷氨酰胺酶酶促糖基化交聯條件及產物性質
姜淑娟,馮鎮,趙新淮
(東北農業大學乳品科學教育部重點實驗室,哈爾濱 150030)
在氨基葡萄糖存在的條件下,利用轉谷氨酰胺酶(EC 2.3.2.13)對酪蛋白進行糖基化交聯修飾。以修飾酪蛋白產物中氨基葡萄糖的導入量為指標,采用單因素試驗分別考察反應體系pH值、酶添加量、反應溫度和時間對修飾反應的影響。優化后的適宜修飾條件為:酪蛋白底物質量濃度為30 g/L,氨基葡萄糖添加量為3 mol(每kg酪蛋白中)、pH值為7.5、酶添加量為10 kU(每kg酪蛋白中)、反應溫度為37℃、時間4 h。與酪蛋白和轉谷氨酰胺酶促交聯的酪蛋白相比,修飾酪蛋白產物的乳化性質和膠凝性質得到顯著改善,并且體外消化性能未受到影響,表明轉谷氨酰胺酶催化的糖基化交聯修飾可以用于改善酪蛋白的這些功能性質。
酪蛋白;轉谷氨酰胺酶;氨基葡萄糖;修飾;功能性質
0 引 言
鑒于糖基對蛋白質功能性質的影響和酶法修飾的優越性,許多人利用氨基糖和轉谷氨酰胺酶對食品蛋白質進行酶促糖基化修飾研究[1,2]。已有研究報導,利用氨基葡萄糖和轉谷氨酰胺酶實現酪蛋白的糖基化交聯,改善了酪蛋白修飾產品的溶解性質、起泡性質和黏度性質[3]。
本研究以酪蛋白為酰基供體、氨基葡萄糖為酰基受體、微生物轉谷氨酰胺酶為催化劑,對酪蛋白的糖基化交聯反應條件進行初步研究。以氨基葡萄糖導入量(mol/mol蛋白)為指標,單因素試驗考察反應體系pH值、酶添加量、反應溫度和時間的影響,并在最優條件下制備修飾酪蛋白產物,分析其乳化、凝膠性質和體外消化性能,以探討轉谷氨酰胺酶催化的糖基化交聯修飾對酪蛋白產物的影響作用。
1 實 驗
1.1 材料
酪蛋白,氨基葡萄糖鹽酸鹽(純度>99%),胃蛋白酶,胰蛋白酶,葡萄糖酸-δ-內酯,微生物轉谷氨酰胺酶,一級精煉大豆油,研究用水為去離子水,HPLC分析所用試劑為液相純,其他試劑均為分析純試劑。
1.2 主要設備
Waters 2695 HPLC系統,Foss 2300全自動凱氏定氮儀,LGJ-1型冷凍干燥機,DELTA 320型精密pH計,UV-2401PC型紫外可見分光光度計,BME100L高剪切混合乳化機,TA-XT2質構分析儀。
1.3 方法
1.3.1 酪蛋白的糖基化交聯修飾及修飾產物制備
在質量濃度為30 g/L的酪蛋白溶液中添加氨基葡萄糖至3 mol/kg(因為1 kg酪蛋白約含1 mol酰胺基團),保證蛋白質酰基供體與酰基受體的摩爾比為1︰3,用濃度為2 mol/L的NaOH調節pH值,添加一定量的酶液,混勻,置于37℃恒溫培養箱內振蕩反應。反應結束后,取出樣品,置于85℃水浴中滅酶5 min,冷卻。于4℃透析除去反應體系中未結合的氨基葡萄糖,樣品凍干。利用HPLC分析修飾酪蛋白產物中氨基葡萄糖的導入量,方法同參考文獻[3],這里不作介紹。
以酪蛋白修飾產物中氨基葡萄糖的導入量為指標,采用單因素試驗分別考察反應體系pH值、酶添加量、反應溫度和反應時間的影響,以選擇適宜的修飾反應條件。在優化的條件下制備修飾酪蛋白產物。交聯酪蛋白對照樣的制備方法同上,只是反應時不添加氨基葡萄糖,并與酪蛋白一起作為雙對照。
1.3.2 乳化活性及乳化穩定性的測定
方法見文獻[4]。用濃度為0.1 mol/L的磷酸鹽緩沖液(pH值為7.0)配制質量濃度為1 g/L樣品溶液。取75 mL蛋白樣品溶液與25 mL一級精煉大豆油混合,于12 000 r/min均質1 min,靜置10 min。 分別在0 min和靜止10 min時從容器底部取50 μL乳液置于試管中,加入5 mL質量濃度為1 g/L的SDS溶液,混勻,于500 nm處測定吸光度(以質量濃度為1 g/LSDS溶液調整儀器零點)。

式中:C為乳化前蛋白樣品溶液的濃度,g/mL;Φ為乳液中油相的體積分數,0.25;A0為乳液零時刻的吸光度;A10為乳液靜置10 min的吸光度。
1.3.3 膠凝性質的測定
(1)酸凝膠的制備。稱取一定量的樣品配制質量濃度為40 g/L的溶液(pH值至7.0)。在同等規格的圓筒容器中填充等體積的樣品溶液,加入一定量的葡萄糖酸-δ-內酯,攪拌均勻,置于40℃水浴中至pH值約為4.0,取出后4℃冰箱中保存,制得酸凝膠樣品。
(2)膠凝性質分析。取出凝膠樣品于室溫放置2 h,然后將待測凝膠樣品置于測定平臺上固定好,室溫下利用TA.XT-2型物性儀進行測量。以質構剖面分析法(TPA)測定凝膠的硬度和彈性等各項結構參數。所選用的探頭為物性儀配備探頭(型號為P/0.5)。重復測定3次,結果以平均值±標準偏差表示。
1.3.4 體外消化性能的分析[5,6]
一步水解法(胃蛋白酶水解):取10 mL質量濃度為10 g/L的樣品分散液(pH值為2.0),加入2 mg胃蛋白酶,于37℃水解2 h。加入等體積質量濃度為200 g/L的TCA溶液終止反應,在10 000 g下離心20 min,收集上清液。
二步水解法(胃蛋白酶—胰蛋白酶水解):取10 mL質量濃度為10 g/L的樣品分散液(pH值為2.0),加入2 mg胃蛋白酶,于37℃水解1 h。水解結束,置于90℃水浴中滅酶5 min,冷卻后凍干。將凍干物重新溶解于10 mL濃度為0.2 mol/L磷酸鹽緩沖溶液(pH值為8.0)中,加入6 mg胰蛋白酶,于37℃繼續水解1 h。然后加入等體積質量濃度為200 g/L的TCA溶液終止反應,在10 000 g下離心20 min,收集上清液。
利用紫外分光光度計測定兩種方法所得水解上清液在280 nm處的吸光度,以反映蛋白樣品中可消化蛋白質的質量濃度,近而說明蛋白樣品的體外消化性能。
2 結果與討論
2.1 酪蛋白的修飾反應條件
考察反應體系pH值、酶添加量、反應溫度和時間單因素對酪蛋白修飾反應中糖基導入量的影響,單因素實驗,結果如圖1所示。
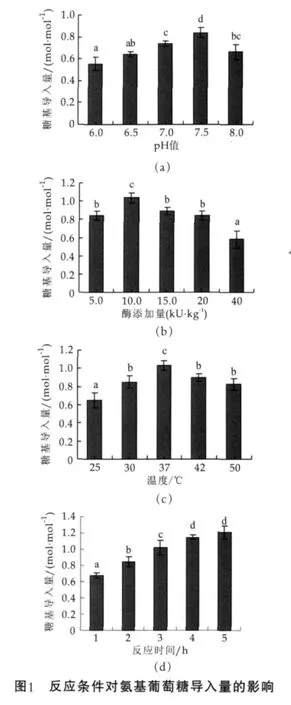
圖1中,糖基導入量以每摩爾酪蛋白中導入的氨基葡萄糖摩爾數表示。根據文獻,酪蛋白和氨基葡萄糖的分子質量分別以24 000 u和215 u計。數據均為3次重復實驗的平均值±標準偏差,不同的上標字母表明數據差異顯著(P<0.05)。
(1)反應體系pH值。固定酪蛋白底物質量濃度為30 g/L和氨基葡萄糖添加量為3 mol/kg,在酶添加量為5 kU/kg、溫度37℃、反應3 h時,反應體系pH值的影響如圖1(a)。 在弱酸性(pH<7.0)條件下,可能是由于氨基葡萄糖中氨基被質子化,多以-NH3+形式存在,糖基導入量較少;在中性或弱堿性(pH值為7.0~7.5)條件下,氨基葡萄糖的氨基以-NH2形式存在,其反應活性增加,pH值為7.5時,糖基導入量為最大,達到0.85 mol/mol酪蛋白。但在堿性(pH>7.5)條件下,可能是酶活力受限,或酪蛋白中游離ε-NH2競爭反應,氨基葡萄糖的導入量降低。
(2)酶添加量。固定酪蛋白底物質量濃度和氨基葡萄糖添加量,在pH值7.5,溫度37℃,反應3 h時,酶添加量的影響如圖1(b)。酪蛋白中糖基導入量隨酶量的增加而增加,在10 kU/kg時糖基導入最多,達到1.04 mol/mol酪蛋白;酶添加量繼續增加,糖基導入量反而下降。這是因為反應體系存在酪蛋白自身交聯與氨基葡萄糖導入兩個反應競爭發生,酶添加量過高會導致酪蛋白迅速交聯從而造成空間位阻,從而減少了氨基葡萄糖與蛋白底物結合位點接觸的機會。因此,酶添加量以10 kU/kg為宜。
(3)反應溫度。固定酪蛋白底物質量濃度和氨基葡萄糖添加量,在pH值為7.5,酶添加量為10 kU/kg,反應3 h時,溫度的影響如圖1(c)。隨著溫度升高,酪蛋白修飾產物中的糖基導入量增加,在度37℃得到最大糖基導入量(1.01 mol/mol酪蛋白);溫度高于37℃時,糖基導入量呈現下降趨勢。這可能是在弱堿性條件下,以糖胺形式存在的氨基葡萄糖不穩定發生氧化等反應,導致參與糖基化反應的氨基葡萄糖減少。
(4)反應時間。固定酪蛋白底物質量濃度為和氨基葡萄糖添加量,在pH值為7.5、酶添加量為10 kU/kg、37℃進行修飾反應,反應時間的影響如圖1(d)。在反應初始階段,酪蛋白修飾產物中氨基葡萄糖的導入量隨反應時間而顯著增加,反應4 h時糖基導入量達到1.15 mol/mol酪蛋白;反應時間繼續延長,而糖基導入量沒有顯著變化。因此,4 h為酪蛋白修飾反應的最適時間。
通過上述分析可知,當酪蛋白底物質量濃度為30 g/L、氨基葡萄糖添加量為3 mol/kg時,修飾反應的最優條件為:pH值7.5,酶添加量10 kU/kg,反應溫度37℃,反應4 h。
2.2 乳化性質
蛋白則提高12%。修飾酪蛋白產品、酪蛋白和交聯酪蛋白乳液的乳化穩定性指數分別為84.3%,70.5%和60.0%。與酪蛋白相比,交聯酪蛋白的乳化穩定性下降15%,而修飾酪蛋白則提高20%。整體上看,轉谷氨酰胺酶催化的糖基化交聯修飾,提高了酪蛋白的乳化活性特別是乳化穩定性。修飾酪蛋白產物表現出較好的乳化能力,可能與親水的葡萄糖基能夠促進蛋白質在油-水兩相界面吸附有關[7]。據報道,糖基化修飾提高蛋白質乳化穩定性,與糖-蛋白質結合體在界面重新定向排列有關:疏水的蛋白質殘基向油相排列,親水的糖基向水相排列,導入的糖基增加了蛋白質的表面親水性,從而阻礙了油滴的聚集和凝聚,因而形成的乳液更加穩定[8]。
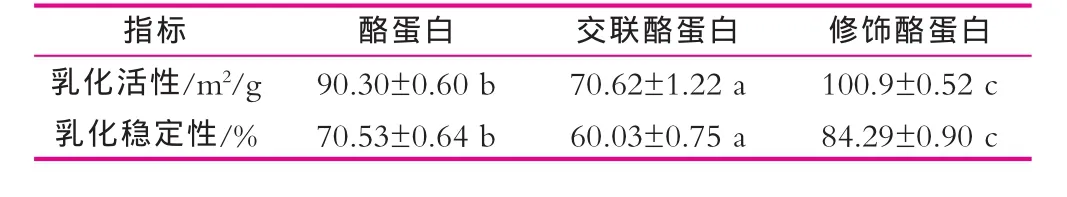
表1 酪蛋白、交聯酪蛋白和酪蛋白修飾產品的乳化性質
表1中的數據均為3次重復實驗的平均值±標準偏差,同一項指標內不同樣品數值后不同的小寫字母表明數據差異顯著(P<0.05)。
2.3 膠凝性質
根據酪蛋白的膠凝特性,利用葡萄糖酸-δ-內酯酸化的方法制得酪蛋白、交聯酪蛋白和修飾酪蛋白的酸凝膠,其膠凝性質評價結果如表2所示。質量濃度為40 g/L酪蛋白溶液所制酸凝膠的硬度和黏性都較小,相比之下相同濃度交聯酪蛋白和修飾酪蛋白的膠凝性質發生顯著變化,主要表現為:交聯酪蛋白和修飾酪蛋白的酸凝膠硬度分別提高2.5倍和1.9倍,黏附性分別增加1.7倍和6.2倍。與酪蛋白和交聯酪蛋白的酸凝膠相比,修飾酪蛋白制備的酸凝膠硬度適中、黏性較大,顯然是蛋白交聯與糖基化修飾協同作用的結果。由于導入的葡萄糖基具有更好的的親水性能,凝膠持水更多,因此修飾酪蛋白產品所制酸凝膠的黏性很大。
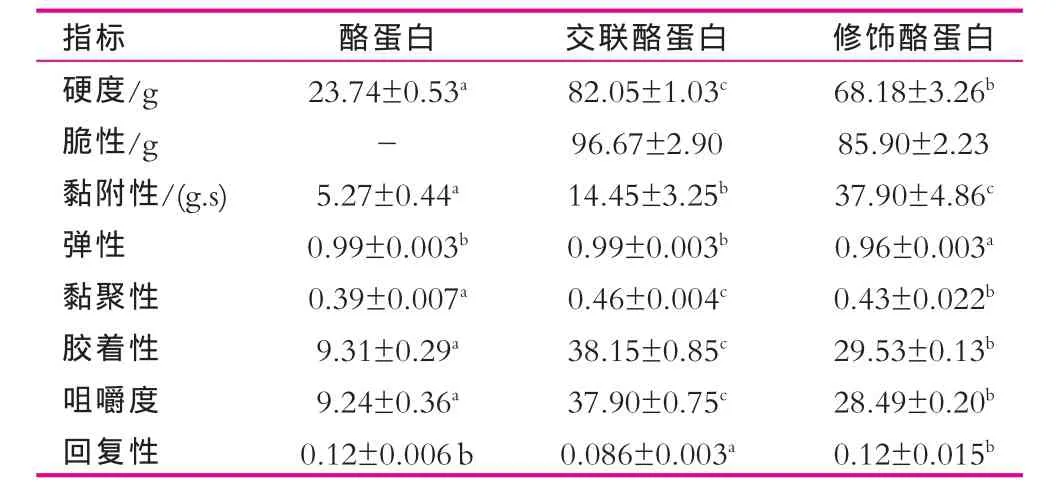
表2 酪蛋白、交聯酪蛋白和酪蛋白修飾產品的膠凝性質
2.4 消化性能
體外消化的方法模擬修飾酪蛋白在體內的消化利用情況。其中,一步水解法是用胃蛋白酶水解,模擬樣品在胃液中的消化利用情況;二步水解法是胃蛋白酶—胰蛋白酶水解,模擬樣品在腸內的消化利用情況。以水解上清液在280 nm處的吸光度值反映樣品經酶消化后釋放肽量的多少,結果如圖2所示。就胃蛋白酶的消化能力而言,修飾酪蛋白產物與酪蛋白相同,但交聯酪蛋白的胃蛋白酶的消化能力下降(肽量比酪蛋白減少27.5%)。在胃蛋白酶—胰蛋白酶模擬腸液消化中,交聯酪蛋白的消化性能與酪蛋白相同,修飾酪蛋白產物釋放的肽量比酪蛋白增加9.8%,表明修飾酪蛋白的消化能力稍好于酪蛋白。體外消化研究表明,在氨基葡萄糖存在條件下轉谷氨酰胺酶對酪蛋白的修飾作用不會損害酪蛋白的消化能力。
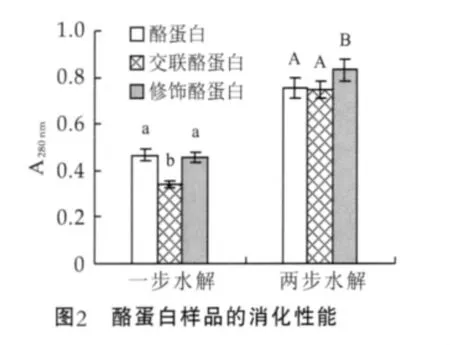
圖2中,數據均為3次重復實驗的平均值±標準偏差,不同的上標字母表明數據差異顯著(P<0.05)。
3 結 論
(1)在酪蛋白底物質量濃度為30 g/L,氨基葡萄糖添加量為3 mol/kg的條件下,以修飾酪蛋白產物中氨基葡萄糖導入量為指標,通過單因素試驗得到適宜的條件:pH值為7.5,酶添加量為10 kU/kg,溫度為37℃,時間為4 h。
(2)轉谷氨酰胺酶催化酪蛋白的糖基化交聯修飾改善了酪蛋白的一些功能性質。在蛋白質質量濃度為1 g/L時,修飾酪蛋白產物的乳化活性和乳化穩定性比酪蛋白分別提高12%和20%。與酪蛋白酸凝膠相比,相同濃度修飾酪蛋白產物制備的酸凝膠,硬度適中,黏性較大。同時,體外消化研究顯示修飾酪蛋白產物的消化性能未受到損害。
[1]VILLALONGA R,FERN?NDEZ M,FRAGOSO A,et al.Thermal Stabilization of Trypsin by Enzymatic Modification with β-Cyclodextrin Derivatives[J].Biotechnology and Applied Biochemistry,2003,38(1):53-59.
[2]PIERRO P D,CHICO B,VILLALONGA R,et al.Transglutaminase-Catalyzed Preparation of Chitosan–Ovalbumin Films[J].Enzyme and Microbial Technology,2007,40(3):437–441.
[3]姜淑娟,趙新淮.酪蛋白的轉谷氨酰胺酶氨基葡萄糖修飾與功能性變化[J].中國乳品工業,2010,38(9):8-11.
[4]PEARCE K N,KINSELLA J E.Emulsifying Properties of Proteins:E-valuation of a Turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716–723.
[5]MARCINIAK-DARMOCHWALL K,KOSTYRA H.Influence of NonenzymaticGlycosylation(Glycation)ofPeaProtein(pisum sativum)on Their Susceptibility to Enzymatic Hydrolysis[J].Journal of Food Biochemistry,2009,33(4):506–521.
[6]YIN S W,TANG C H,WEN Q B,et al.The Relationships between PhysicochemicalPropertiesandConformationalFeaturesof Succinylated and Acetylated Kidney Bean(Phaseolus vulgaris L.)Protein Isolates[J].Food Research International,2010,43(3):730-738.
[7]BAEZA R,CARRERA SANCHEZ C,PILOSOF A M R,et al.Interactions of Polysaccharides with β-Lactoglobulin Adsorbed Films at the Air-Water Interface[J].Food Hydrocolloids,2004,19(2):239-248.
[8]WOOSTER T J,AUGUSTIN M A.β-Lactoglobulin-Dextran-MaillardConjugates:TheirEffectonInterfacialThicknessand Emulsion Stability[J].Journal of Colloid and Interface Science,2006,303(2):564-572.
Optimal conditions to glycosylate and cross-link casein by transglutaminase and some functional properties of the modified product
JIANG Shu-juan,FENG Zhen,ZHAO Xin-huai
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Glycosylation and cross-linking of casein catalyzed by transglutaminase in presence of glucosamine was studied in this work.When the concentration of casein was fixed at 3%(w/v)and glucosamine added to the final concentration of 3 mol glucosamine/kg casein,the content of glucosamine conjugated in the modified casein product was used as an index,the pH of reaction system,addition level of transglutaminase,reaction temperature and time were studied by single factor experiments.The optimal modification conditions final selected were as fellow:a pH of 7.5,enzyme addition level of 10 kU/kg casein,temperature of 37℃and reaction time of 4 h.Compared to the original casein and the cross-linked casein by transglutaminase,the modified casein product exhibited markedly improved emulsifying and gelation properties;moreover,its digestibility in vitro wasn’t impaired upon this modification.Our results indicated that glycosylation and cross-linking of casein catalyzed by transglutaminase could improve these important properties of casein.
Casein;transglutaminase;glucosamine;modification;functional property
Q936
A
1001-2230(2011)07-0025-04
2011-01-04
黑龍江省高等學校科技創新團隊建設計劃項目(項目編號2010td11),東北農業大學創新團隊發展計劃資助項目(項目編號CXT007-1-1)。
姜淑娟(1981-),女,博士研究生,從事食品蛋白質研究。
趙新淮

