冷適應對一株植物乳桿菌膜脂肪酸組成和膜蛋白表達的影響
王勝男,王淼
(1.東北農業大學 乳品科學教育部重點實驗室,哈爾濱 150030;2.黑龍江省乳品工業技術開發中心,哈爾濱 150086)
冷適應對一株植物乳桿菌膜脂肪酸組成和膜蛋白表達的影響
王勝男1,2,王淼2
(1.東北農業大學 乳品科學教育部重點實驗室,哈爾濱 150030;2.黑龍江省乳品工業技術開發中心,哈爾濱 150086)
從15株乳桿菌中篩選出一株冷敏感性較高的菌株(植物乳桿菌KLDS1.0703),研究冷適應對該株菌細胞膜脂肪酸組成和膜蛋白表達的影響。根據生長速率與溫度(開氏溫度)相關性的Arrhenius曲線及冷適應時間對存活率的影響,確定該菌株的冷適應條件為:培養至對數中期,10℃冷適應處理4 h。應用GC/MS分析冷適應前后菌體的膜脂肪酸組成發現,脂肪酸18:1△9c的結構中不飽和鍵由反式轉變為順式;應用雙向電泳分析冷適應前后菌體的膜蛋白質組成,分析找到23個差異表達的蛋白點,其中3個為特異表達蛋白質點。結果表明,冷適應處理誘導植物乳桿菌KLDS1.0703膜脂肪酸結構向熔點降低方向轉變,而且膜蛋白質出現特異性表達。
植物乳桿菌;冷適應;細胞膜脂肪酸;細胞膜蛋白
0 引 言
據報道,對乳桿菌預先進行冷適應處理能夠提高細胞在冷凍條件下的存活率[1]。菌體對冷適應或冷應激應答,發生適應性調節,導致細胞膜脂肪酸和膜上蛋白質表達變化,進而降低冷對細菌造成的傷害[2]。而細胞膜脂肪酸改變方式以不飽和度增加、碳鏈長度降低、甲基分支增加、出現甲基異構分支結構等為主[3]。
國內的學者研究發現,細胞脂肪酸和蛋白質的改變有利于細菌的低溫存活[4-6]。并且從基因角度證實了冷誘導蛋白能夠提高菌體的抗凍特性[7]。
本研究以一株冷敏感性較高的菌株作為試驗菌株。通過凍-融實驗確定最佳的冷適應條件。應用GC/MS分析及雙向凝膠電泳方法,研究冷適應處理對試驗菌株細胞膜脂肪酸組成和細胞膜蛋白質表達的影響。該研究可為闡明乳桿菌冷凍抗性機理奠定基礎。
1 材料和方法
1.1 材料
供試菌株和培養基:植物乳桿菌(KLDS1.0702,KLDS1.0703,KLDS1.0704,KLDS1.0706,KLDS1.0708,KLDS1.0714,KLDS1.0715,KLDS1.0717,KLDS1.0724,KLDS1.0725,KLDS1.0728);嗜酸乳桿菌(KLDS1.0701,KLDS1.0732,KLDS1.0738);干酪乳桿菌1.0720。
主要儀器:高速冷凍離心機(GL-21M型),混勻器(VORTE-5型),超聲波破碎儀(JY92-ⅡD型)恒溫磁力攪拌器(HJ-3型),氣-質聯用儀(6890-5973N),雙向凝膠電泳系統。
1.2 乳桿菌凍-融后存活率的測定
15株乳桿菌分別以3%接種量接種至10mL MRS培養基中,37℃培養至對數中期,調整細胞終菌數為107mL-1;離心(5 000 g,4℃,離心15 min)收集菌體,所獲菌體用PBS緩沖液清洗2次,離心,棄上清,收集菌體,懸浮于質量分數為0.9%生理鹽水中制成菌的懸浮液,以1 mL的量分裝至凍存管中,然后迅速于-20℃放置24 h后,取出于25℃水浴解凍5 min,采用標準平板菌落計數方法測定凍-融前后的活菌數,計算凍-融后的存活率。
1.3 冷適應處理條件的確定
以上述試驗獲得的凍-融后存活率最低的菌株為試驗菌株,確定冷適應處理條件。
試驗菌株Arrhenius曲線的建立:測定試驗菌株在不同溫度下的生長曲線。根據實驗室實際條件,在7~46℃溫度范圍內每間隔2℃選取1個測試溫度點,共選取14個溫度點。在不同培養溫度下,測定試驗菌株的生長曲線,選擇對數生長中期測定的OD值對時間作圖,得到直線斜率為k,再分別計算Ln(k),以Ln(k)對絕對溫度的倒數(1/T)作圖,獲得試驗菌株的Arrhenius曲線。
冷適應處理條件的確定:根據Arrhenius曲線確定的冷適應臨界溫度點,分別將10 mL培養至對數中期的培養物置于臨界點以下的不同試驗溫度下,保持4 h,冷適應處理后的菌體經凍-融后,計算其存活率,以不經冷適應處理的菌體為對照。選擇存活率最高的條件作為冷適應處理條件。
1.4 細胞膜脂肪酸組成的分析
1.4.1 細胞膜脂肪酸的提取
取約1 g的試驗菌株的菌體,加入7 mL甲醇:氯仿(2∶1,體積比)混合溶液。室溫條件下渦旋2 h,迅速置于4°C條件下放置24 h,取出后5 000 g(4℃)條件下離心15 min,收集上清液備用;沉淀用3.75 mL甲醇∶氯仿∶水(2∶1∶0.8,體積比)混合溶液潤洗,5 000 g(4℃)條件下離心15 min收集上清液備用。將前面兩次離心所得上清液合并,在其中加入5 mL、4℃預冷的水∶氯仿(1∶1,體積比)轉換為雙向體系。用移液管移出氯仿(下相),此相包括細胞膜脂,迅速氮吹蒸發溶劑,獲得約50 μL的細胞膜脂,迅速加入1 mL(4℃)預冷的氯仿∶甲醇(1∶1,體積比)混合溶液,樣品于-20°C保存備用。
1.4.2 脂肪酸甲酯化
將所得細胞膜脂肪酸樣品重新氮吹,蒸發除去氯仿∶甲醇(1∶1,體積比)混合溶液,加入3 mL氫氧化鉀的甲醇溶液,70℃水浴回流5 min。冷卻后加入1 mL三氟化硼乙醚溶液70℃水浴回流5 min,冷卻。加入3 mL正己烷提取3次。合并提取液,用甲醇潤洗,移除上層溶液。加入飽和氯化鈉,放置3~5 min,氮氣吹干,1 mL正己烷定容,獲得脂肪酸甲酯待測樣品。
1.4.3 脂肪酸分析
氣相色譜分析條件:采用HP-5彈性石英毛細管柱(30 m×0.25 mm×0.25 μm),進樣口溫度250℃,載氣為高純氦氣,柱流速1 mL/min,柱前壓73.0 kPa,柱起始溫度70℃,保持2 min,以5℃/min升至230℃,保持20 min,再以5℃/min升至280℃,保持15 min,分流進樣1 μL,分流比20∶1。
質譜分析條件:用電子轟擊源(EI)分析,電子能量70 eV,離子源溫度200℃,接口溫度250℃,選取全程離子碎片掃描(SCAN)模式,質量掃描范圍40~650,溶劑延遲3.5 min。
1.5 細胞膜蛋白質表達譜分析
1.5.1 細胞膜提取
冷適應處理前后的試驗菌株的菌體養至對數中期,離心(5 000 g,4℃,15 min),收集到的菌體在PBS中清洗2次,再離心(5 000 g,4℃,15 min)。 將收集到的菌體均勻分散于質量分數為0.001%的PMSF的緩沖液[Tris–HCl(20 mmol/L),pH=7,EDTA(1 mmol/L)]中,超聲波破碎(破碎條件:工作5 s,間歇15 s,功率800 W)15 min,用革蘭氏染色的方法觀察細胞破碎程度,然后10 000 g(4℃)條件下離心5 min,棄沉淀,上清以75 000 g(4℃)條件離心30 min,沉淀(菌膜)溶于1 mL緩沖液中,放入-80℃保存備用。
1.5.2 膜蛋白樣品的制備
樣品室溫融解后,重懸于IEF緩沖液(濃度為8 mol/L尿素,質量分數0.02%的CHAPS,濃度為0.02 mol/L的DTT,質量分數為0.05%的IPG)中,充分放置,使樣品充分融解,呈透明狀態。采用Bradford方法測定蛋白濃度。
1.5.3 雙向電泳及圖像分析
IPGphor第一向等電點共聚焦電泳采用pH值為4~7的18 cm長IPG預制膠條,第二向SDS-PAGE(13.0%)按每一膠條40 mA電泳40 min后換用60 mA電泳5 h,銀染,采用ImageScanner光密度掃描儀掃描,并經ImageMasteTM2D Platinum6.0軟件分析蛋白質表達譜。
2 結果與分析
2.1 乳桿菌凍-融后的存活率
15株乳桿菌經凍-融后,其存活率如圖1所示,根據其存活率可以獲得對冷敏感的菌株。15株菌中,植物乳桿菌KLDS1.0703的存活率最低,為20.25%,該菌對凍-融最敏感,因此選用該菌為實驗菌株進行下面的試驗。

2.2 冷適應處理條件的確定
根據不同生長溫度條件下植物乳桿菌KLDS1.0703的生長速度,可以建立該菌的Ahrrenius曲線(圖2),在此曲線上可直接獲得熱適應、冷適應臨界溫度值以及最適合生長的溫度區域,進而確定冷適應溫度范圍。
由圖2可以看出,溫度對植物乳桿菌KLDS1.0703生長的影響有兩個拐點,分別為37℃和16℃,這兩個拐點將曲線分為3個區間,其中37~16℃區間為最適生長溫度區間,此溫度區間活化能基本恒定,表明此區間溫度對菌株KLDS1.0703生長速度不存在顯著性影響,且相對于其他培養溫度,37℃生長速率最高;在37~46℃區間,Ln(k)隨溫度的升高而降低,37℃為熱適應臨界溫度;在37~7℃區間,Ln(k)隨溫度的降低而降低,其中16℃為冷適應臨界溫度,因此冷適應處理應在此溫度以下。

根據實驗室實際條件,選擇16,13,10,7℃作為菌株KLDS1.0703冷適應處理溫度,分別處理4 h后,菌體再經凍-融處理后的存活率如圖3所示。由圖3可以看出,10℃處理4 h后,菌體經凍-融處理后的存活率最高,為71.94%,因此確定該菌株的冷適應條件為:培養至對數中期,10℃冷適應處理4 h。

2.3 冷適應對植物乳桿菌膜脂肪酸組成的影響
通過GC-MS法測定了植物乳桿菌KLDS1.0703冷適應前后菌體細胞膜脂肪酸的組成,如圖4所示。

通過SPSS 13.0軟件分析獲得冷適應前菌體細胞膜不飽和脂肪酸質量分數為55.21%,飽和脂肪酸質量分數為44.75%,不飽和脂肪酸與飽和脂肪酸的比例為為123.37%。在10℃條件下適應4 h后的冷適應菌體,其細胞膜不飽和脂肪酸質量分數上升至56.92%,而飽和脂肪酸質量分數下降為44.75%,不飽和脂肪酸與飽和脂肪酸的比例(U/S)為127.20%(表1)。結果表明:冷適應處理并未顯著影響該菌株的細胞膜飽和脂肪酸與不飽和脂肪酸的比例。
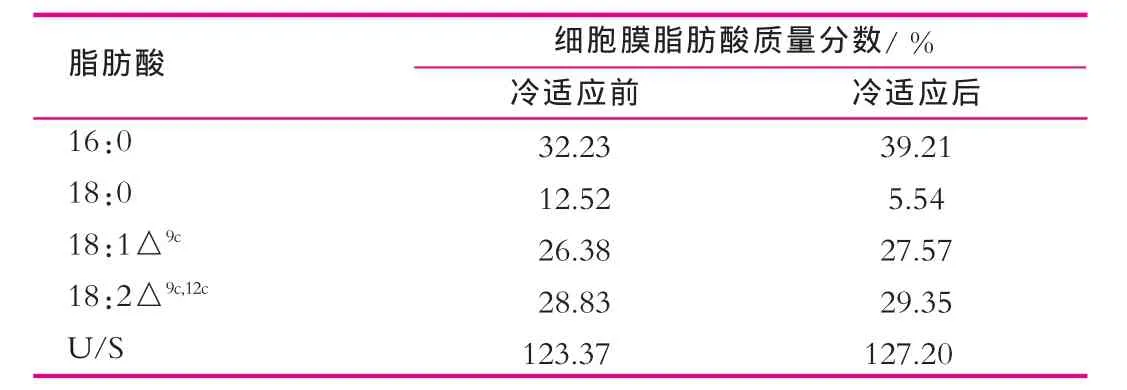
表1 冷適應對植物乳桿菌KLDS 1.0703細胞膜脂肪酸組成的影響
由表1可以看出,飽和脂肪酸16:0的質量分數增加了6.98%,18:0的減少了6.98%。此結果表明:在此冷適應條件下,植物乳桿菌KLDS 1.0703細胞膜飽和脂肪酸向短鏈脂肪酸轉化,進而使熔點降低。
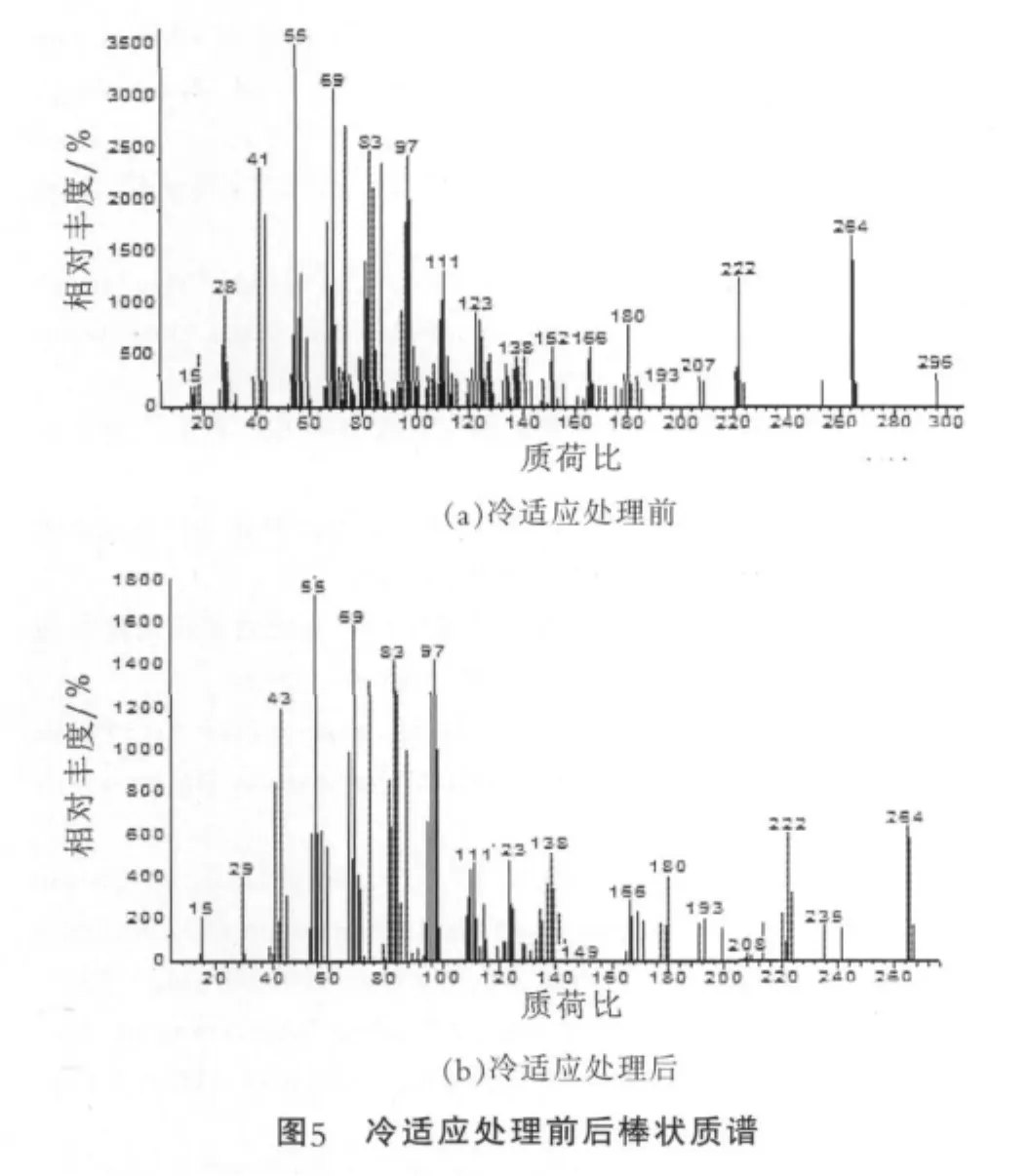
圖5為冷適應處理前后菌體細胞膜脂肪酸中的18:1△9c的棒狀質譜圖。 由圖5(a)可以看出,冷適應處理前菌體的18:1△9c的結構中不飽和鍵為反式;圖5(b)中,冷適應處理后菌體的18:1△9c的結構中不飽和鍵為順式。同一脂肪酸,順式不飽和脂肪酸比反式不飽和脂肪酸熔點更低。因此可推測:冷適應過程中,細胞膜脂肪酸的結構發生改變,以減低熔點,進而增強菌株對冷的耐受力。
2.3 冷適應對植物乳桿菌膜蛋白質表達的影響
采用BCA試劑盒測定得到,提取的植物乳桿菌KLDS1.0703冷適應前后菌體膜蛋白質質量濃度分別為7000 mg/L和7060 mg/L,此蛋白質濃度符合制備雙向凝膠電泳18cm膠條樣品的需要。應用ImageMasterTM2D Platinum 6.0軟件對蛋白質表達譜分析,在冷適應處理菌體的2次重復膠上分別檢測到812和801個蛋白點,平均有806個蛋白點;在未經冷適應處理菌體的2次重復膠上分別檢測到890和875個蛋白點,平均有882個蛋白點。兩膠匹配相關系數為0.863,匹配效果較好(圖6)。

冷適應菌體圖譜與未經冷適應的對照菌體圖譜匹配的蛋白點的相對體積值進行求熵運算,以3.5倍為標準,比值大于3.5(且蛋白點輪廓清晰)的即為認定的在冷適應后差異表達的蛋白點。經過分析找到23個差異表達的蛋白點(圖7)。
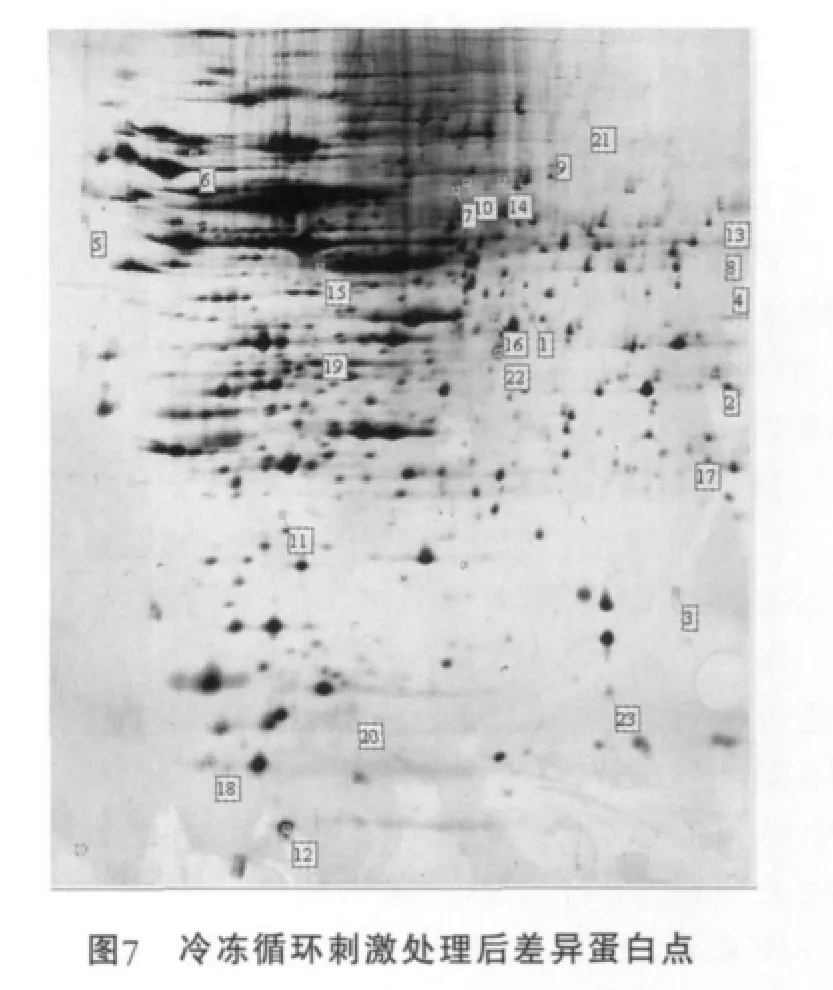
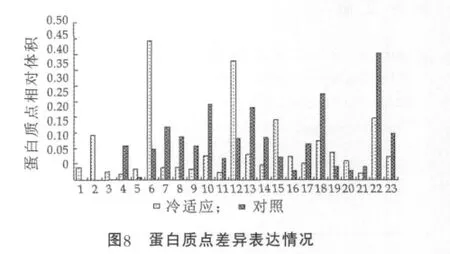
在凝膠的報告中分別找出這些差異表達的蛋白點的相對體積值,根據處理組與對照組圖譜中同一蛋白點的相對體積值的差異可以確定蛋白點的表達變化情況。將處理組圖譜中的23個蛋白點對應的相對體積值的平均值 (2次重復凝膠中同一蛋白點相對體積作均值運算得到的結果)與對照組的20個蛋白點對應的相對體積的平均值比較作圖(圖8)。結果顯示,蛋白點5,6,12,15,16,19,20上 調 表 達 ; 蛋 白 點4,7,8,9,10,11,13,14,17,18,21,22,23下調表達;蛋白點1,2,3只在冷適應處理膠上出現為特異表達。下調表達的蛋白點較上調表達的蛋白點多,說明冷凍適應對細胞膜上某些蛋白表達有抑制作用,同時也誘導產生新的蛋白。
3 討 論
3.1 冷適應處理對脂肪酸組成的影響
對單增李斯特氏菌(Listeria monocytogenes)的研究發現,冷適應處理后短鏈脂肪酸顯著增加[8],且冷凍抗性增強;嗜酸乳桿菌(Lactobacillus acidophilus CRL 640)冷適應處理后,冷凍抗性增強,不飽和脂肪酸(C18:2)比例顯著增加[9];對嗜酸乳桿菌(Lactobacillus acidophilus RD758)進行冷適應處理后,不飽和脂肪酸增加的同時,產生cycC19:0脂肪酸[10];對瑞士乳桿菌(Lactobacillus helveticus)和舊金山乳桿菌(Lactobacillus sanfranciscensis)冷適應處理后,發現存在cycC19:0脂肪酸,同時獲得細胞分子流動性或膜物理化學性能的適應性變化主要取決于短鏈脂肪酸的結論[11]。上述研究結果初步表明,不同菌株冷適應處理后,脂肪酸結構變化并不一致,但都向著熔點降低方向轉變。
本研究中并未出現不飽和脂肪酸比例、脂肪酸碳鏈長度的改變以及出現cycC19:0脂肪酸等的顯著變化,但脂肪酸18:1△9c的結構中,不飽和鍵由反式轉變為順式,同時冷凍抗性顯著增強。
3.2 細胞膜蛋白質差異表達
乳酸菌膜蛋白質不同于嗜冷菌的膜蛋白質,嗜冷菌能夠在低溫條件下保持結構上的完整性和催化功能。當生長溫度突然降低時,乳酸菌細胞會合成一組冷適應性蛋白[12],維持細胞正常生物學功能的發揮[13],進而提高乳酸菌對冷的耐受力,增加存活率。雙向凝膠電泳可有效地分離細胞膜蛋白質[14],在本研究的對照膠上出現3個特異表達蛋白質點,其分子量顯著高于冷休克蛋白,因此不屬于冷休克蛋白,對其特異表達的特性及功能有待深入研究。
4 結 論
本試驗通過比較15株乳桿菌的冷敏感性,獲得一株對冷較為敏感的植物乳桿菌KLDS1.0703,通過冷適應處理,該菌對的冷敏感性顯著降低;冷適應處理并未導致該菌細胞膜的不飽和脂肪酸與飽和脂肪酸比例出現顯著差異,但是其脂肪酸18:1△9c的結構中不飽和鍵由反式轉變為順式,有利于降低該菌的冷敏感性;且冷適應處理后該菌細胞膜蛋白質表達出現差異,出現特異性表達蛋白質。
[1]LEILA B,CATHY F G,DANIEL A,et al.Study of the Cryotolerance of Lactobacillus acidophilus:Effect of Culture and Freezing Conditions on the Viability and Cellular Protein Levels[J]?.?International Journal of Food Microbiology,2000,59(3):241-247.
[2]NICHOLAS J R.Bacterial Membranes:the Effects of Chill Storage and Food Processing[J].International Journal of Food Microbiology,2002,79:27–34.
[3]曹軍衛,沈萍,李朝陽.嗜極微生物[M].武漢:武漢大學出版社,2004:82-84.
[4]VIGH L,MARESCA B,HARWOOD J L.Does the Membrane’s Physical State Control the Expression of Heat Shock and Other Genes[J].Trends Biochem Sci.,1998.23:369-374.
[5]陳貴元,魏云林.冷適應微生物的研究現狀與應用前景[J].大理學院學報,2008,7(4):82-84.
[6]李晶,王繼華,崔迪,等.嗜冷菌適冷代謝機制的研究[J].哈爾濱師范大學學報:自然科學版,2007,23(5):88-91.
[7]張英華,雷雨婷,霍貴成.乳酸乳球菌中冷休克蛋白基因的高效表達及其抗凍保護作用[J].微生物學報,2008(9):27-30.
[8]SOFIA K M,ARVANITIS N.Cold Dependence of Fatty Acid Profile of Different Lipid Structures of Listeria Monocytogenes[J].Food Microbiology,2005(22):213–219.
[9]FERNANDEZ M L,MURGA G M C,et,al.Influence of Growth Temperature on Cryotolerance and Lipid Composition of Lactobacillus acidophilus[J].Journal of Applied Microbiology,2000(88):342–348.
[10]WANG Y,JEROME D.Influence of Cooling Temperature and Duration on Cold Adaptation of Lactobacillus acidophilus RD758[J].Cryobiology,2005,50(3):294-307.
[11]CHIARA M,SYLVAIN L.SADO K,et al.Synthesis of Cyclopropane Fatty Acids in Lactobacillus helveticus and Lactobacillus sanfranciscensis and Their Cellular Fatty Acids Changes following Short Term Acid and Cold Stresses[J].Food Microbiology,2010,27(4):493-502.
[12]RYOSUKE M,MIHO M.Very Rapid Induction of a Cold Shock Protein by Temperature Downshift in Thermus thermophilus[J].?Biochemical and Biophysical Research Communications,2010,399(3):336-340.
[13]劉志恒.現代微生物學[M].科學出版社.2002:475-476.
[14]MARTIN V,DERR K D,et.al.A High-Throughput Strategy to Screen 2D Crystallization Trials of Membrane Proteins[J].Journal of Structural Biology,2007,160(3):295-304.
Influence of cold adaptation on composition of membrane fatty acids and membrane proteins for Lactobacillus plantarum
WANG Sheng-nan1,2,WANG Miao2
(1.Key Lab of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbinn 150030,China;2.National Research Centre for Dairy Eng and Tech,Harbin 150086,China)
Abstrac:A most cold-sensitive strain was screened from 15 Lactobacilli strains(Lactobacillus plantarum KLDS1.0703).The objective of this paper is to investigate the influence of cold stimulation on the membrane fatty acids compositions and membrane protein expression of this strain.Lactobacillus plantarum KLDS1.0703 was most freeze-thaw sensitive among 15 strains.The condition of cold adaptation was that mid-logarithmic strain was cultured at 10℃for 4 h according to the Arrhenius curve and the survival rate of this strain.The membrane fatty acid were analyzed with GC/MS,and the unsaturated bond was transferred from the cis to trans for 18:1△9cunsaturated fatty acids.Analysis of 2D-EF gels revealed that there are 23 differentia protein spots and 3 specific expression protein spots after cold adaptation.It can be suggested that the structure of unsaturated fatty acids transform high to low melting point was stimulated by cold adaptation for L.plantarum KLDS1.0703,and specific expression protein spots were appeared.
Lactobacillus plantarum;cold adaptation;the membrane fatty acids;protein spots
Q93-33
A
1001-2230(2011)08-0018-05
2011-04-10
王勝男(1982-),女,碩士,研究方向為畜產品加工。

