四季桂花瓣色素的初步鑒定與提取方法
蔡 璇,蘇 蘩,金荷仙,姚崇懷,王彩云
(1.華中農業大學 園藝林學學院,湖北 武漢 430070;2.浙江農林大學 園林學院,浙江 臨安 311300;3.《中國園林》雜志社,北京 100835)
桂花Osmanthus fragrans為原產中國的木犀科Osmanthaceae園林觀賞植物,享有 “獨占三秋壓眾芳”的美譽,其樹姿優美,四季常綠,是中國傳統十大名花之一,不僅在園林中廣泛應用,而且因其濃郁的芳香而成為中國重要的特產天然香料資源[1]。前人以花色作為重要的分類依據,將桂花分為花色較淡的銀桂品種群、黃色系的金桂品種群、橙色系的丹桂品種群及黃白色的四季桂品種群[2]。桂花花瓣色素方面的研究較少,僅有李志州等[3]、儲敏[4]、王桃云等[5]在色素提取與穩定性方面以及陳洪國[6]將桂花開花進程中花瓣色素的變化作為衰老指標之一進行的研究報道。桂花色素鑒定和提取的實驗體系尚不夠完善,阻礙了桂花花瓣色素形成與結構的進一步研究。因此,本研究以四季桂Osmanthus fragrans‘Siji Gui’為材料,旨在探索其優化的花瓣色素鑒定條件以及黃酮類化合物和類胡蘿卜素的提取方法,為進一步開展桂花其他相關色素鑒定、提取和結構與代謝的研究奠定基礎。
1 材料與方法
1.1 試驗材料
試驗材料四季桂于2008年10月采自華中農業大學校園。采樣樹為樹齡40~50 a的健康植株,無病蟲害。選取盛花期、黃白色的花朵進行采摘。采后花瓣放于-70℃冰箱[5],試驗前置50~60℃烘箱中烘干,研成粉末后放于牛皮紙袋中于室溫下避光干燥保存待用[7]。
1.2 四季桂花瓣色素的初步鑒定
1.2.1 四季桂花瓣色素的顏色反應法鑒定 參考白新祥等[8]方法,準確稱取桂花花瓣粉末3份各0.1 g放于3個具塞試管中,分別加入體積分數為30%的氨水、體積分數為10%的鹽酸和石油醚5 mL,觀察并記錄試驗反應。
1.2.2 四季桂花瓣色素的紫外-可見光譜法鑒定 參考王桃云等[5]方法,準確稱取桂花花瓣粉末6份各0.1 g放于6個具塞試管中,分別加入甲醇、乙醇、石油醚、丙酮、丙酮 ∶乙醇(1∶1)、丙酮 ∶石油醚(1∶1)各10 mL,室溫下浸提1 h后,將色素提取液放置于1 cm石英比色皿中,用SHIMADZU UV-2450紫外可見分光光度計在190~600 nm范圍內進行掃描。
1.3 四季桂花瓣色素的提取
1.3.1 四季桂花瓣黃酮類化合物的提取 稱取15份四季桂花瓣粉末各0.01 g,分別以體積分數為25%,50%,75%,90%和100%的甲醇、乙醇和丙酮溶液[5]于室溫下浸提1 h,用于比較不同試劑的提取效果;稱取5份花瓣粉末各0.01 g,以10 mL體積分數為75%乙醇溶液作為提取劑,在室溫下分別浸提1.0,1.5,2.0,2.5,3.0和3.5 h,用于比較不同時間的提取效果;室溫下按料液比(花瓣粉末單位為 g,提取劑單位為 mL)1∶10,1∶20,1∶30,1∶40,1∶50,1∶60,1∶70,1∶80,1∶90和1∶100,用體積分數為75%乙醇溶液浸泡花瓣粉末1 h,用于比較不同料液比的提取效果;稱取5份花瓣粉末各 0.01 g,在室溫 25,30,45,60和75℃下各用10 mL體積分數為75%乙醇溶液浸提1 h,用于比較不同溫度的提取效果。根據單因素試驗結果,采用L9(34)正交表對提取條件進行優化(表1)。以上各試驗重復3次,濾液在黃酮類化合物的特征吸收峰 320 nm 處測定吸光值[9-10]。
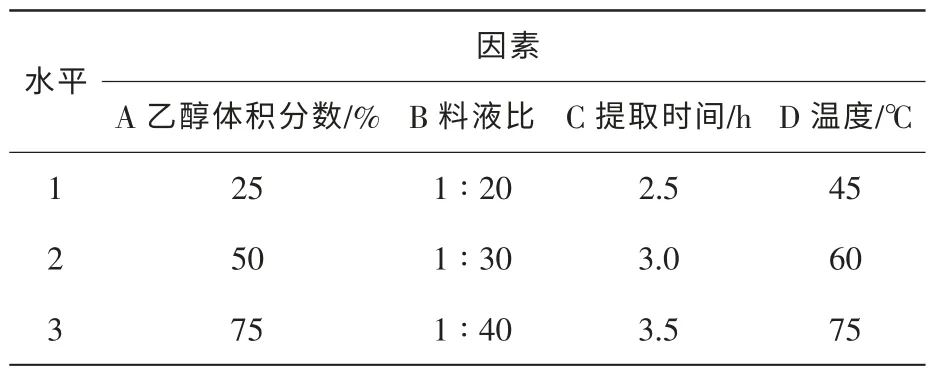
表1 四季桂花瓣黃酮類色素提取的正交試驗因素水平表 L9(34)Table 1 Petal flavonoids extracting orthogonal test factor level L9(34)of Osmanthus fragrans‘Siji Gui’
1.3.2 四季桂花瓣類胡蘿卜類色素的提取 稱取5份花瓣粉末各0.5 g,分別用10 mL的石油醚、乙酸乙酯、丙酮 ∶乙醇(1∶1)、丙酮∶石油醚(1∶1)和石油醚 ∶乙醇(1∶1)溶液[5]于室溫下浸提1 h,用于比較不同試劑的提取效果;稱取6份花瓣粉末各0.5 g,以10 mL乙醇 ∶丙酮(1∶1)溶液作為提取劑,在室溫下分別浸提 1.0,1.5,2.0,2.5,3.0和3.5 h,用于比較不同時間的提取效果;室溫下按料液比(花瓣粉末單位為g,提取劑單位為mL)為1∶20,1∶40,1∶60,1∶80和 1∶100,用乙醇 ∶丙酮(1∶1)溶液浸泡花瓣粉末 1 h,用于比較不同料液比的提取效果;稱取5份花瓣粉末各0.5 g,在室溫25,30,45,60和75℃下各用10 mL乙醇 ∶丙酮(1∶1)溶液浸提1 h,用于比較不同溫度的提取效果;根據單因素試驗結果,用L9(34)正交表對提取條件進行優化(表2)。以上各試驗重復3次,濾液在葉黃素、番茄紅素和胡蘿卜素的紫外最大吸收峰 443,472,502 nm 處測定吸光值[11]。
2 結果與分析
2.1 四季桂花瓣色素的初步鑒定
向四季桂花瓣的色素提取液中加入石油醚,浸提液表現為淺亮黃色,說明四季桂花瓣中含有類胡蘿卜素;加入體積分數10%鹽酸,浸提液呈現黃色,說明其中含有黃酮類化合物;加入體積分數30%氨水,浸提液呈現銹黃色,說明其中含有黃酮醇類化合物[8]。
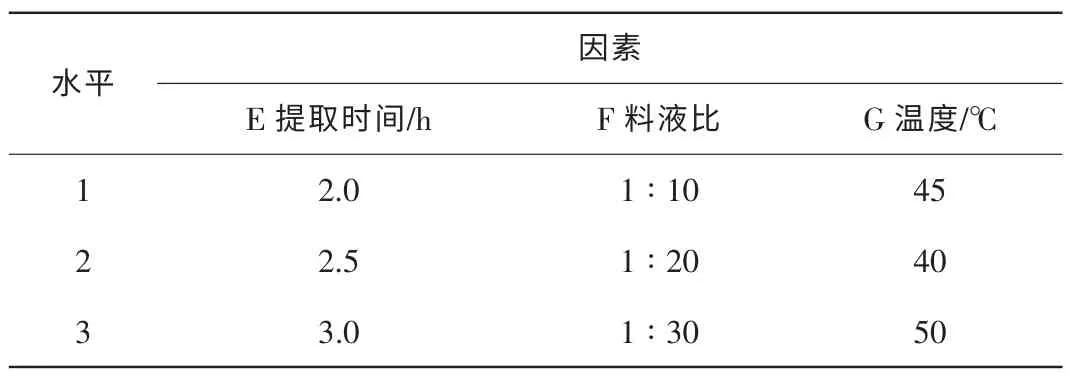
表2 四季桂花瓣類胡蘿卜類色素提取的正交試驗因素水平表 L9(34)Table 2 Petal carotenoids extracting orthogonal test factor level L9(34)of Osmanthus fragrans‘Siji Gui’
2.2 四季桂花瓣的吸收光譜特征
從圖1可知,四季桂花瓣色素提取液的最高吸收峰在320 nm處,為黃酮類化合物的特征吸收峰。以丙酮 ∶乙醇(1∶1)作為提取試劑時,浸提液在類胡蘿卜素的特征吸收峰處有波動現象,表明可能含有少量類胡蘿卜素[11]。
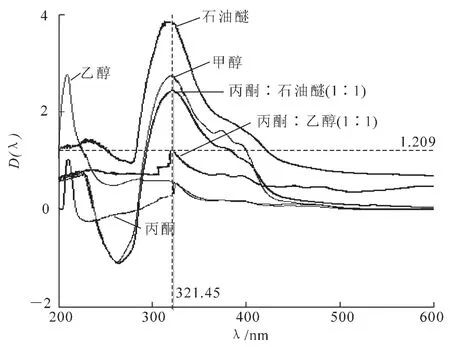
圖1 四季桂花瓣色素浸提液吸收光譜特征圖Figure 1 Absorption spectra characteristic of O.fragrans‘Siji Gui’petal pigment
2.3 四季桂花瓣黃酮類化合物的提取
2.3.1 提取劑、提取時間、溫度與料液比等單因素試驗 由表3可知,甲醇和乙醇對桂花色素的提取效果較好,丙酮較差。不同體積分數的溶劑提取效果也不同。其中,體積分數為25%甲醇提取效果雖好,但甲醇有毒,一般不采用[12];用體積分數為90%的乙醇提取效果也很好,但時間長了容易將葉綠素提取出來[13],所以應采用體積分數較低的乙醇溶液作為提取試劑。由圖2可見,提取時間為3 h時,提取效果最好;料液比在1∶20~40時對黃酮類化合物的提取效果最好;隨著溫度的升高,吸光度逐漸增大,但由于乙醇的沸點是78.5℃,所以提取溫度應在乙醇的沸點以下。
2.3.2 黃酮類化合物提取的最優工藝條件 根據表1的正交試驗因素水平,對黃酮類化合物的提取條件進行正交設計,見表4。各因子對提取率的影響依次為:提取溫度、提取料液比、提取劑體積分數和提取時間,最優工藝條件為:A2B1C2D3,即體積分數為50%的乙醇、料液比1∶20、提取時間3 h和溫度75℃。
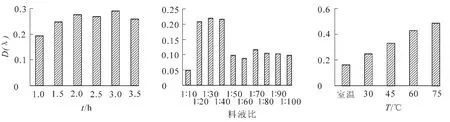
圖2 不同提取時間、料液比及溫度對四季桂花瓣黃酮類化合物的提取效果Figure 2 Effect of different extracting time,material-solvent ratios,and temperatures to extract petal flavonoids of Osmanthus fragrans‘Siji Gui’
2.4 四季桂花瓣類胡蘿卜的提取方法
2.4.1 提取劑、提取時間、溫度與料液比等單因素試驗 由圖3可以看出,石油醚與丙酮 ∶乙醇(1∶1)溶液提取的四季桂花瓣提取液在443,472和502 nm下的吸光度都很高。但由于石油醚溶液作提取劑時,四季桂花瓣粉末粘于試管壁,所以宜采用丙酮∶乙醇(1∶1)溶劑作為提取劑。提取時間為2.5和3.5 h時出現了波峰,但時間過長會引起溶劑揮發,導致提取物濃度的升高,因此提取時間為2.5 h較好。在料液比為1∶20時,有明顯的吸收峰。在提取溫度為45,60℃時均有吸收峰,但由于丙酮的沸點為56.5℃,乙醇的沸點為78.5℃,溫度為45.0℃時提取效果較好。
2.4.2 類胡蘿卜素提取的最優工藝條件 根據表2對類胡蘿卜素的提取條件進行正交試驗設計(表5)。由此可知,在不同的吸光度下,各因素對提取率的影響由大到小依次為:料液比、提取溫度和提取時間。其最佳工藝條件都為E3F1G3,即提取時間3 h,料液比1∶10,溫度50℃。
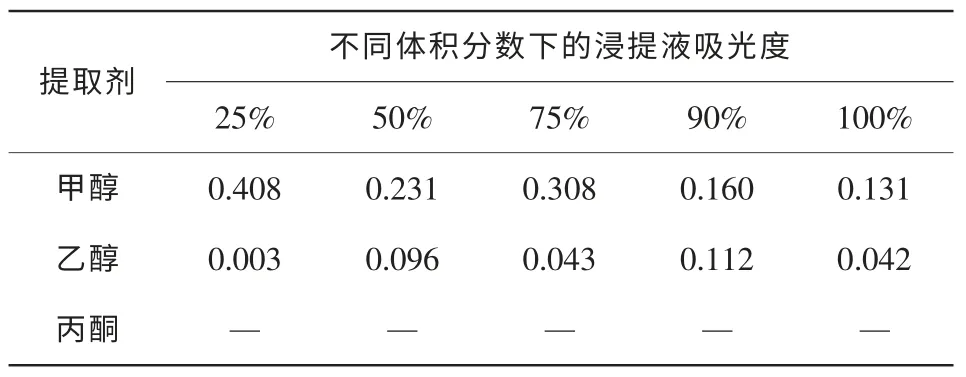
表3 四季桂花瓣不同提取劑各濃度下浸提液的吸光度(λ=320 nm)Table 3 Osmanthus fragrans‘Siji Gui’petal pigment absorbances of extraction solvents and different concentrations(λ=320 nm)
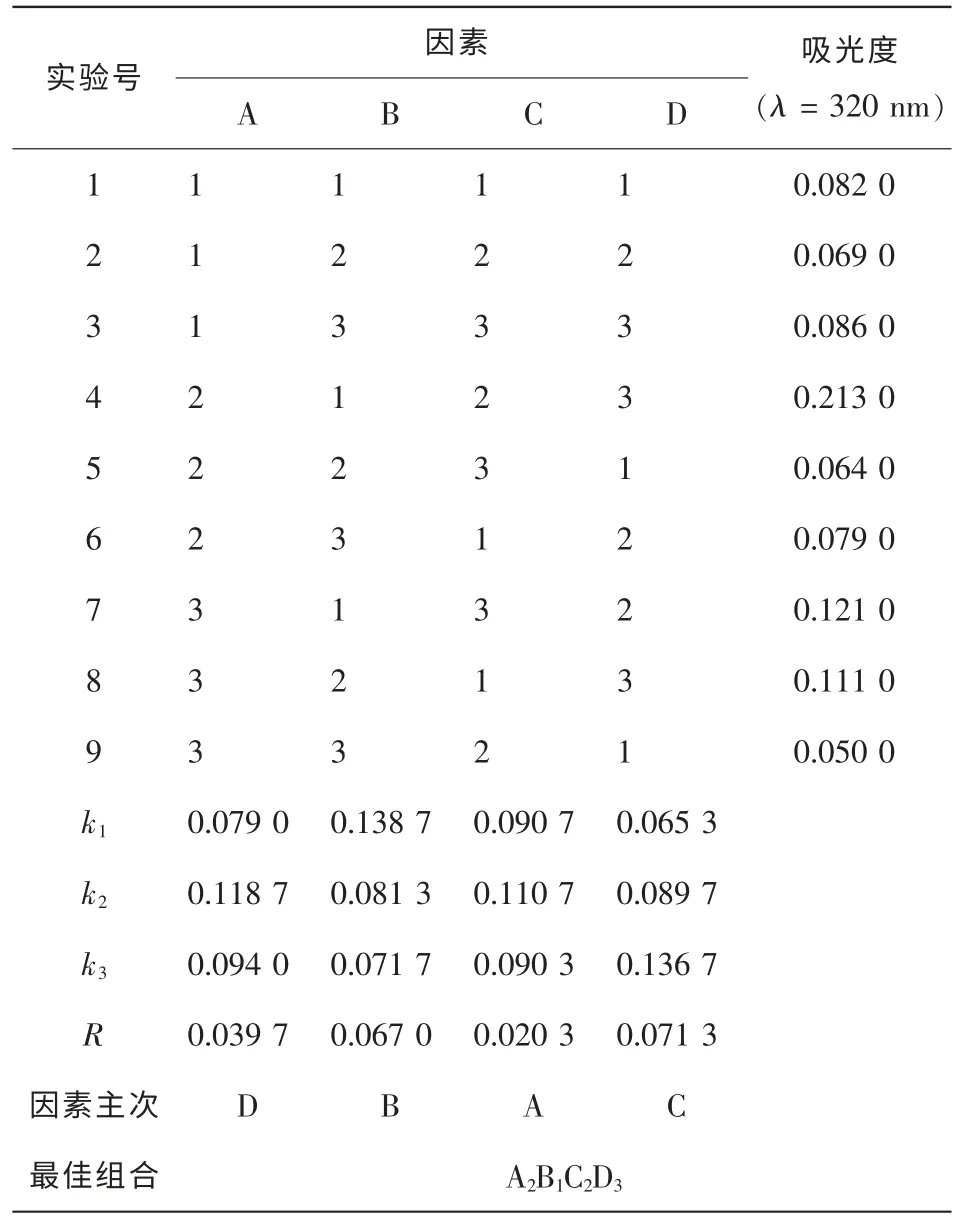
表4 四季桂花瓣黃酮類化合物提取的正交試驗結果Table 4 Orthogonal test results of extracting petal flavonoids of O.fragrans‘Siji Gui’
3 討論
黃酮類化合物易溶于甲醇、乙醇等溶劑,難溶于水,且在低濃度的甲醇中,其溶解性較好,所以甲醇一直被廣泛用于天然黃酮類化合物的提取[14]。但在玫瑰 Rosa rugosa 花瓣[15]的黃酮類色素提取工藝研究中發現,乙醇作為提取劑時,提取效果也很好,甚至超過甲醇;近幾年在提取八仙花Hydrangea macrophylla花瓣黃酮類化合物時,也有用乙醇作為提取劑[16]。鑒于甲醇的毒性,黃酮類化合物的提取純化產物多用于醫藥和食品,因此在本次試驗中選取體積分數為50%的乙醇為四季桂花瓣中黃酮類化合物提取的最佳試劑。選取1∶20的料液比在45.0℃的條件下浸提3 h時的效果最佳。本實驗所得的最佳提取條件與前人在桂花總黃酮含量測定試驗[17]中所得的結果略有差異,可能是由于選取的實驗材料及實驗環境不同。在對四季桂花瓣類胡蘿卜素的提取試驗中雖然發現用石油醚和丙酮 ∶乙醇(1∶1)作為溶劑提取效果都很好,但使用石油醚時,花瓣粉末易粘于試管壁,增加了純化回收的難度[7],因此本試驗選用丙酮 ∶乙醇(1∶1)溶液作為提取劑,以1∶10的料液比在50.0℃的條件下浸提3 h獲得最佳的提取效果。而本研究只選取了葉黃素、番茄紅素和胡蘿卜素作為類胡蘿卜素的代表進行分析,結果可能會有一定的局限性。而且黃酮類化合物和類胡蘿卜素的種類都十分豐富,因此在科研或生產中可根據實際情況對最佳提取條件進行選擇。下一步的工作是進一步分離純化或采用色譜質譜聯用、核磁共振等儀器確定色素物質的結構,從次生代謝產物水平分析不同桂花品種花色的差異與機理,也作為桂花花色育種工作的參考。
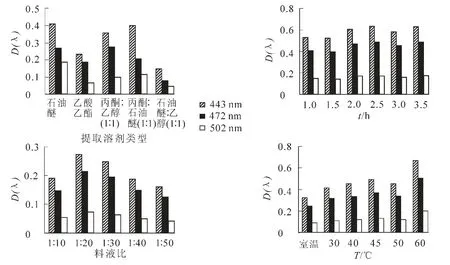
圖3 不同提取溶劑、提取時間、料液比及溫度對四季桂花瓣類胡蘿卜素的提取效果Figure 3 Effect of different solvent types,time,material-solvent ratios and temperature to extract petal carotenoids of Osmanthus fragrans‘Siji Gui’
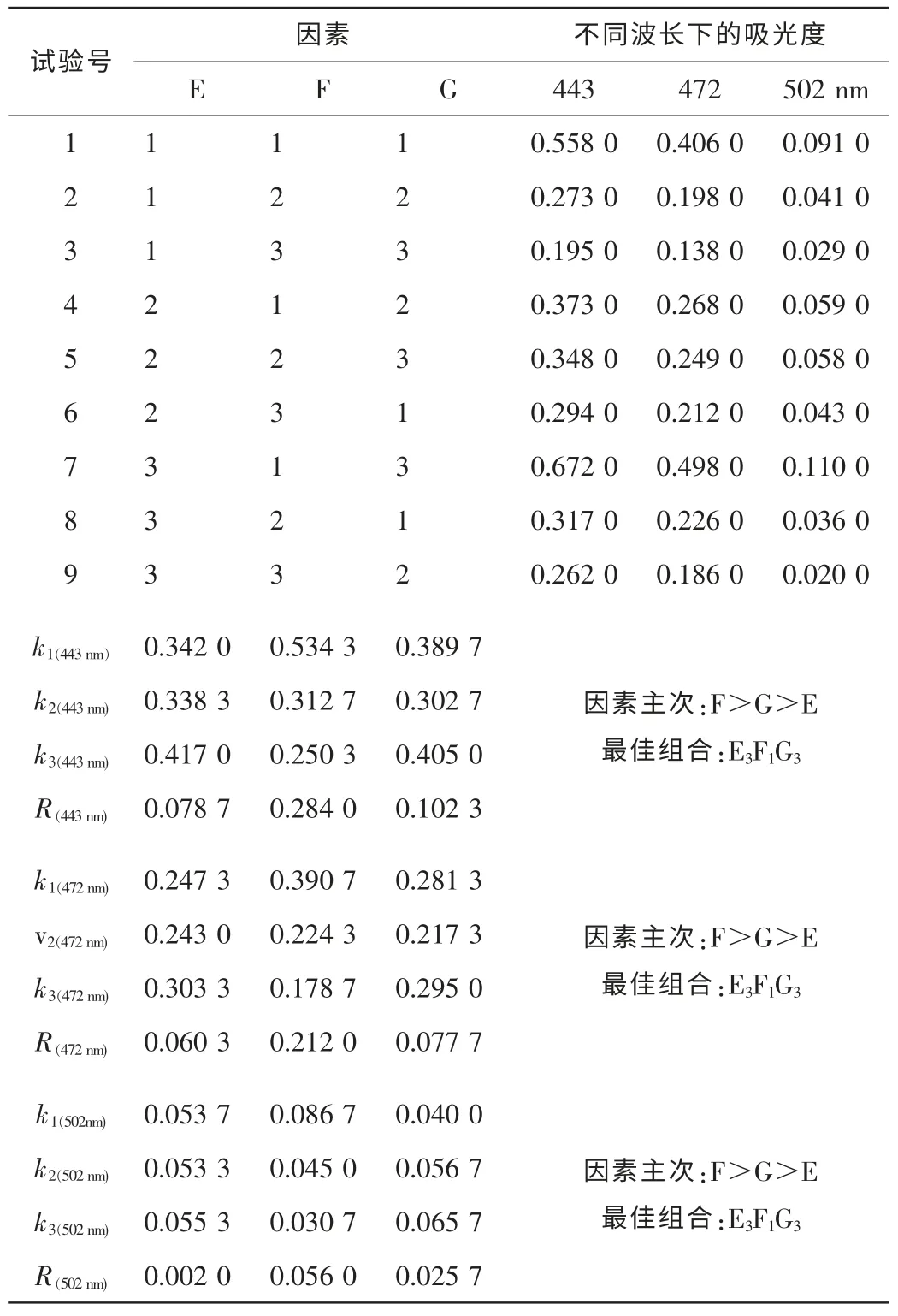
表5 四季桂花瓣類胡蘿卜素提取的正交試驗結果Table 5 Orthogonal test result of extracting petal carotenoids of Osmanthus fragrans‘Siji Gui’
[1]臧德奎.桂花品種分類研究[D].南京:南京林業大學,2004.ZANG Dekui.Studies on the Cultivar Classification of Sweet Osmanthus[D].Nanjing:Nanjing Forestry University,2004.
[2]劉玉蓮.桂花品種分類及木犀屬種質資源的利用[J].植物資源與環境,1993,2(2):44-48.LIU Yulian.Cultivar classification of Osmanthus fragrans Lour.and the development of germplasm resources of Osmanthus Lour.[J].J Plant Resour Environ,1993,2(2):44-48.
[3]李志洲,楊海濤.桂花色素的提取及其穩定性的研究[J].氨基酸和生物資源,2005,27(3):4-6.LI Zhizhou,YANG Haitao.Study on extraction and stability of pigment from Osmanthus[J].Amino Acids & Biotic Resour,2005,27(3):4-6.
[4]儲敏.金桂與丹桂醇溶性色素的提取及其穩定性比較[J].氨基酸和生物資源,2006,29(1):1-3.CHU Min.Extraction and stability of rthanol-solvent pigments from Osmamthus fragrans var.thunbergii and Osmamthus fragrans var.aurantiacus[J].Amino Acids & Biotic Resour,2006,29(1):1-3.
[5]王桃云,陳海華,張珍珍,等.桂花色素提取工藝的優化研究[J].蘇州科技學院學報:自然科學版,2009,26(1):44-48.WANG Taoyun,CHEN Haihua,ZHANG Zhenzhen,et al.An optimal study on extraction technology of pigment from Osmanthus fragrans[J].J Suzhou Univ Sci Technol Nat Sci,2009,26(1):44-48.
[6]陳洪國.桂花開花進程中花瓣色素、可溶性糖和蛋白質含量的變化[J].武漢植物學研究,2006,24(3):231-234.CHEN Hongguo.Changes of pigment,soluble sugar and protein content of petal during florescence and senescence of Osmanthus fragrans Lour.[J].J Wuhan Bot Res,2006,24(3):231-234.
[7]李娟.橙色大白菜類胡蘿卜素和黃酮提取測定方法及其積累規律的研究[D].楊凌:西北農林科技大學,2007.LI Juan.The Study of Extraction and Determination of Carotenoid and Flavonoids in Orange-Heading Chinese Cabbages and Its Accumulation[D].Yangling:Northwest A & F University,2007.
[8]白新祥,胡可,戴思蘭,等.不同花色菊花品種花色素成分的初步分析[J].北京林業大學學報,2006,28(5),57-63.BAI Xinxiang,HU Ke,DAI Silan,et al.Components of flower pigments in the petals of different color Chrysanthemum morifolium[J].J Beijing For Univ,2006,28(5):57-63.
[9]楊萬政,陳慧英,李道遠.玫瑰花紅色素及其穩定性研究[J].中央民族大學學報:自然科學版,2003,1(12):64-68.YANG Wanzheng,CHEN Huiying,LI Daoyuan.The extraction of natural rose pigment and the study of its stability[J].J Cent Univ National Nat Sci Ed,2003,1(12):64-68.
[10]PAN Yingming,ZHU Zhiren,HUANG Zhili,et al.Characterisation and free radical scavenging activities of novel red pigment from Osmanthus fragrans’seeds[J].Food Chem,2009,112:909-913.
[11]趙昶靈,郭維明,陳俊愉.梅花花色色素種類和含量的初步研究[J].北京林業大學學報,2004,26(2):68-73.ZHAO Changling,GUO Weiming,CHEN Junyu.Preliminary study on the categories and contents of the flower color pigments of Prunus mume[J].J Beijing For Univ,2004,26(2):68-73.
[12]曾凡坤,王中鳳,吳永嫻.甜橙皮類胡蘿卜素提取研究[J].西南農業大學學報,1994,16(4):327-329.ZENG Fankun,WANG Zhongfeng,WU Yongxian.On optimum conditions for extractiong carotenoids in sweet orange peel[J].J Southwest Agric Univ,1994,16(4):327-329.
[13]胡靜麗,陳健初.楊梅葉黃酮類化合物最佳提取工藝研究[J].食品科學,2003,24(1):96-99.HU Jingli,CHEN Jianchu.Study on the optimum extracting conditions of flavonoids from Myrica rubra leaves[J].Food Sci,2003,24(1):96-99.
[14]安田齊.花色的生理生物化學[M].北京:中國林業出版社,1989:60-75.
[15]杜鵑,張曉敏,徐金玉,等.玫瑰花中黃酮類色素的提取工藝研究[J].冷飲與速凍食品工業,2006,12(1):23-26.DU Juan,ZHANG Xiaomin,XU Jinyu,et al.Study of optimum extracting method of rose pigment[J].Beverage & Fast Frozen Food Ind,2006,12(1):23-26.
[16]蔣新龍.繡球花花、葉總黃酮的提取工藝和含量測定[J].麗水學院學報,2007,29(5):37-41.JIANG Xinlong.On extracting method of flavonoid from flowers and leaves of Hydrangea macrophylla[J].J Lishui Univ,2007,29(5):37-41.
[17]蔡健,王薇.桂花中總黃酮含量的測定[J].食品科技,2007(4):178-180.CAI Jian,WANG Wei.Determination of the total flavonoids in sweet-scented Osmanthus[J].Food Sci Technol,2007(4):178-180.

