殺蟲劑和除草劑的植物修復研究進展
李海濤, 葉 非
(東北農業大學理學院,哈爾濱 150030)
中國是一個農業大國,農藥的施用給糧食增產、有害生物的減少等都帶來了極大的益處;同時隨著其施用量的增加,也嚴重污染了土壤,對植物、動物和環境都帶來了巨大的危害。植物在接觸某些農藥后,其生理、生化代謝功能受到干擾,正常的生長發育過程受到影響;此外,植物還會從土壤中吸收農藥在體內殘留,導致農產品污染超標,并通過食物鏈造成牲畜的慢性中毒,最終影響人體健康。農藥的長期使用,不僅使土壤害蟲抗藥性不斷增強,也使有益于農作物的微生物、昆蟲、鳥類及大量害蟲的天敵遭受毒害;此外,噴灑到植物上的農藥大部分會降落到地面而殘留于土壤中,并會通過徑流、入滲污染地表水與地下水,對環境造成危害。目前,對農藥污染土壤的修復技術包括物理修復、化學修復和生物修復等。其中生物修復主要包括微生物修復和植物修復。傳統的物理修復和化學修復方法是將受污染的土壤挖掘后再處理,不僅工程大、費用高,而且對生態系統破壞嚴重。微生物修復則對環境條件要求苛刻,微生物群落間的相互競爭、溫度、營養物都會影響處理效果,因此,在實際環境微生物修復當中,往往需要向污染土壤中加入營養和生物催化劑混合物,以加速微生物修復的速率。但是工廠化生產微生物存在安全性問題而應用到環境中可能再次引起另一種形式的污染。植物修復技術是近年來興起的一種去除土壤、水和沉積物中污染物的新方法,它利用植物能忍耐和超量積累環境中污染物的能力,通過植物的生長來清除環境中的污染物,是一種經濟、有效、非破壞型的污染土壤修復方式。植物修復具有操作簡單、成本低、修復范圍廣等特點,是一種易為社會公眾和政府管理機構接受的有潛力的修復工程技術。
1 植物修復的機制與方式
目前,植物對土壤中農藥的修復主要有3種機制理論[1]:(1)許多植物可以直接從土壤中吸收農藥等污染物,通過木質化作用在新的植物結構中儲藏它們及其殘片,或是在植物生長代謝活動中發生不同程度的轉化或降解,變成對植物無害的中間產物儲存在植物體內,有的則被完全降解并最終礦化成H 2 O和CO2;(2)植物產生并釋放出具有降解作用或促進環境中生物化學反應的酶等根系分泌物。植物釋放到根際土壤中的酶可直接降解有關化合物,其中對殺蟲劑和除草劑等外源有機物的降解起著重要作用的植物酶是水解酶類和氧化還原酶類等降解酶,這些酶通過氧化、還原、脫氫等方式將農藥分解成結構簡單的無毒小分子化合物[2];(3)植物根際與微生物的聯合代謝作用。植物根系、根系微生物和土壤組成的根際微生態系統是土壤中最活躍的區域,微生物群落在植物根際區繁殖活動,根分泌物和分解物給微生物提供營養物質,而微生物活動也促進了根系分泌物的釋放,兩者互惠互利,共同加速根際區農藥的降解。
植物修復的方式主要有4種[3]。(1)植物提取:植物直接吸收有機污染物并在體內蓄積;(2)植物降解:植物本身及相關微生物和各種酶系將有機污染物降解為小分子的CO2和H 2O,或轉化為無毒性的中間產物;(3)植物穩定:植物在與土壤的共同作用下,將有機物固定并降低生物活性,阻止其進一步擴散,以減少其對生物與環境的危害;(4)植物揮發:植物揮發是與植物吸收相連的,它是利用植物的吸收、積累、揮發而減少土壤污染物。前3種方式實際應用較多,最后一種植物揮發方式只針對一些揮發性強的金屬,局限性較大。主要的殺蟲劑和除草劑植物修復見表1。
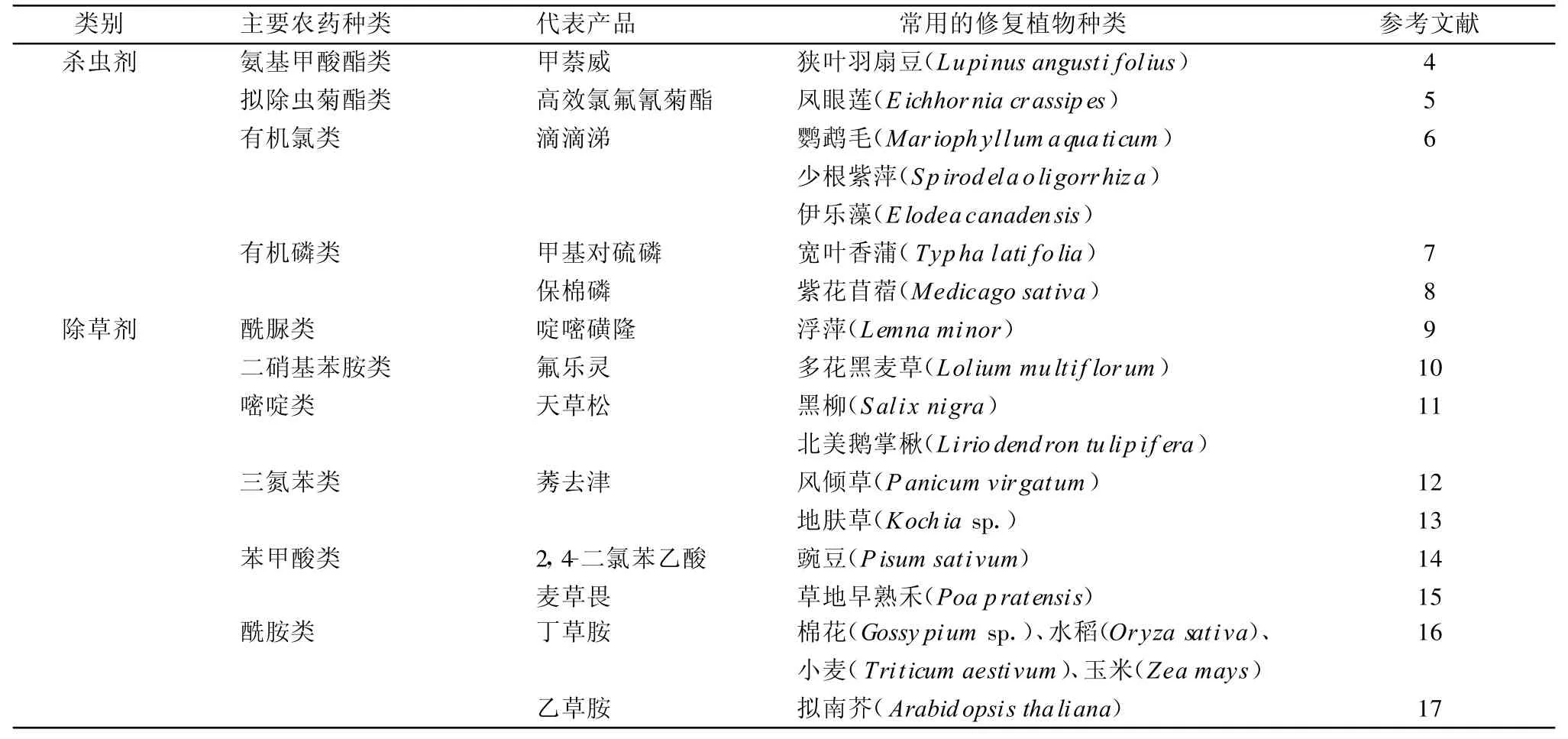
表1 主要的殺蟲劑和除草劑植物修復情況
2 幾種殺蟲劑污染土壤的植物修復研究進展
由于在農林生產上大量不合理地施用各種殺蟲劑來控制害蟲危害,給土壤、水體和大氣帶來許多有機污染物殘留。目前,人們在利用植物對這些殺蟲劑造成的污染進行修復研究方面取得了一定的成果。
2.1 有機氯類殺蟲劑
主要產品有滴滴涕(DDT)、六六六(BHC)等,它們是較早廣泛使用的殺蟲劑,尤其是DDT的開發被認為是現代農藥的起點。盡管現在已經淘汰了這兩種殺蟲劑,但由于它們在土壤中殘留時間長,故對其進行植物修復的研究仍然必要。Gao等[6]報道,在無菌條件下,水生植物鸚鵡毛、紫萍、伊樂藻在6 d內可以完全富集水環境中的 DDT,并能將 1%~13%的DDT降解為DDD和DDE。Lunney等[18]通過對西葫蘆、大牛毛草、紫花苜蓿、黑麥草和南瓜5種植物在溫室內對DDT及其代謝產物DDE運輸傳導和修復能力的研究發現,兩種葫蘆科植物南瓜和西葫蘆具有較強的運輸和富集能力,且嫩芽的富集能力高于根系;在用較高質量濃度DDT處理的土壤中,南瓜和西葫蘆根系的富集量分別為1 519 ng和2 043 ng,在芽中分別達到57 536 ng和35 277 ng。安鳳春等[19]比較了用早熟禾、草地早熟禾、多年生黑麥草與高羊茅草等10種草坪草修復受滴滴涕和六六六污染土壤的能力,研究發現:同一品種的草在不同土壤中對污染物的清除能力不同;不同品種的草在同一土壤中對污染物的清除能力相異。在植物修復的過程中,通過草本身的直接吸收途徑去除土壤中有機污染物所作的貢獻很小,植草的作用可能是通過草的根部向土壤釋放酶和某些分泌物,從而激發土壤中微生物的活性,并加速農藥生物降解作用。草在不同土壤中修復能力的差異,可能是不同土壤中所存在的微生物差異以及其活性酶和某些分泌物所激發的差異所產生的結果。植物根系及其根際微生物在有機農藥殘留的植物修復中起著極其重要的作用,Pereira等[20]研究了地中海薊和埃里卡藻對殺蟲劑六六六同分異構體的吸收和分布,在地中海薊和埃里卡藻的組織中β-型的六六六所占的比例最大,且地上組織比在根中的六六六含量要大得多,這些結果對于修復六六六污染的土壤有很重要的意義。
2.2 有機磷類殺蟲劑
Chávez等[7]研究了香蒲對甲基對硫磷(parathion-methyl)的吸收,在正常的光照條件,p H 7,18~22℃的溫度下培養14 d,測定殺蟲劑的濃度、葉綠素的含量和谷胱甘肽S-轉移酶的活性,結果表明:香蒲對甲基對硫磷有很高的去除率,是一種很有前景的植物修復候選物。Flocco等[8]將紫花苜蓿放在10 mg/L的保棉磷(azinphos-methyl)中培養,20 d后,已檢測不出保棉磷;而在沒有種植紫花苜蓿的培養基中,30 d后,仍有20%左右的保棉磷殘留在培養基中。結果顯示:在種植紫花苜蓿的培養基中,保棉磷的半衰期由10.8 d下降到3.4 d。
2.3 其他類殺蟲劑
Garcinuno等[4]研究了狹葉羽扇豆種子對殺蟲劑甲萘威(carbaryl)、苯線磷(fenamiphos)和氯菊酯(permethrin)的保留效果。試驗結果顯示:狹葉羽扇豆種子對上述殺蟲劑有極強的保留能力,因此,用它來修復被這些殺蟲劑污染的土壤或水體具有應用前景。夏會龍等[5]對鳳眼蓮修復水溶液中乙硫磷(ethion)、高效氯氟氰菊酯(lambda-cyhalothrin)的研究結果表明:10~11 g鳳眼蓮可使250 mL中1 mg/L的乙硫磷、高效氯氟氰菊酯消解速度分別提高283.33%、362.23%;修復機理是鳳眼蓮吸收農藥后在其體內積累或進一步降解,其中乙硫磷消解量的60%是由累積作用完成。由于在試驗期內,鳳眼蓮吸收的乙硫磷主要累積在植物組織中,因此,鳳眼蓮是否能利用這些污染物作為碳源產生同化作用而避免農藥的二次污染值得進一步研究。同期的研究還表明,鳳眼蓮對水溶液中的甲基對硫磷具有極佳的吸收作用,并且具有徹底清除水溶液中甲基對硫磷的能力。
3 幾種除草劑污染土壤的植物修復研究進展
除草劑的種類較多,有酚類、苯氧乙酸類、苯甲酸類、二苯醚類、酰胺類、磺酰脲類和三氮苯類等等。因為有些種類的除草劑應用并不廣泛,所以人們對這類除草劑的植物修復研究得還很少,本文主要介紹幾種常用除草劑的植物修復情況。
3.1 三氮苯類除草劑
該類除草劑是現代除草劑中最主要的類型之一,它的殺草譜廣,適應范圍大,選擇性強,主要品種有西瑪津(simazine)和莠去津(atrazine)等。Jordahl發現狼尾草在污染土壤中生長80 d以后,莠去津和西瑪津分別降解45%和52%,而未種植狼尾草的只降解22%和20%[21]。Lin等[12]用5種牧草(鴨茅草、高羊茅、梯牧草、大扁雀稗和風傾草)對莠去津污染的土壤進行了修復試驗,結果顯示:大部分莠去津仍然殘留在土壤中,只有少量(<4%)被牧草吸收,而風傾草降解了80%以上的莠去津,因此,它可以作為一種很好的修復植物。Kruger等[13]研究發現,在用植物修復多種農藥污染的土壤時,地膚草可明顯地吸收多年沉積的莠去津,降低土壤中生物可利用的莠去津量,且莠去津的降解不受污染土壤中其他農藥存在的影響。因此,對于受到多種農藥污染的土壤,利用植物降解其中的莠去津是可行的。如果人為地向土壤中添加高分子線性陰離子聚丙烯酰胺(PAM)作為土壤調節劑,雖然不影響非離子的莠去津在土壤中的吸附和解吸附,卻能夠影響其代謝產物,并能對另一種除草劑2,4-滴的吸附、解吸以及降解行為產生影響,從而改善土壤中這兩種農藥的生物可利用性。Gaskin等[22]的研究發現,在外部根際菌群與宿主植物松樹共存時,對于土壤中的莠去津其修復效率比單獨的植物修復高3倍。盡管某些植物的根際菌群能夠加速污染物的降解或轉移,但并不是所有的植物都具備這樣的功能。Fang等[23]的研究證實了這一點,他們將5種類似植物:蘇丹草、黑麥草、高牛毛草、冠毛芽草、柳枝稷種植于肥沃的濕土中,研究根際菌群對莠去津降解和培養土的利用情況,發現種植蘇丹草的土壤異于其他4種草,與未種任何植物的土壤情況類似。Perkovich等[24]報道了種植地膚草可以加速莠去津在根際區土壤中的礦化,36 d后根際區莠去津的礦化率達62.1%。研究表明,即使培養條件改變導致了菌群結構的改變,與植物對莠去津降解效率沒有直接的關聯。
3.2 苯甲酸類除草劑
2,4-二氯苯乙酸(2,4-dichlorophenyl acetic acid)是一種有機氯類內吸型選擇性除草劑,它被廣泛使用來控制闊葉雜草,但其對闊葉植物如楊樹、柳樹等同樣具有毒性,在土壤中殘留時間長,并且可以在土壤中遷移。Germaine等[14]將能夠降解2,4-二氯苯乙酸的細菌的基因導入到豌豆中,試驗表明這些豌豆具有更高的降解2,4-二氯苯乙酸的能力。Roy等[15]研究了草坪草對另一種代表性除草劑麥草畏(dicamba)的降解作用,選用美國肯塔基州的草地早熟禾,在實驗室中模擬田間條件,結果發現種植草地早熟禾的土壤中麥草畏的降解率比沒有種植草地早熟禾的土壤要高6~8倍,通過計算得出麥草畏的半衰期僅為5.5 d。因此,草地早熟禾可以作為一種很有效的修復植物來修復被麥草畏污染的土壤。
3.3 酰胺類除草劑
虞云龍等[16]通過對根際土壤和非根際土壤中丁草胺(butachlor)降解的研究發現,棉花、水稻、小麥和玉米的種植明顯促進了丁草胺的降解,其降解半衰期縮短了26.6%~57.2%。Mezzari等[17]從分子水平上研究了擬南芥幼苗對乙草胺(acetochlor)和異丙甲草胺(metolachlor)等物質的修復,證實了擬南芥根細胞中的谷胱甘肽(GSH)和乙草胺以及異丙甲草胺發生結合反應,表明還原酶OPR2也參與了乙草胺和異丙甲草胺的代謝反應,這些結果對研究植物修復的機理具有十分重要的意義。
3.4 其他類除草劑
Olette等[9]研究了浮萍、伊樂藻和水盾草對磺酰脲類除草劑啶嘧磺隆(flazasulfuron)的吸收能力,將浮萍、伊樂藻和水盾草放在5種不同濃度的啶嘧磺隆的培養基中培養了7 d,發現浮萍的吸收能效率最強,依次是伊樂藻和水盾草,每天每克鮮重的最大吸收量可達到27μg。Li等[10]研究發現,多花黑麥草能吸收氟樂靈(trifluralin),并在植株體內將其代謝。Conger等[11]發現,黑柳、北美鵝掌楸、落羽杉、黑樺及櫟屬植物都能有效地降解除草劑滅草松(bentazone)。近年來,應用轉基因技術將特定外源基因導入植物以提高植物降解除草劑的效率研究也獲得良好結果。表達CYP2B6基因的水稻植株對除草劑呋草黃(benfuresate)的降解作用至少增強了60倍;表達大豆CYP71A10和P450還原酶基因的煙草植株,對苯脲型除草劑降解能力提高20%~23%[25-27]。Inui等[28]將人類細胞色素P450種類的基因轉入到馬鈴薯和水稻植株中,使得它們對磺酰脲類除草劑表現出較好的抗性,并且能夠代謝一系列的除草劑,因此這些轉基因作物同樣可以用來修復環境污染物。此外,研究還表明:通過表達單個目標基因或同一代謝途徑中的多個目標基因能夠有效地提高植物修復有機污染物的能力。
4 植物修復目前存在的問題及展望
植物修復技術是一種利用太陽能作為動力的低投入、節能、環保的修復手段,具有巨大的發展潛力,如將基因工程技術運用到植物修復中,利用基因工程技術來增強植物本身對農藥的降解能力,可大大提高植物修復的效率。但是,植物是活的生物體,需要有合適的生存條件,況且植物修復過程通常比物理化學修復過程緩慢,因此植物修復還存在許多局限性及有待完善之處,主要表現在:(1)植物不能降解環境中所有的有機農藥污染。(2)應用植物修復,由于植物的生物量小,無法滿足大面積污染的修復要求。(3)植物修復受污染物濃度的限制,只有在植物能承受的濃度范圍內,植物修復才能進行。(4)植物修復需要的時間相對來說要長些,不如物理或化學修復快。
但是,植物修復其經濟有效、綠色環保、以太陽能為驅動等優點使得該技術成為非常適合我國國情的實用技術。如何尋找、篩選自然界中累積、超累積植物,如何利用現代生物技術手段培育具有多種吸收和降解機制的植物,如何耕種混合植物進行復合污染植物修復等問題仍是今后研究的重點。此外,如利用基因工程技術來增強植物本身對農藥的降解能力,提高植物修復的效率,加強根系分泌物調節與控制根際微生物對污染物的降解轉化機理研究,都是今后的研究方向。
[1] 盧桂寧,黨志,陶雪琴,等.農藥污染土壤的植物修復研究進展[J].土壤通報,2006,37(1):189-193.
[2] Steer J,Harrisja A.Shiftin the microbial community in rhizosp here and nonrhizosphere soils during the growth of Agrostis stolonifera[J].Soil Biology and Biochemistry,2000,32(6):869-878.
[3] 汪小勇,張超蘭,姜文.被農藥污染的土壤植物修復研究進展[J].農業資源與環境科學,2005,21(7):382-384.
[4] Garcinu?o R M,Fernández-Hernando P,Cámara C.Evaluation of pesticide uptake by Lupinus seeds[J].Water Research,2003,37(14):3481-3489.
[5] 夏會龍,吳良歡,陶勤南.鳳眼蓮植物修復幾種農藥的效應[J].浙江大學學報(農業與生命科學版),2002,28(2):165-168.
[6] Gao J,Car rison A W,Hochamer C.Uptake and phy totransformation of o,p'-DDT and p,p'-DDT by axenically cultivated aquatic plants[J].Agriculture and Food Chemistry,2000,48(12):6121-6127.
[7] Amaya-Chávez A,Martinez-Tabche L,López-López E L,et al.Methyl parathion toxicity to and removal efficiency by Ty pha latif olia in water and artificial sediments[J].Chemosp here,2006,63(7):1124-1129.
[8] Flocco C,Carranza M P,Carvajal LG,et al.Removal of azinphos methyl by alfalfa plants(Medicago sativa L.)in a soilfree system[J].Science of the Total Environment,2004,327(1-3):31-39.
[9] Olette R,Couderchet M,Biagianti S,et al.Toxicity and removal of pesticides by selected aquatic plants[J].Chemosp here,2008,70(8):1414-1421.
[10]Li H,Sheng G Y,Xu O Y.Up take of trifluralin and Lindane from water by Ryegrass[J].Chemosphere,2002,48(3):335-341.
[11]Conger R M,Portier R J.Phytoremediation experimentation with the herbicide bentazon[J].Remediation,2006,7(2):19-37.
[12]Lin C H,Lerch R N,Garrett H E,et al.Bioremediation of atrazine-contaminated soil by forage grasses:transformation,uptake and detoxification[J].Environmental Quality,2008,37(1):196-206.
[13]Kruger E L,Anhalt J C,Sorenson D.Atrazine degradation in pesticide-contaminated soils:phytoremediation potential[M]∥K ruger E L,Anderson T A,Coats J R.Phytoremediation of soil and water contaminanants.ACS Symposium Series,1997,664:54-64.
[14]Germaine K J,Liu X M,Garcia C,et al.Bacterial endophyteenhanced phy toremediation of theorganochlorine herbicide 2,4-dichlorophenoxyacetic acid[J].FEMS Microbiology Ecology,2006,57(2):302-310.
[15]Roy J W,Hall JC,Parkin G W,et al.Seasonal leaching and biodegradation of dicamba in turfgrass[J].Environmental Quality,2001,30(4):1360-1370.
[16]虞云龍,楊基峰,潘學東,等.作物種類對根際土壤中丁草胺降解的影響[J].農藥學學報,2004,6(1):46-52.
[17]Mezzari M P,Katherine W,Marcela J,et al.Gene expression and microscopic analysis of arabidopsis exposed to chloroacetanilide herbicides and explosive compounds[J].Plant Physiology,2005,138(2):858-869.
[18]Lunney A I,Zeeb BA,Reimer K J.Uptakeof weathered DDT in vascular plants:potential for phytoremediation[J].Environmental Science and Technology,2004,38(22):6147-6154.
[19]安鳳春,莫漢宏,鄭明輝,等.化學農藥污染土壤植物修復中的環境化學問題[J].環境化學,2003,22(5):420-425.
[20] Pereira R C,Monterroso C,Macias F,et al.Distribution pathways of hex achloro-cyclohexane isomers in a soil-plant-air sy stem[J].Environmental Pollution,2008,155(2):350-358.
[21]Jordahl J L.Effect of hybrid poplar tree on microbial populations important to hazardous waste bioremediation[J].Environmental Toxicology and Chemistry,1997,16(6):1318-1321.
[22]Gaskin J L,Fletalher J.The metabolism of exogenously provided atrazine by the ectomycorrhizal fungus Hebeloma crustulinifor me and the host plant Pinus ponderosa[M]∥Kruger E L,Anderson T A,Coats J R.Phytoremediation of soil and water contaminanants.ACS Symposium Series,1997,664:152-160.
[23]Fang C,Radosevich M,Fuhrmann J J.Atrazine and phenanthrene degradation in grass rhizosphere soil[J].Soil Biology and Biochemistry,2001,33(4):671-678.
[24]Perkovich B S,A nderson T A,Kruger E L.Enhancemineralization of 14Catrazinein k ochia scoparia rhizosphere soil from a pesticide-contaminated soil[J].Pesticide Science,1996,46(4):391-396.
[25]衛士美,武小平,李潤植.有機污染物的植物修復[J].生態農業科學,2006,22(5):384-388.
[26] Kawahigashi H,Hirose S,Hayashi E,et al.Phytotoxicity and metabolism of ethofumesate in transgenic rice plants expressing the human CYP2B6 gene[J].Pesticide Biochemistry and Physiology,2002,74(3):139-147.
[27]Siminszky B,Freytag A M,Sheldon BS,et al.Co-expression of a NADPH:P450 reductase enhances CYP71A10-dependent phenylurea metabolism in tobacco[J].Pesticide Biochemistry and Phy siology,2003,77(2):35-43.
[28]Inui H,Ohkawa H.Herbicide resistance in transgenic plants with mammalian P450 mono-oxygenase genes[J].Pest Management Science,2005,61(3):286-291.

