PIAS1基因沉默對胰腺腺泡細胞炎癥反應的影響
陳平 董文杰 孫蘊偉 姚瑋艷 章永平 喬敏敏 袁耀宗
·論著·
PIAS1基因沉默對胰腺腺泡細胞炎癥反應的影響
陳平 董文杰 孫蘊偉 姚瑋艷 章永平 喬敏敏 袁耀宗
目的觀察活化信號轉導和轉錄激活因子的蛋白抑制因子-1(PIAS1)基因特異性siRNA干擾大鼠胰腺腺泡細胞株AR42J后對雨蛙素誘導炎癥反應的影響,探討其在胰腺炎發病中的作用。方法采用脂質體法將靶向PIAS1的siRNA和陰性siRNA轉染AR42J細胞, 24 h后分別加入雨蛙素繼續培養24 h。同時設脂質體+雨蛙素組、雨蛙素組及僅加PBS的對照組。Western blotting檢測p38絲裂原激活蛋白激酶(p38MAPK)及磷酸化p38MAPK(P-p38MAPK)表達;RT-PCR及Western blotting檢測各組細胞腫瘤壞死因子α(TNF-α)、白介素1β(IL-1β)、IL-6、基質金屬蛋白酶9(MMP-9)的mRNA和蛋白表達。結果siRNA+雨蛙素組、陰性siRNA+雨蛙素組、脂質體+雨蛙素組、雨蛙素組及對照組細胞p38MAPK表達量分別為1.93±0.11、1.22±0.10、1.30±0.17、1.32±0.21、0.12±0.02;P-p38MAPK表達量分別為2.10±0.25、1.36±0.20、1.26±0.15、1.23±0.25、0.58±0.48, siRNA+雨蛙素組較其余各組明顯增加(P值均<0.05)。siRNA+雨蛙素組細胞TNF-α、IL-1β、IL-6、MMP-9 mRNA表達量分別為1.66±0.15、1.66±0.15、1.90±0.01、1.56±0.20;蛋白的表達量分別為2.06±0.37、2.20±0.34、1.80±0.10、1.17±0.05,均較其他雨蛙素處理組表達上調(P值均<0.05)。結論PIAS1參與雨蛙素誘導的胰腺腺泡細胞p38MAPK活性與下游炎癥介質的表達調控。
胰腺; 活化信號轉導和轉錄激活子的蛋白抑制劑-1; 炎癥; 細胞因子
現有研究認為,活化信號轉導和轉錄激活因子的蛋白抑制因子-1(protein inhibitor of activated signal transducer and activator of transcription 1,PIAS1)通過阻斷轉錄因子的DNA結合活性、募集轉錄的共抑制子或共激活子和促進蛋白SUMO化等機制來調節STAT信號轉導途徑相關蛋白轉錄過程[1],它能阻止免疫調控基因的產物,以防止失控性炎癥反應[2]。大鼠胰腺腺泡細胞株ARJ42細胞具有類似正常胰腺腺泡細胞合成和分泌消化酶樣功能[3],被廣泛應用于胰腺腺泡細胞分泌、生長、增殖、分化、凋亡和炎癥體外模型的研究。本研究應用RNA干擾技術靜默PIAS1基因,觀察雨蛙素誘導的AR42J急性胰腺炎體外模型的p38絲裂原激活蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)信號通路變化及其下游調控的炎癥介質的表達,探討PIAS1在急性胰腺炎病程中的作用。
材料和方法
一、siRNA的設計及合成
根據GenBank的PIAS1基因序列(NM_001106829),應用Ambion公司網上交互式軟件在線設計3對siRNA。siRNA-A上游5′-GCAAAU-GGUUAUGAGCCUUTT-3′,下游5′-AAGGCUCAUAACCAUUUGCTT-3′;siRNA-B上游5′-GCUGGA-CGAACUGAUCAAATT-3′,下游5′-UUUGAUCAGUUCGUCCAGCTT-3′;siRNA-C上游5′-CCGGAUCAUUCUAGAGCUUTT-3′,下游5′-AAGCUCUAGAAUGAUCCGGTT-3′。同時,設計1對陰性對照siRNA,上游5′-UUCUCCGAACGUGUCACGUTT-3′,下游5′-ACGUGACACGUUCGGAGAATT-3′。所有siRNA由上海英駿生物技術有限公司合成。
二、有效siRNA篩選
AR42J細胞購自ATCC公司。常規培養后取對數生長期細胞,以每孔3×105個細胞接種于6孔培養板。當細胞覆蓋達60%~80%時采用脂質體(Invitrogen公司)分別轉染3對siRNA。Western blotting和RT-PCR篩選最有效siRNA。
三、細胞分組
同上述方法在6孔板中培養細胞達60%~80%融合時,采用脂質體分別轉染siRNA(最有效的) 和陰性siRNA,24 h后分別加入雨蛙素(10-8mol)繼續培養24 h。同時設脂質體+雨蛙素組、雨蛙素組及僅加PBS的對照組,每組設3個復孔。
四、RT-PCR檢測細胞mRNA表達
Trizol試劑(Invitrogen公司)提取各組細胞總RNA,采用M-MLV第一鏈cDNA合成試劑盒(上海生物工程公司)合成cDNA。目的基因引物序列見表1,由上海英駿生物技術有限公司合成。反應條件:94℃ 4 min,94℃ 45 s、56℃(PIAS1和MMP-9)或55℃(GAPDH)或58℃(IL-6、IL-1β)或60℃(TNF-α)45 s,72℃延伸45 s,35個循環,72℃ 5 min。擴增產物經電泳分離,Bio-Rad凝膠成像系統攝影,Quantity One軟件灰度分析,以目的條帶與GAPDH條帶灰度值的比值表示mRNA的表達量。
五、Western blotting檢測細胞蛋白的表達
采用RIPA分裂液(申能博彩公司)抽提細胞總蛋白,BCA法定量蛋白,行常規Western blotting。抗p38MAPK、P-p38MAPK、PIAS1、TNF-α、IL-1β、IL-6、MMP-9一抗均購自Santa cruz公司,抗GAPDH抗體購自上海康成公司,ECL購自Amersham Biosciences公司。最后經數碼成像系統掃描,以目的條帶與GAPDH條帶灰度值比值作為蛋白表達量。
六、統計學方法
結 果
一、最有效靶向PIAS1的siRNA篩選
siRNA-C轉染細胞后PIAS1mRNA表達缺如,PIAS1蛋白也最弱(圖1),故均以siRNA-C進行下一步的所有實驗。

表1 所測目的基因引物序列
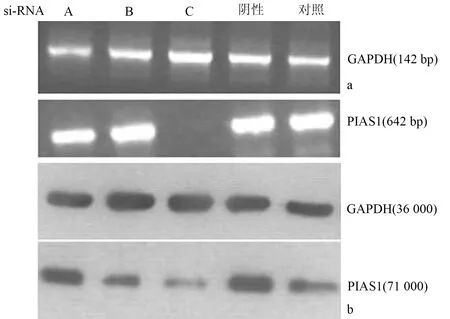
圖1 轉染細胞PIAS1mRNA(a)和蛋白(b)的表達
二、p38MAPK及P-p38MAPK、TNF-α、IL-1β、IL-6、MMP-9蛋白表達的變化
雨蛙素處理后AR42J細胞p38MAPK、P-p38MAPK、TNF-α、IL-1β、IL-6、MMP-9蛋白表達均較對照組明顯增加 (P值均<0.05),其中siRNA+雨蛙素組細胞的表達較其他雨蛙素處理組增加更顯著(P值均<0.05,圖2,表2)。
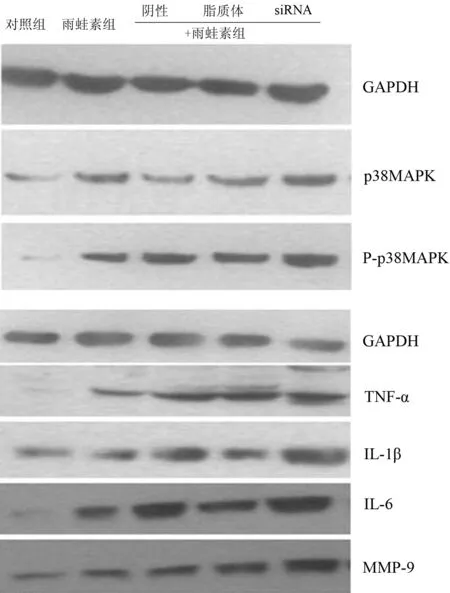
圖2各組細胞p38MAPK、P-p38MAPK、TNF-α、IL-1β、IL-6、MMP-9 蛋白的表達(Western blotting)
三、各組細胞TNF-α、IL-1β、IL-6、MMP-9 mRNA表達的變化
雨蛙素處理AR42J細胞后,TNF-α、IL-1β、IL-6、MMP-9 mRNA表達均較對照組明顯增加(P值均<0.05),其中siRNA+雨蛙素組的表達又較其他雨蛙素處理組增加更明顯(P值均<0.05,圖3,表3)。
表2 各組細胞p38MAPK、P-p38MAPK 、TNF-α、IL-1β、IL-6、MMP-9蛋白表達的變化
注:與對照組比較,aP<0.05;與siRNA+雨蛙素組比較,bP<0.05
表3 各組細胞TNF-α、IL-1β、IL-6、MMP-9 mRNA表達的變化
注:與對照組比較,aP<0.05;與siRNA+雨蛙素組比較,bP<0.05
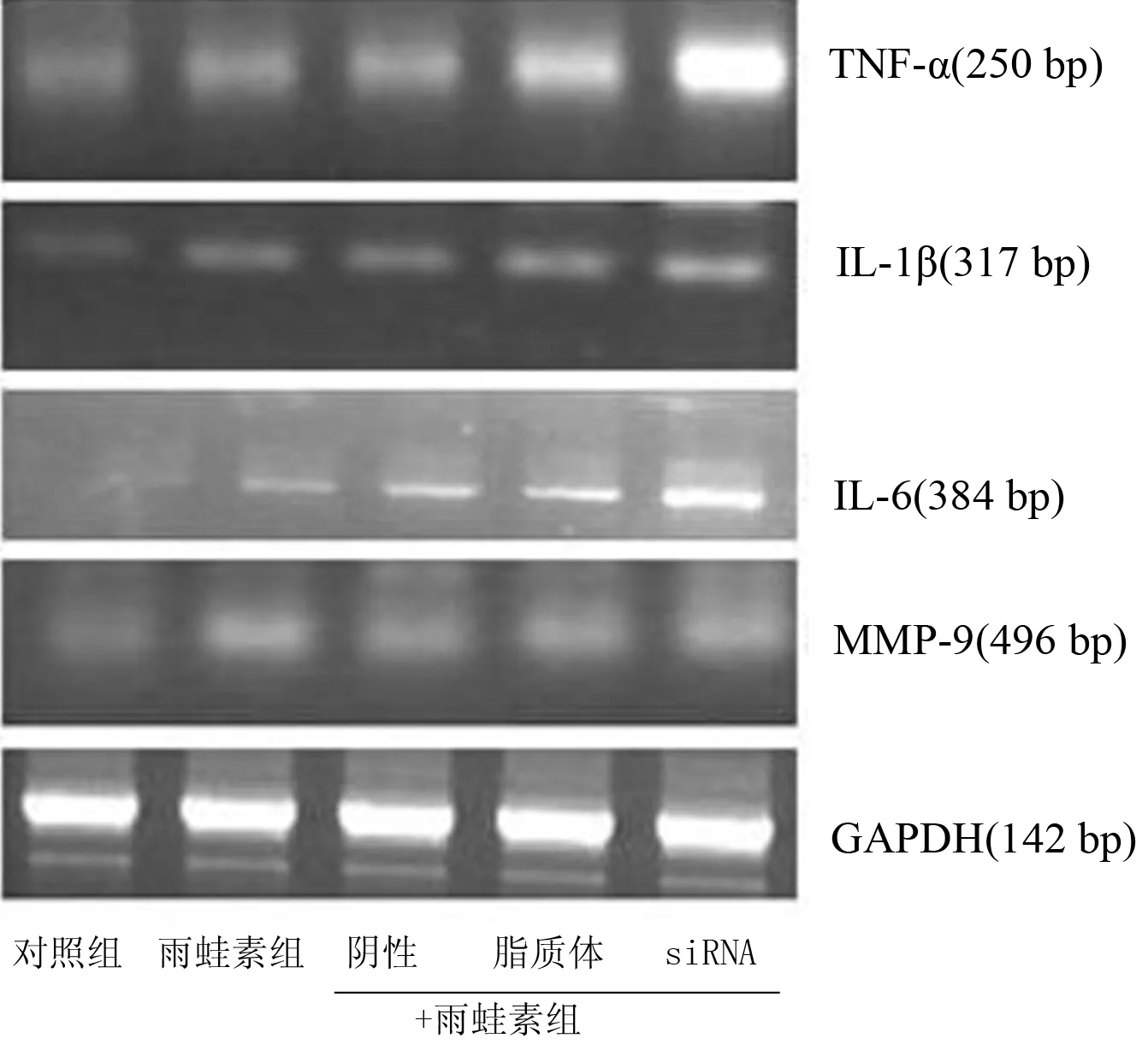
圖3各組細胞TNF-α、IL-1β、IL-6、MMP-9 mRNA的表達(RT-PCR)
討 論
在急性胰腺炎發病機制研究中發現,TNF-α、IL-1β、IL-6、MMP-9等炎癥介質參與誘導病程中全身炎癥反應綜合征及多臟器功能失調的發生,炎癥介質過度釋放已成為疾病早期患者病死的原因之一[4]。促炎癥介質釋放的信號通路在這過程中發揮關鍵作用,其中p38MAPK參與促進疾病的進展,而應用特異性抑制劑可降低急性胰腺炎模型動物死亡率,改善病情[5-6]。我們既往的研究結果顯示,p38MAPK信號轉導通路介導急性胰腺炎大鼠 TNF-α和IL-1β等炎癥介質的釋放,阻斷p38MAPK信號轉導通路可改善急性胰腺炎病情[7]。本結果同樣顯示雨蛙素誘導的的AR42J細胞體外炎癥模型,p38MAPK蛋白活性增加, TNF-α、IL-1β、IL-6、MMP-9表達增高。
現已證實,PIAS1敲除小鼠經脂多糖處理后血清中炎癥介質水平增高明顯,發育遲緩,圍產期死亡增加,因此認為PIAS1敲除小鼠對脂多糖誘導的膿毒血癥具有超敏性[8]。此外,Liu等[9]發現在TNF-α或脂多糖刺激下,PIAS1中的Ser 90磷酸化,通過SUMO化作用于IκB激酶α,發揮抑制核因子κB活性,減輕炎癥反應。因此,有必要了解PIAS1在急性胰腺炎病程中的作用機制。
本實驗采用RNA干擾技術沉默AR42J細胞的PIAS1基因表達后,雨蛙素可明顯增加細胞p38MAPK的活性,同時增加TNF-α、IL-1β、IL-6、MMP-9等促炎癥介質的轉錄。其原因可能是PIAS1能抑制炎癥介質釋放,調控過度炎癥反應;而抑制PIAS1基因的表達,則弱化其對炎癥反應的調控所致。但具體的作用方式仍需要進一步探索。
[1] Kahyo T,Nishida T,Yasuda H.Involvement of PIAS1 in the sumoylation of tumor suppressor p53.Mol Cell,2001,8:713-718.
[2] Liu B,Yang Y,Chernishof V,et al.Proinflammatory stimuli induce IKKalpha-mediated phosphorylation of PIAS1 to restrict inflammation and immunity.Cell, 2007,129:903-914.
[3] Yu JH,Lim JW,Kim KH,et al.NADPH oxidase and apoptosis in cerulein-stimulated pancreatic acinar AR42J cells.Free Radic Biol Med,2005,39: 590-602.
[4] 袁耀宗,陳平.應加強重癥急性胰腺炎的綜合治療.臨床消化病雜志,2006,18:19-20.
[5] Greenhalgh CJ,Hilton DJ.Negative regulation of cytokine signaling.J Leukoc Biol,2001,70:348-356.
[6] Yubero S,Ramudo L,Manso MA,et al.The role of redox status on chemokine expression in acute pancreatitis.Biochem Biophys Acta,2009,1792:148-154.
[7] Chen P,Zhang Y,Qiao M,et al.Activated protein C,an anticoagulant polypeptide,ameliorates severe acute pancreatitis via regulation of mitogen-activated protein kinases.J Gastroenterol,2007,42:887-896.
[8] Liu B,Mink S,Wong KA,et al.PIAS1 selectively inhibits interferon-inducible genes and is important in innate immunity.Nat Immunol, 2004, 5: 891-898.
[9] Liu B,Yang R,Wong KA,et al.Negative regulation of NF-kappaB signaling by PIAS1.Mol Cell Biol,2005,25:1113-1123.
2010-02-14)
(本文編輯:屠振興)
EffectofPIAS1genesilencingoninflammatoryresponseofpancreaticacinarcell
CHENPing,DONGWen-jie,SUNYun-wei,YAOWei-yan,ZHANGYong-ping,QIAOMin-min,YUANYao-zong.
DepartmentofGastroenterology,RuijinHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200025,China
YUANYao-zong,Email:yyz28@medmail.com.cn
ObjectiveTo investigate the effect of protein inhibitor of activated signal transducer and activator of transcription 1 (PIAS1) gene silencing on the inflammatory response of rat pancreatic acinar cell lines AR42J with cerulein stimulation, to study its role in the pathogenesis of acute pancreatitis.MethodsThe siRNA targeting PIASI was designed, synthesized, transfected into AR42J cells by lipofectmine 2000. 24 h later, cerulean was added and cultured for another 24 h. Subsequent AR42J cells with cerulein stimulation were divided into 4 groups: cerulein, liposome, negative-siRNA and PIAS1-siRNA groups. In addition, a group with PBS was as control group. The activity of p38 mitogen-activated protein kinase (p38MAPK) was detected by western blotting. TNF-α, IL-1β, IL-6, matrix metalloproteinase (MMP) 9 expression were analyzed by RT-PCR and western blotting, respectively.ResultsThe expression of p38MAPK in PIAS1-siRNA, negative-siRNA, liposome, cerulein,and control group was 1.93±0.11, 1.22±0.10, 1.30±0.17, 1.32±0.21, 0.12±0.02; while the expression of phosphorylated p38MAPK was 2.10±0.25, 1.36±0.20, 1.26±0.15, 1.23±0.25, 0.58±0.48, the expression in PIAS1-siRNA group was significantly increased when compared with other groups (P<0.05). The levels of TNF-α, IL-1β, IL-6, MMP-9 mRNA were 1.66±0.15,1.66±0.15, 1.90±0.01, 1.56±0.20 in PIAS1-siRNA group, while the expression of protein was 2.06±0.37,2.20±0.34, 1.80±0.10, 1.17±0.05, which was markedly higher than those in other group (P<0.05).ConclusionsPIAS1 gene silencing could enhance p38MAPK activity, and improve inflammatory mediator expression in pancreatic acinar cells with cerulein stimulation.
Pancreas; Protein inhibitor of activated signal transducer and activator of transcription 1; Inflammation; Cytokines
10.3760/cma.j.issn.1674-1935.2010.06.008
200025 上海,上海交通大學醫學院附屬瑞金醫院消化內科
袁耀宗,Email:yyz28@medmail.com.cn

