靈芝多糖對失血性休克復蘇時腸粘膜損傷的保護作用及機制*
河南職工醫學院(鄭州450003)
楊紅梅 陳 潔 王 黎
失血性休克及復蘇過程中,腸粘膜最易發生損傷,導致腸粘膜的屏障作用破壞,并引起其他臟器的繼發性損傷,導致多器官功能衰竭[1]。靈芝多糖(ganoderma lucidum polysaccharide,GLP)是靈芝的有效成分之一,已證明其對失血性休克再灌注損傷有保護作用[2,3],本實驗通過復制家兔失血性休克再灌注復蘇模型,觀察了失血性休克復蘇過程中腸粘膜屏障功能的變化及GLP的保護作用和可能的作用機制,以期為臨床危重病人的救治提供新的理論依據。
材料和方法
1 實驗藥物 GLP購自保定施達科生物工程技術有限公司,系采用超聲波酶法從人工栽培的赤芝中提取,其主要成分是 L巖藻糖、D半乳糖、D甘露糖、D木糖和D葡聚糖等具有生理活性的單糖聚合體,1g靈芝多糖相當于22.2g生藥。溶于加熱的生理鹽水,制成質量分數為1%的靈芝多糖溶液,無菌過濾備用。
2 動物模型復制與實驗分組 體質量為2.5~3.0 kg成年健康家兔 30只,雌雄不限,隨機分為假手術組(S組)、生理鹽水再灌注組(NS組)和GLP再灌注組(LS組)3組,每組 10只。用質量分數為3%的異戊巴比妥鈉30mg/kg經耳緣靜脈注入麻醉,氣管切開插管,自主呼吸;右側頸外靜脈插管,供輸液、輸藥用;左側頸總動脈插管,通過BL-420智能型生物信號采集與處理系統(成都泰盟電子有限公司)連續監測血壓;左側股動脈插管,用于放血、采集血樣。全身肝素化后,記錄血壓,按 15ml/kg快速放血,使平均動脈血壓(MAP)在10min內下降至40 mm Hg(1mmHg=0.133k Pa),通過調整血容量維持 MAP在 40 mm Hg 40min。然后NS組快速回輸自體肝素化血,并靜脈滴注 2倍量的生理鹽水,分別于放血前(BI)、休克40min(S40)及再灌注復蘇40min(R40)和90 min(R90)時取血樣;LS組用質量分數為1%的GLP代替生理鹽水,其余同NS組;S組只做手術不放血。
3 檢測指標(1)細菌培養及鑒定:于放血前、休克40min、再灌注后復蘇40min和90min時嚴格無菌條件下經股動脈采集血樣,迅速置于乙酸鈉液體培養基中,37℃培養,陽性管進行需氧菌和厭氧菌分離培養,分別用 G+菌、G-菌和厭氧菌鑒定實驗卡進行鑒定,以自動微生物系統儀判定結果。(2)腸粘膜 SOD活性、MDA和TNFα含量檢測:再灌注復蘇 90 min時,快速處死動物,低溫下刮取腸粘膜制備 10%的勻漿,3 000r/min離心,取上清,檢測 MDA和TNFα含量和SOD活性,SOD活性用黃嘌呤氧化酶法,MDA用硫代巴比妥酸比色法,TNFα用放射免疫法檢測,試劑盒購自南京聚力生物醫學工程研究所,嚴格按試劑盒說明進行操作檢測。(3)光鏡觀察和腸粘膜細胞凋亡的檢測:動物處死后取末端回腸 2cm制作光鏡標本,分別進行 HE染色觀察腸絨毛的損傷程度和應用末端脫氧核苷酸轉移酶介導的原位末端平移(TUNEL)法檢測腸粘膜細胞凋亡情況,每張切片觀察 10個高倍視野,計算染色陽性細胞百分數。腸粘膜損傷分級依據Chiu腸粘膜損傷評分方法進行[4]。
結 果
1 細菌培養及鑒定結果 見表1。3組動物于放血前血液細菌培養均為陰性,沒有細菌移位發生(P>0.05)。NS組和LS組于失血性休克 40min時均有2例血液細菌培養陽性,而隨著再灌注時間的延續,NS組血液細菌培養陽性率逐漸增加,細菌移位增加,明顯高于LS組,培養的陽性菌經鑒定,以大腸桿菌最為多見,其余菌種依次為腸球菌、糞鏈球菌、嗜酸乳桿菌、葡萄球菌等。

表1 細菌移位情況(n=10)
2 腸粘膜 SOD活性、MDA和TNFα含量變化見表2。NS組和LS組腸粘膜 SOD活性明顯低于S組,而 LS組又明顯高于NS組(P<0.05);NS組和LS組腸粘膜MDA和TNFα含量明顯高于S組,而 LS組又明顯低于NS組(P<0.05)。
表2 3組腸粘膜 SOD活性、MDA和TNFα含量變化(n=10,±s)

表2 3組腸粘膜 SOD活性、MDA和TNFα含量變化(n=10,±s)
注:與S組比較,* P<0.05;與NS組比較,# P<0.05
NS組 145.50±71.318.19±0.327.76±1.07 LS組 246.46±57.73*# 5.73±0.61*# 6.11±0.94*#
3 光鏡觀察結果 見表3,附圖。S組腸粘膜上皮細胞層完整,腺體結構未見異常;NS組腸絨毛水腫,上皮層下間隙增寬,間質疏松,排列混亂,損傷脫落明顯,固有層血管充血,中性粒細胞和淋巴細胞浸潤;而 LS組腸粘膜損傷較NS組明顯減輕。
4 TUNEL法檢測結果 NS組腸粘膜凋亡細胞百分數(46.82±6.1)% 明顯高于S組(32.41±4.4)%和LS組(38.67±3.7)%(P<0.05)。
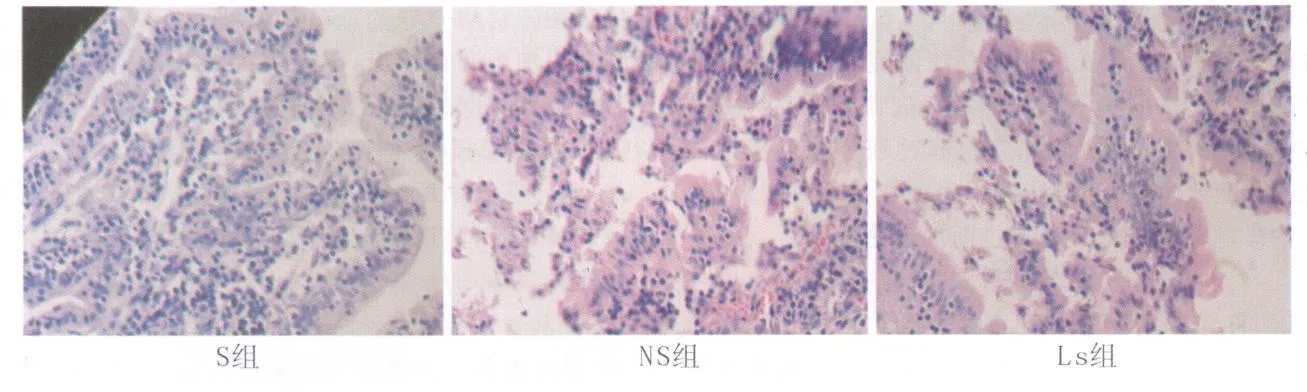
附圖 腸粘膜損傷情況(HE×200)
表3 3組腸粘膜損傷Chiu評分比較(n=10,±s)

表3 3組腸粘膜損傷Chiu評分比較(n=10,±s)
注:與S組比較,* P<0.05;與NS組比較,# P<0.05
NS組 3.79±1.23*LS組 1.44±0.64*#
討 論
研究表明,缺血再灌注損傷的主要機制是氧自由基介導的脂質過氧化反應和炎性因子觸發的全身炎性反應(SIRS)[5],丙二醛(MDA)和超氧化物歧化酶(SOD)是反映脂質過氧化反應的敏感指標,腫瘤壞死因子(TNFα)是機體細胞因子網絡的重要成分,可以促進和放大炎癥損傷反應[6]。另有研究表明,創傷失血后,機體各臟器早期即發生大量細胞凋亡,進一步加重臟器功能障礙,尤其是腸粘膜細胞大量凋亡時所致的腸粘膜屏障功能破壞可造成細菌、內毒素移位而促進SIRS和多臟器功能衰竭(MOF)的發生發展[7]。
本研究結果表明,休克 40 min后用生理鹽水再灌注復蘇時,腸粘膜的損傷、細菌移位和細胞凋亡百分數明顯高于S組,同時 SOD活性則明顯低于S組(P<0.05),而 MDA和TNFα含量則明顯高于S組(P<0.05),說明失血性休克復蘇時氧自由基介導的脂質過氧化反應和TNFα觸發的全身炎癥反應以及腸粘膜細胞的大量凋亡共同參與了失血性休克再灌注復蘇時腸粘膜的損傷,從而使腸粘膜的屏障功能降低,通透性增加,腸道細菌及內毒素等通過損傷的腸粘膜侵入血液循環,出現細菌移位現象而引發細菌和內毒素血癥,促進了SIRS和MOF的發生發展。
靈芝是我國傳統的延年益壽中藥,具有“益精氣、扶正固本”的作用。靈芝多糖是靈芝的主要有效成分之一,以前的研究表明,靈芝多糖具有清除體內自由基、抗氧化、保護失血性休克再灌注時心肌損傷的作用[8],本實驗中,失血性休克用靈芝多糖再灌注時腸粘膜的損傷、細菌移位明顯低于NS組而 SOD活性明顯高于NS組,MDA和TNFα含量及腸粘膜細胞凋亡數目則明顯低于NS組(P<0.05),說明靈芝多糖可能是通過抑制脂質過氧化反應和減少細胞因子 TNFα和細胞凋亡而對失血性休克再灌注過程中腸粘膜的再灌注損傷起保護作用的。
[1] Swank GM,Deitch EA.Rode of the gut in multiple organ failure:bacterial translocation and permeability changes[J].World JSurg,1996,20(4):411-417.
[2] 楊紅梅,王 黎,陳 潔,等.靈芝多糖對兔失血性休克血液流變學的實驗研究 [J].中醫藥學刊,2004,22(5):914-915.
[3] 楊紅梅,王 黎,陳 潔,等.失血性休克再灌注心肌損傷機制及靈芝多糖的預防作用[J].河南職工醫學院學報,2003,15(3):8-10.
[4] Chiu CJ,Mcardle AH,Brown R,etal.Intestinal mucosal lesion in lowflow states[J].Arch Surg,1970,101(4):478-483.
[5] 鄒捍東,吳 靈,周有山,等.阿魏酸對兔失血性休克腹腔臟器再灌注損傷的保護作用 [J].中國臨床康復,2006,10(43):114-116.
[6] 姜小國,胡 森,石德光,等.卡巴膽堿對腸缺血再灌注大鼠血漿腫瘤壞死因子-α和白介素-10含量的影響 [J].中國危重病急救醫學,2003,15(3):167-168.
[7] 夏中元,羅 濤,夏 芳,等.生脈注射液對腸粘膜再灌注損傷保護作用機制的實驗研究 [J].中華麻醉學雜志,2001,21(5):299-301.
[8] 楊紅梅,王 黎,陳 潔,等.失血性休克復蘇時心肌損傷和一氧化氮的變化及靈芝多糖的干預作用[J].中國中西醫結合急救雜志,2003,10(5):304-306.

