嗜肺軍團菌lvgA基因分析及實時熒光定量RT-PCR對軍團菌的檢測*
單小云,胡 野,應延風,屠平光
2.金華職業技術學院人畜共患病研究所,金華 321007
軍團菌是一種兼性胞內寄生的人畜共患病病原體,廣泛存在于天然淡水和人工水域等多種水體環境中。由軍團菌感染引起的軍團菌病是一種以肺炎為主要臨床表現的急性細菌性傳染病,病程進展快,死亡率高〔1-2〕。研究表明,軍團菌有48種70個血清型〔3〕,但90%以上的軍團菌肺炎均由嗜肺軍團菌感染引起〔4-5〕。隨著城市化進程加快,大型建筑增多,城市人口居住密度增高,軍團菌病爆發和流行的可能性越來越大。因此,對該病進行有效的防治已引起社會的普遍關注。
軍團菌病的早期準確診斷不但有利于該病的治療,而且可有效降低其死亡率。目前,軍團菌病的診斷方法主要有血清學診斷、尿抗原測定、以及通過PCR、qPCR等檢測特定目的基因片段的分子生物學方法〔6-7〕。雖然從呼吸道分泌物中分離出相應的病原體仍被認為是診斷該病的金標準,但由于該方法靈敏性低,耗時長,且絕大部分軍團菌肺炎患者不分泌痰液,故臨床實驗室實際應用價值不大〔7-8〕。又由于軍團菌肺炎與其他原因引起的肺炎的臨床表現難以區別,容易造成誤診。因此,對軍團菌病進行快速、準確的早期診斷具有十分重要的臨床意義。
據文獻報道,嗜肺軍團菌可侵入哺乳動物巨噬細胞,逃避吞噬體和溶酶體的殺傷作用,并在其中生長繁殖,這與嗜肺軍團菌的致病機制密切相關〔9-10〕。Edelstein等采用信號標記轉座子誘變(signaturetagged transposon mutagenesis)技術研究發現了1個編碼約28kDa蛋白的軍團菌毒力基因(Legionella virulence gene,lvgA),認為lvgA蛋白與軍團菌在宿主細胞中的存活緊密相關〔11-12〕,但其分子致病機制不明。
本研究試圖通過生物信息學方法對嗜肺軍團菌lvgA基因進行分析,同時利用細胞模型檢測軍團菌毒力基因在軍團菌感染宿主細胞后的表達變化,為闡明該基因的功能和致病機制提供理論基礎,并建立基于軍團菌lvgA基因檢測軍團菌的實時熒光定量RT-PCR,為該病的早期診斷提供有效方法。
1 材料與方法
1.1 材料 嗜肺軍團菌LP1標準株由浙江省疾病預防控制中心微生物所惠贈。大腸桿菌JM 109由本所保存;細菌RNA/DNA提取試劑盒,cDNA合成試劑盒,PCR系列試劑,T-A克隆試劑盒,質粒pMD18-T,限制性內切酶NdeI、XhoI,T4DNA連接酶均購自 TaKaRa公司。人單核巨噬樣細胞THP-1購自中科院上海細胞生物學研究所細胞庫。
1.2lvgA基因序列及其蛋白結構分析 將嗜肺軍團菌Corby株、Lens株和Paris株的lvgA基因序列進行比對,并將蛋白序列輸入http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi數據庫預測其功能結構域,采用TMHMM Server v.2.0預測該蛋白在細胞膜上的定位情況。
1.3 基因組DNA的提取及lvgA基因的擴增 采用細菌DNA提取試劑盒(MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0)提取嗜肺軍團菌基因組DNA。根據lvgA基因參考序列(Gen-Bank accession No.:NC_009494)的限制性內切酶位點分析結果〔8〕,采用Primer Designer軟件自行設計PCR引物并由上海Invitrogen公司合成。引物序列:上游5'-GCG CAT ATG (Nde I)GCA GAC GGC GAT ATC-3',下游 5'-GCG CTC GAG(XhoI)TT T TCG TGC AGT AGT TGC-3'。采用PCR試劑盒擴增全長lvgA基因片段,反應總體積為100 μ L,其中各引物濃度為250 nmol/L,DNA模板 100 ng。PCR 參數:94℃5 min;94℃30 s、50℃30 s、72℃50 s,30個循環;72℃10 min。采用1.0%溴乙錠預染瓊脂糖凝膠電泳檢測擴增產物,預期擴增目的片段大小為624 bp。
1.4 目的基因克隆和測序 采用T-A克隆試劑盒將回收的目的擴增片段插入pMD18-T中,再轉化至E.coliJM 109中并擴增,利用質粒提取試劑盒提取重組質粒pMD18-T-lvgA。pMD18-T-lvgA經NdeI和XhoI雙酶切初步鑒定后,委托上海invitrogen公司測定插入片段的核苷酸序列,然后與lvgA基因參考序列(GenBank accession No.:NC_009494)進行比對。
1.5 宿主細胞中軍團菌總RNA的提取以及cDNA的合成 按100∶1的比例用軍團菌感染THP-1細胞,在37℃條件下孵育1、2、4、8h后去除上清液,用PBS將細胞洗滌三次。采用細菌RNA提取試劑盒(MiniBEST RNA Extraction Kit)提取不同樣本中的總RNA。將總RNA用DNase處理后用逆轉錄試劑盒(M-MLV RTase cDNA Synthesis Kit)合成cDNA,并以此為熒光定量PCR的模板。正常條件下培養的嗜肺軍團菌被用作對照。
1.6 實時熒光定量RT-PCR 根據本研究中所檢測的嗜肺軍團菌lvgA基因序列及GenBank中嗜肺軍團菌16S rDNA基因序列(Accession No.:NC_006368),采用Primer Express軟件,設計用于熒光定量PCR擴增lvgA基因片段以及作為內參的16S rDNA基因片段的引物。用于擴增lvgA基因片段以及16S rDNA基因片段的引物分別為:5'-TCATAGAACCCGAACTGATACCTGG-3',5'-GCACATAGACATGCCTGCACTAAAC-3',和5'-GAAGAACCT TACCTACCCT TGACATACAG-3',5'-TCGT TACGGGACT TAACCCAACATC-3'。擴增產物大小分別為 125bp、133bp。采用TaKaRa公司 SYBR Premix Ex TaqTM熒光定量PCR試劑盒對不同逆轉錄產物樣本進行檢測。反應體積為 50 μ L,內含 1×SYBR Premix Ex-TaqTMII、10 μ mol/L 各引物、1 ×ROX Reference Dye II、逆轉錄產物4 μ L。利用ABI7500 Realtime PCR儀進行擴增 ,反應參數 :95℃10 s、95℃5 s、60℃34 s,40個循環。之后采用△△CT數學模式對實時熒光定量PCR結果進行分析。同時采用SPSS統計學軟件對嗜肺軍團菌lvgA基因轉錄水平相對值進行t檢驗等統計學分析。
1.7 臨床樣本中lvgA基因的檢測 檢測樣本來自金華市中心醫院的30份肺炎患者血液,其中10份經病原學檢測為嗜肺軍團菌陽性。實時熒光定量RT-PCR檢測的擴增體系:總反應體系為50μ L,包括 SYBR Premix EX Taq II(2×)25μ L、上游引物(10μ mol/L)2.0μ L 、下游引物(10μ mol/L)2.0μ L 、ROX Reference Dye II(50 ×)1μ L、模板 DNA 4μ L,用ddH2O補足至50μ L。反應條件:95℃預變性10s后,采用二步法進行反應:95℃5 s、60℃30s,40個循環。在60℃設定熒光檢測點。每個循環結束后采集數據,反應結束后根據擴增曲線判定結果,ct值<35,且反應曲線良好判為陽性〔13〕。
2 結 果
2.1 嗜肺軍團菌lvgA基因的PCR擴增 采用如上所述的特異性引物對所提嗜肺軍團菌LP1基因組DNA進行PCR擴增。通過1.0%瓊脂糖凝膠電泳分析,擴增得到一條產物大小的lvgA基因片段條帶。通過TA克隆,成功構建了pMD18-T-lvgA質粒,結果見圖1。
2.2 嗜肺軍團菌不同菌株lvgA基因核苷酸序列及其氨基酸序列分析 通過TA克隆、測序,將嗜肺軍團菌LP1基因組DNA中的lvgA基因序列與已報道的其他菌株中的lvgA基因序列(GenBank No.:NC_006369、NC_009494、NC_006368)進行比較分析,與嗜肺軍團菌LP1lvgA基因核苷酸和氨基酸的相似性分別為:99%,96%,96%和99%,98%,98%,見圖2,3。
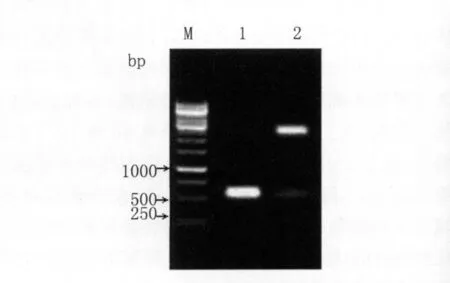
圖1 嗜肺軍團菌基因組DNA中擴增的lvgA基因目以及質粒pMD18-T-lvgA的酶切鑒定M:marker(TaKaRa);1:嗜肺軍團菌 lvgA基因擴增條帶;2:雙酶切鑒定質粒 pMD18-T-lvgA。Fig.1 The amplification result of lvgA gene from DNA of L.pneumophila and identification of plasmid pMD18-T-lvgA by restriction enzyme digestionM:mark(TaKaRa);1:Amplification result of lvgA gene from L.pneumophila;2:Identification of plasmid pMD18-T-lvgA by double enzyme digestion.
2.3lvgA基因中保守功能結構域及跨膜結構預測結果 通過Blast比對發現,雖然嗜肺軍團菌 LP1中的lvgA基因為毒力相關基因,但在其氨基酸序列中未發現存在某種保守功能結構域。通過跨膜結構預測發現LvgA蛋白為1種定位于外膜并部分表面表達的單體結構。
2.4lvgA基因轉錄水平的變化 本研究采用實時熒光定量RT-PCR檢測嗜肺軍團菌LP1在37℃條件下感染 T HP-1細胞2、4、6、8h后,其lvgA基因轉錄水平的變化情況。結果表明,嗜肺軍團菌LP1感染THP-1細胞2h后,lvgA基因轉錄水平上調明顯,比正常培養條件下嗜肺軍團菌LP1的lvgA基因轉錄水平最大上調4.3倍。提示lvgA基因可能與嗜肺軍團菌 LP1在巨噬細胞中的存活有關,見圖4。
2.5 臨床樣本中lvgA基因的檢測結果 經基于lvgA基因的熒光定量RT-PCR檢測顯示,軍團菌感染患者的血清檢測結果均為陽性而其他肺炎患者的血清檢測結果均為陰性,見圖5。
3 討 論
嗜肺軍團菌有15個血清型,其中1型在人軍團菌獲得性肺炎中最為常見。嗜肺軍團菌lvgA基因為軍團菌所特有,對其在宿主體內保持完整的毒力必不可少。該基因可能對嗜肺軍團菌在宿主細胞中的增殖、宿主的局部抗菌效應以及感染后激發全身性炎性反應等均密切相關。深入研究lvgA基因對闡明嗜肺軍團菌的毒力及致病機制具有重要意義〔14-15〕。

圖2 4株嗜肺軍團菌lvgA基因核苷酸序列比較1-3:嗜肺軍團菌 Lens株,Corby株,Paris株 lvgA基因核苷酸序列,4:嗜肺軍團菌1型菌株 lvgA基因核苷酸序列。Fig.2 Comparison sequences of lvgA genes from four L.pneumophila strains1-3:lvgA gene sequences form L.pneumophila strain Lens,Corby,Paris.4:lvgA gene sequence form L.pneumophila type I.
本研究采用TA克隆技術構建了在宿主菌中高拷貝、性質穩定的pMD18-T-lvgA。通過基因測序、生物信息學分析,發現嗜肺軍團菌1型中的lvgA基因與嗜肺軍團菌Corby株、Lens株和Paris株中的lvgA基因序列極其相似,核苷酸和氨基酸序列的相似度分別為99%,96%,96%和99%,98%,98%,說明lvgA基因保守地存在于嗜肺軍團菌中。從氨基酸序列的比對發現某些核苷酸的突變并未引起相對應氨基酸的改變,也進一步說明了lvgA基因表達產物序列、功能的保守性。通過膜定位分析預測并發現lvgA基因表達產物是1種定位于外膜的單體結構。上述結果強烈提示lvgA基因可以作為研制軍團菌病疫苗的候選基因。
為了闡明嗜肺軍團菌lvgA基因的潛在功能,分析嗜肺軍團菌在不同條件下lvgA基因的表達變化是首要問題。據文獻報道,嗜肺軍團菌可侵入哺乳動物巨噬細胞,逃避吞噬體和溶酶體的殺傷作用,并在其中生長繁殖。本研究采用實時熒光定量RTPCR檢測嗜肺軍團菌在體外感染巨噬細胞后lvgA基因轉錄調控情況。結果顯示該基因轉錄水平最大上調達4.3倍,表明嗜肺軍團菌毒力基因lvgA表達產物確實與該菌在巨噬細胞中的存活和增殖有關。
目前實驗室診斷嗜肺軍團菌病的常用手段主要有細菌培養、直接熒光抗體染色、尿軍團菌抗原測定和PCR試驗等方法,但均存在不足之處。對軍團菌病進行早期準確診斷需要有更敏感、穩定、準確的檢測方法。本研究表明嗜肺軍團菌在感染巨噬細胞的過程中轉錄水平上調明顯,而且lvgA基因在各個菌株中保守存在,提示建立基于lvgA基因的熒光定量RT-PCR,不但可有效地在軍團菌感染早期進行檢測,而且可提高檢測的靈敏度。本研究中,以此法檢測肺炎患者的血液樣本,只有嗜肺軍團菌肺炎患者血液樣本為陽性。因此表明,如能進一步優化反應體系等手段,我們所建立的基于lvgA基因的熒光定量RT-PCR技術,完全可以用于臨床實驗室進行敏感、特異、快速、準確地檢測血液樣本中的嗜肺軍團菌。
〔1〕Breiman FR,Butler JC.Legionnaires'disease:clinical,epidemiological,and public health perspectives〔J〕 .Semin Respir Infect,1998,13:84-89.
〔2〕Vander EM,M Vlaspolder,F Graaff,et al.Value of intensive diagnostic microbiological investigation in low-and high-risk patients with community acquired pneumonia〔J〕.Eur J Clin Microbiol Infect Dis,2005,24:241-249.
〔3〕Yu VL,Plouffe JF,Pastoris MC,et al.Distribution of legionella species and serogroups isolated by culture in patients with sporadic community-acquired legionellosis:an international collaborative study〔J〕.J Infect Dis,2002,186:127-128.
〔4〕Fraser DW,T R Tsai,W Orenstein,et al.legionnaires'disease:description of an epidemic of pneumonia〔J〕.N Engl J Med,1977,297:1189-1197.
〔5〕McDade JE,CC Shepard,DW Fraser,T et al.legionnaires'disease:isolation of a bacterium and demonstration of its role in other respiratory diseases〔J〕.N Engl J Med,1977,297:1197-1203.
〔6〕Murdoch DR.Diagnosis ofLegionellainfection〔J〕.Clin Infect Dis,2003,36:64-69.
〔7〕Denboer JW,Yzerman EPF.Diagnosis ofLegionellainfection in legionnaires'disease〔J〕.Eur J Clin Microbiol Infect Dis,2004,23:871-878.
〔8〕Yzerman EP,Denboer JW,Lettinga KD,et al.Sensitivity of three urinary antigen tests associated with clinical severity in a large outbreak of legionnaires'disease in the Netherlands〔J〕.J Clin Microbiol,2002,40:3232-3236.
〔9〕 Abu KY.Fatal attraction of mammalian cells toLegionella pneumophila〔J〕.Mol Microbiol,1998,30:689-696.
〔10〕Horwitz MA.,SC Silverstein.Legionnaires'disease bacterium(Legionella pneumophila)multiples intracellularly in human monocy tes〔J〕.J Clin Investig,1980,66 :441-450.
〔11〕Edelstein PH,Edelstein MA,Higa F.Discovery of virulence genesLegionella pneumophilaby using signature tagged mutagenesis in a guinea pig pneumonia mode1〔J〕.Proc Natl Acad Sci USA,1999,96:l81-190.
〔12〕Edelstein PH,Hu B,Higa F.LvgA,a novelLegionella pneumophilavirulence factor〔 J〕.InfectImmun,2003, 71:2394-2403.
〔13〕Zhang Zheng,Zhu Shui-rong,Xu Bao-xiang.Study on gene detection and molecular characteristics ofLegionella pneumophila〔J〕.Chinses Journal of Health Laboratory Technology,2007,17:1978-1980.
〔14〕Liu MJ,Chen JP,Wang T,et al.Legionella pneumophilalvgA and Hsp60 gene splicing and the fusion gene expression inE.coli〔J〕.Nan Fang Yi Ke Da Xue Xue Bao,2006,26:904-909.
〔15〕Liu M,Chen J,Liao T,et al.Cloning the lvgA gene ofLegionella pneumophilaand detecting its expression inEscherichia coli〔J〕.Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2006,23 :605-608.

