乙酸正丁酯合成實驗的改進
王敏宋志國趙爽萬鑫
(1渤海大學化學化工學院 遼寧錦州 121000;2渤海大學科技實驗中心 遼寧錦州 121000)
乙酸正丁酯合成實驗的改進
王敏1宋志國2趙爽1萬鑫1
(1渤海大學化學化工學院 遼寧錦州 121000;2渤海大學科技實驗中心 遼寧錦州 121000)
對乙酸正丁酯的制備方法進行了改進。用甲基磺酸鈣作催化劑,環己烷作共沸溶劑,在回流分水條件下進行反應。對正丁醇、乙酸、環己烷和催化劑的用量進行了優化,得出較佳反應條件,在該反應條件下,酯化率可達 93%。反應結束后,催化劑經簡單的相分離就可重復使用。
隨著科技的發展,人們越來越意識到環境保護的重要性。化學家正努力探尋著化學發展的新方向——綠色化學。綠色化學又稱環境無害化學、環境友好化學或清潔化學,是指化學反應和過程以“原子經濟性”為基本原則,即在獲取新物質的化學反應中充分利用參與反應的原料,在始端就采用實現污染預防的科學手段,因而過程和終端極大降低了排放和污染,是一門從源頭阻止污染的化學[1]。
在大學化學教學中滲透綠色化學思想是必要和可行的[2],用綠色化學思想來指導和規范化學實驗教學具有重要的意義。在高校培養化學專業人才過程中,實驗課是很重要的,其目的在于理解、認識化學反應事實,培養學生嚴謹的科學態度和良好的工作習慣。化學教育工作者應具有綠色化學的思想,在實驗教學中注重培養學生建立綠色化學意識。在高校有機化學實驗中,酯的合成是具有典型性和代表性的實驗之一,該反應可以用質子酸或路易斯酸進行催化。目前國內外有機化學實驗教材中大部分采用濃 H2SO4作催化劑,在圓底燒瓶中回流反應3~6h合成酯[3-6]。該方法不但對環境有污染,而且收率較低,只有 50%左右。
為了克服以上酯化反應的缺點,解決實驗中的污染問題,我們采用甲基磺酸鈣作催化劑,環己烷作共沸溶劑,在回流分水條件下反應 2.5h,酯化率可達 93%。反應結束后,催化劑經簡單的相分離就可重復使用。該方法操作簡單,適宜實驗教學。該反應的方程式如下:

1 實驗部分
1.1 儀器與試劑
儀器:上海精密科學儀器有限公司 GC-122型氣相色譜儀,美國 VAR IAN公司 Scimitar 2000型紅外光譜儀,上海物理光學儀器廠 2WA-J型阿貝折光儀,電子分析天平。
試劑:乙酸(AR),正丁醇(AR),環己烷(AR),乙醇 (AR),甲基磺酸 (CP),氧化鈣 (AR),去離子水。
1.2 甲基磺酸鈣的制備
稱取 19g(0.20mol)甲基磺酸,將其與水按 1:1(體積比)混合后加入反應瓶內,緩慢加入5.6g(0.10mol)CaO,在攪拌下加熱回流 1.0h。趁熱過濾,洗滌,合并濾液,蒸干,在真空 100℃下干燥 3.0h,樣品為無色晶體,分子式為 Ca(CH3SO3)2,重量 20g,收率 89%。
1.3 乙酸正丁酯的合成
以較佳反應條件為例:在 100mL反應瓶中依次加入 10g(0.17mol)乙酸、14g(0.18mol)正丁醇、0.40g(0.0017mol)甲基磺酸鈣以及 2.5mL環己烷,搖勻后,測酸值。在分水器中加入一定量的飽和食鹽水(飽和食鹽水可以破壞正丁醇與水形成的氫鍵,降低正丁醇在水中的溶解度,減少正丁醇損失),再在分水器上端安裝冷凝管,在磁力加熱攪拌器上加熱回流 2.5h。反應結束后,冷卻反應體系至室溫,回收分水器中的油層到反應器中,測定其酸值,用于計算酯化率。
1.4 酯化率的測定
按 GB/T1668-95方法測定反應體系的酸值,按下式計算乙酸的酯化率:

為確定在甲基磺酸鈣的催化下是否有副反應發生,在反應結束后,從有機相中取出一部分,用氣相色譜儀進行定性分析,結果表明無任何副產品。
1.5 產品的分離及表征
將 1.3中得到的反應混合物濾出催化劑后,倒入分液漏斗中,依次用飽和碳酸鈉、飽和食鹽水洗滌至中性,有機層經無水硫酸鎂干燥后,常壓蒸餾收集 124~126℃的餾分,得無色透明液體 17g,收率 90%,折光率 nD20=1.3951(文獻值 nD20=1.3950[7])。產品用紅外光譜分析,其紅外光譜主要特征峰有:C—H吸收峰 (2963cm-1,2876cm-1),吸收峰 (1743cm-1), C—O—C吸收峰 (1244cm-1,1078cm-1),未出現羥基吸收峰,證明該產品為乙酸正丁酯。
2 結果與討論
2.1 醇酸物質的量比對酯化率的影響
傳統合成乙酸正丁酯的方法中,一般都使酸或醇過量很多,但過量太多會對環境產生廢棄物,不符合綠色化學宗旨,因此應盡量使醇酸等物質的量反應。取乙酸 0.17mol,催化劑 1.0% (物質的量分數,以酸的物質的量計,下同),環己烷 5.0mL,改變正丁醇用量,回流反應 2.5h,考察不同醇酸物質的量比對酯化率的影響,結果見表 1。實驗結果表明,隨著正丁醇用量的增加,酯化率提高。當醇酸物質的量比為 1.1:1時,酯化率達到 93%,再增大正丁醇用量,酯化率增幅不大。所以選擇醇酸物質的量比為 1.1:1,接近等物質的量醇酸酯化反應。

表1 醇酸物質的量比對酯化率的影響
2.2 溶劑用量對酯化反應的影響
酯化反應常用的共沸溶劑為苯和環己烷。由于苯毒性大,因此本實驗選用環己烷作共沸溶劑,并對其用量進行考察。若共沸溶劑用量少,起不到較好的帶水效果,反應生成的水無法被帶出反應體系;但用量過多則反應物濃度低,反應速度慢;因此,存在最佳共沸溶劑用量。用環己烷為共沸溶劑時,若其他條件不變,改變環己烷用量,實驗結果見表 2。從表 2可以看出,環己烷用量為 2.5mL時酯化率最高,可達 94%。
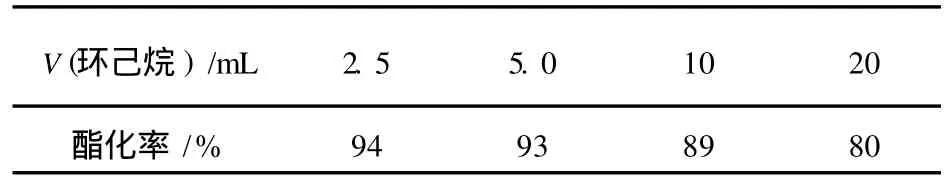
表2 環己烷用量對酯化反應的影響
2.3 催化劑用量對酯化率的影響
表3給出了催化劑用量對酯化率的影響。反應條件如下:醇酸物質的量比為 1.1:1,環己烷 2.5mL,反應時間 2.5h。用甲基磺酸鈣作催化劑,用量僅為 0.1%時,酯化率就較高;當用量增加到 0.5%時,酯化率達 93%,再增大催化劑用量,酯化率增幅不大,從節約原料的角度考慮,選擇催化劑用量為 0.5%。
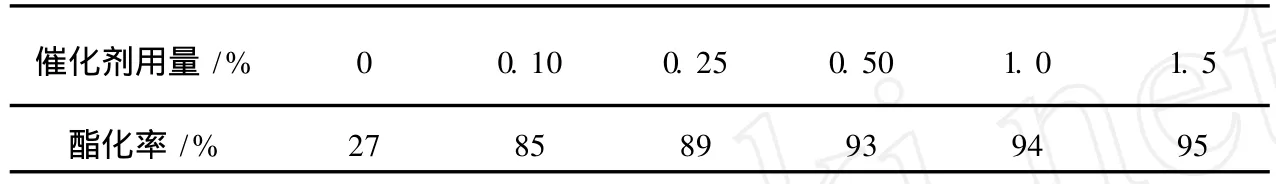
表3 催化劑用量對酯化率的影響
2.4 反應時間對酯化率的影響
醇酸物質的量比為 1.1:1,環己烷 2.5mL,催化劑用量 0.5%,考察不同反應時間對酯化率的影響,實驗結果見表 4。由表 4可知,酯化率隨反應時間增加而增大,在 2.5h時酯化反應基本完成,酯化率為 93%。再延長反應時間酯化率略有下降。因此,選擇反應時間為 2.5h,學生完全可以在規定課時內完成實驗。

表4 反應時間對酯化率的影響
2.5 甲基磺酸鈣的重復使用性能
甲基磺酸鈣是一種耐水性 Lewis酸,具有很好的水溶性,反應為均相催化,但甲基磺酸鈣不溶于醇、酸和酯,反應結束后催化劑呈固體粉末析出,經過簡單的相分離即可重復使用,并能保持很高的催化活性。重復實驗步驟如下:反應結束后,濾出反應液,催化劑留在反應瓶中,再加入反應物與溶劑。由表 5可見,經 5次重復使用后酯化率并無明顯下降,這說明甲基磺酸鈣作為酯化反應催化劑,不僅后處理簡單,而且重復使用穩定性好,是一種綠色酯化催化劑。

表5 催化劑的重復使用
2.6 幾種甲基磺酸鹽對合成酯的催化作用
在實驗過程中還考察了另外 4種甲基磺酸鹽(甲基磺酸鑭、甲基磺酸亞鈰、甲基磺酸銅和甲基磺酸鋁)對催化合成乙酸正丁酯、氯乙酸異丙酯、乙酸苯甲酯、乙酸異戊酯的催化活性。實驗結果表明,在上述的較佳反應條件下,酯化率都在 85%以上,并且催化劑連續重復使用 5次,活性均無明顯下降(表 6)。這說明甲基磺酸鹽作為酯化反應催化劑的適用范圍較廣。

表6 幾種甲基磺酸鹽對合成酯的催化作用
2.7 酯化反應機理
對甲基磺酸鹽來說,陰離子部分體積較大,金屬離子與甲基磺酸基中的硫氧鍵有協同配位作用,使電荷離域更充分,穩定性增強,從而使金屬離子的 Lewis酸性增強。在反應過程中,醇羥基可能與雙鍵形成配體。由于配體的形成,在一定溫度下,乙酸酰氧鍵斷裂,OH-與H+極易結合生成水,最終被共沸溶劑轉移出反應體系,脫去羥基的酸和烷氧基結合生成酯。以甲基磺酸鈣催化合成乙酸正丁酯實驗為例,反應可能形成的反應中間體如圖 1所示。
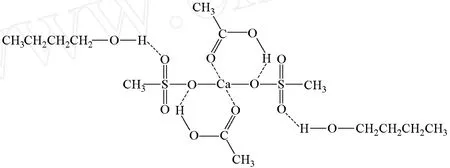
圖1 甲基磺酸鈣催化酯化可能形成的反應中間體
3 結論
與傳統催化劑濃硫酸相比,雖然本文使用的催化劑甲基磺酸鈣增加了合成成本,但用量少,且可多次循環使用;而且使用該催化體系,產率提高將近 1倍。建議用于學生實驗的較佳條件為:醇酸物質的量比 1.1:1,催化劑用量 0.5%,環己烷 2.5mL,回流分水時間 2.5h。整個實驗過程工藝簡單、無污染,對培養學生綠色化學意識很有意義。
[1] Anastas P T,Warner J G.Green Chemistry,Theory and Practice.Oxford:Oxford University Press,1998
[2] 汪朝陽,李景寧.大學化學,2001,16(2):19
[3] 曾昭瓊.有機化學實驗.第 3版.北京:高等教育出版社,2000
[4] 北京大學化學學院有機化學研究所.有機化學實驗.第 2版.北京:北京大學出版社,2002
[5] 張毓凡,曹玉蓉,馮宵,等.有機化學實驗.天津:南開大學出版社,1999
[6] 奚關根,趙長宏,高建寶.有機化學實驗.上海:華東理工大學出版社,1999
[7] 周華,屈小英,余高奇.武漢科技大學學報(自然科學版),2007,30(6):629

