高效液相色譜-基質輔助激光解吸電離串聯飛行時間質譜分離鑒定牛乳鐵蛋白素
安美忱, 劉 寧
(東北農業大學乳品科學教育部重點實驗室,黑龍江哈爾濱150030)
高效液相色譜-基質輔助激光解吸電離串聯飛行時間質譜分離鑒定牛乳鐵蛋白素
安美忱, 劉 寧*
(東北農業大學乳品科學教育部重點實驗室,黑龍江哈爾濱150030)
建立了高效液相色譜-基質輔助激光解吸電離串聯飛行時間質譜(MALD I-TO F/TO F MS)分離鑒定牛乳鐵蛋白素(bovine lactoferricin,Lfcin B)的方法。采用胃蛋白酶酶解牛乳鐵蛋白,酶解液離心后取上清液,經過離子交換色譜、反相液相色譜、透析等技術分離,對分離得到的目標產物進行抗菌活性分析、蛋白含量測定和MALD ITOF/TO F MS鑒定。分離得到高活性的LfcinB,其相對分子質量為3 124.89,蛋白含量為18.20μg/mL。本方法具有精度高、分析速度快和分辨能力強等優點,是其他傳統的分析鑒定LfcinB方法所無法比擬的,為進一步研究LfcinB奠定了基礎。
高效液相色譜;基質輔助激光解吸電離串聯飛行時間質譜;牛乳鐵蛋白素;牛乳鐵蛋白
Abstract:A high performance liquid Chromatography-matrix-assisted laser desorption/ionization time of flight/time of flight mass spectrometry(HPLC-MALD I-TO F/TO F MS)method was developed for the separation and identification of bovine lactoferricin(LfcinB).Bovine lactoferrin was hydrolyzed by pepsin and then separated by ion exchange Chromatography and reversed-phase liquid Chromatography(RP-LC).The antibacterial activities of the fractions from RP-LC separation were determined and the protein concentration of the fraction with the highest activity was measured,whose sequence was indentified by MALD I-TO F/TO F MS.The relative molecular mass of LfcinB was3 124.89and the protein concentration was18.20μg/mL.The method of producing LfcinB proposed in this study has fast speed,high accuracy and high resolution.
Key words:high performance liquid Chromatography(HPLC);matrix-assisted laser desorption/ionization time of flight/time of flight massspectrometry(MALD I-TO F/TO F MS);bovine lactoferricin;bovine lactoferrin
牛乳鐵蛋白(bovine lactoferrin)是富含在牛初乳中的一種功能因子,是轉鐵蛋白家族中一種天然的鐵離子結合糖蛋白,參與鐵的轉運,并具有抗菌、抗病毒、抗癌、調節免疫系統、抗氧化和促進骨骼生長等功能[1,2]。牛乳鐵蛋白雖然具有一定的抗菌活性,但酶解后可獲得活性更高的抗菌肽段。已有若干種抗菌肽段從牛乳鐵蛋白的酶解液中獲得,其中牛乳鐵蛋白素(bovine lactoferricin,LfcinB)因抗菌活性最強而成為研究熱點[3,4]。LfcinB來源于牛乳鐵蛋白的第17~41位氨基酸,由25個氨基酸殘基組成,氨基酸順序為Phe(F)-Lys(K)-Cys(C)-A rg(R)-A rg(R)-Trp(W)-G ln(Q)-Trp(W)-A rg(R)-M et(M)-Lys(K)-Lys(K)-Leu(L)-G ly(G)-A la(A)-Pro(P)-Ser(S)-Ile(I)-Thr(T)-Cys(C)-Val(V)-A rg(R)-A rg(R)-A la(A)-Phe(F),包括5個A rg、2個Trp和多個芳香族氨基酸殘基,具有強堿性,其p I>8.5,相對分子質量(Mr)為3 124,其中的2個Cys通過形成分子內二硫鍵使LfcinB分子呈環狀結構[5,6]。LfcinB還具有普通抗生素所不具有的一系列優點,特別是廣譜的抗菌能力和不易產生耐藥性等特點。此外,它在抑制病毒、真菌和腫瘤細胞的同時,對真核細胞幾乎沒有毒性[7-9]。
近年來,研究人員一直尋求建立一種快速分離、鑒定LfcinB的方法。1991年,Tom ita等[10]酶解乳鐵蛋白得到LfcinB粗組分,然后利用液相色譜和電泳方法分離鑒定LfcinB。1998年,Sh im azaki等[11]通過色譜方法分離得到LfcinB,并結合液相色譜-質譜和N端氨基酸分析鑒定了LfcinB。2007年,龐廣昌等[12]利用超濾的方法得到純度分別為40%和80%的LfcinB。本文建立的方法通過色譜技術分離得到LfcinB,并利用基質輔助激光解吸電離串聯飛行時間質譜(MALD I-TO F/TO F MS)快速鑒定LfcinB的氨基酸序列。與其他傳統的分析鑒定LfcinB的方法相比,本方法具有精度高、分析速度快和分辨能力強等優點,為進一步研究LfcinB奠定了基礎。
1 實驗部分
1.1 原料、試劑和儀器
1.1.1 原料和主要試劑
乳鐵蛋白購自Sigm a公司,大腸桿菌(E.coli)ATCC25922購自黑龍江省微生物研究所,金黃色葡萄球菌(S.au reus)ATCC25923購自中國藥品生物制品檢定所,磷酸氫二鈉(分析純)、磷酸二氫鈉(分析純)、乙腈(色譜純)、三氟乙酸(TFA,色譜純)、胃蛋白酶和BCA蛋白濃度(增強型)測定試劑盒(碧云天生物技術研究所),α-氰基-4-羥基肉桂酸和營養肉湯培養基(北京奧博星生物技術責任有限公司)。
1.1.2 儀器設備
1.2 實驗方法
1.2.1 樣品制備
稱取5g牛乳鐵蛋白溶于100mL水中,用1 mol/L的HCl調節溶液pH至2.5,然后加入胃蛋白酶在37℃下酶解4h,酶解液在80℃下加熱15 m in,使酶完全失活。將酶解液冷卻到20℃,滴加1 mol/L的N aOH調節溶液pH至7.0,于4℃下離心(17 000g)15m in,收集上清液,置于4℃下保存待用。
1.2.2 離子交換色譜法分離LfcinB
陽離子交換色譜柱:H iTrap SP XL(1mL,美國Am ersham公司)。進樣量:500μL。檢測波長:215 nm。流動相:A溶液,50mmol/L N a3PO4水溶液(含10%乙腈);B溶液,50mmol/L N a3PO4水溶液(含1mol/L N aC l和10%乙腈)。于25℃下進行分離。用A溶液平衡15m in后進樣。先用A溶液淋洗11m in,除去雜蛋白。再進行梯度洗脫:第一步用50%的B溶液洗脫15m in,第二步用100%的B溶液洗脫10m in,流速為1mL/m in。收集第二步梯度洗脫峰,得到LfcinB的粗分離組分。將粗分離組分放置于截流Mr為1 000的半透膜中,在pH 8.0的超純水中透析24h,脫鹽后凍干保存。
1.2.3 反相液相色譜法分離LfcinB
反相液相色譜柱:SOURCETM5RPC ST(150 mm×4.6mm,美國Am ersham公司)。進樣量:500μL。檢測波長:215nm。流動相:A溶液,0.1%(體積分數)的三氟乙酸水溶液;B溶液,乙腈-0.09%三氟乙酸水溶液(9∶1,v/v)。25℃下進一步分離。先用20%的B溶液平衡5m in再進樣,然后進行線性洗脫:在30m in內從20%B溶液升到50%B溶液,流速為1mL/m in。收集相應的洗脫峰并凍干。
1.2.4 抗菌活性分析
抗菌活性測定采用瓊脂擴散法,選擇大腸桿菌和金黃色葡萄球菌做指示菌。1.2%(質量分數)的素瓊脂,按每個培養皿10mL傾倒在無菌培養皿中晾干;制備含0.7%(質量分數)瓊脂的軟瓊脂培養基,冷卻至50℃左右,每100mL接入0.6mL過夜培養的指示菌菌液,在底層有瓊脂的培養皿上傾倒8mL含有指示菌的軟瓊脂培養基晾干;用打孔器在涂有指示菌的培養基上打孔,孔直徑8mm;分別在孔中加入200μL質量濃度為1m g/mL反相液相色譜分離得到的洗脫峰溶液,超凈工作臺上放置3h;置于37℃下培養16h。用游標卡尺測量抗菌圈直徑。
第一,這是稻谷生產合作社辦的。“糧食銀行”的運行,與合作社提供的其他各項生產服務密切聯系在一起,能夠讓農民有獲得感,同時合作社也能較好地減輕收購資金的壓力,獲得優質稻谷原料,“糧食銀行”的各種運行成本也能夠降到最低。
1.2.5 LfcinB的蛋白質濃度的測定
以牛血清白蛋白(BSA)為標準樣品,按碧云天生物技術研究所BCA蛋白濃度測定試劑盒(增強型)說明書指導,將標準品加入96孔板,用酶標儀在570nm波長下測定光吸收值;根據已知的標準品BSA濃度,用直線回歸法擬合標準曲線,再根據待測樣品的光吸收值算出蛋白的質量濃度(μg/mL)。
1.2.6 MALD I-TO F/TO F MS分析
肽段的Mr分析:稱取具有抗菌活性的凍干樣品1μg,溶解于100μL乙腈-0.1%三氟乙酸水溶液(1∶1,v/v),取0.8μL點靶,等樣品自然干燥后再點0.5μL基質(α-氰基-4-羥基肉桂酸),自然干燥后,將靶裝入質譜儀中進行分析。儀器參數:反射模式,掃描范圍m/z1 000~3 500,激光能量MS 4 500,質譜信號的單次掃描累加200次,正離子譜測定。
肽段質量指紋譜分析及肽段二級質譜鑒定:稱取具有抗菌活性的凍干樣品1μg,溶解于100μL乙腈-0.1%三氟乙酸水溶液(1∶1,v/v)中,取0.8 μL點靶,等樣品自然干燥后再點0.5μL基質(α-氰基-4-羥基肉桂酸),自然干燥后,將靶裝入質譜儀進行分析。儀器參數:反射模式,掃描范圍m/z800~1 500,激光能量MS4 500,MS/MS5 500,質譜信號的單次掃描累加150次,正離子譜測定。
2 結果與討論
2.1 離子交換色譜法分離LfcinB
采用H iTrap SP XL柱分離LfcinB,因LfcinB自身帶正電荷,故采用陽離子交換法進行分離。按1.2.2節的條件進行洗脫,得到的色譜圖見圖1。收集梯度洗脫峰A2組分(27~32m in),充分透析后真空冷凍干燥。
2.2 反相液相色譜法分離LfcinB
采用SOURCETM5RPC ST反相色譜柱進一步分離圖1中的A2組分,按1.2.3節方法進行分離,主要得到5個組分(見圖2)。分別收集各個組分并冷凍干燥,測定各組分的抗菌活性。

圖1 離子交換色譜分離LfcinB的色譜圖Fig.1 Chromatogram of the LfcinB separated by ion exchange chromatography

圖2 反相液相色譜分離圖1中的A2組分的色譜圖Fig.2 Chromatogram of the A2in Fig.1 separated by RP-LC
2.3 抗菌活性分析
由圖3和圖4可見,反相液相色譜分離得到的5個組分中,只有F2組分對指示菌金黃色葡萄球菌ATCC25923和指示菌大腸桿菌ATCC25922都產生明顯的抗菌圈,其余4個組分均未產生明顯的抗菌圈。初步判定F2組分為LfcinB。
2.4 LfcinB的蛋白質濃度的測定
按碧云天生物技術研究所BCA蛋白濃度測定試劑盒(增強型)說明書要求,用牛血清白蛋白做標準曲線,測定F2組分的蛋白質濃度,標準曲線線性范圍是10~2 000μg/mL,線性方程為y=0.029x+0.092 1(y為吸光值;x為蛋白質的質量濃度,μg/mL)。在570nm波長下檢測光吸收值,在96微孔板中按一定濃度分別加入20μL標準蛋白(BSA)稀釋液和F2組分后,再加入200μL BCA工作液,于37℃下放置20~30m in,然后用酶標儀測得F2組分的吸光值為0.62。根據線性方程計算F2組分的蛋白質的質量濃度為18.20μg/mL。

圖3 圖2中5個組分對金黃色葡萄球菌的抗菌活性Fig.3 Antibacterial activities of5components in Fig.2to S.aureus

圖4 圖2中5個組分對大腸桿菌的抗菌活性Fig.4 A n tibacte ria l activities of5components in Fig.2to E.coli
2.5 MALD I-TO F/TO F M S分析
采用MALD I-TO F/TO F MS對分離純化得到的有抗菌活性的F2組分進行更準確的鑒定分析。LfcinB的理論序列為FKCRR WQWRM KKLGA PSITCVRRAF。由于胰酶酶解位點是R和K,用胰酶酶解LfcinB會導致肽段被分解得太小,無法得到理想的圖譜,所以F2組分不經酶解而直接點靶。LfcinB肽段的Mr計算值為3 124.68,實際測定F2組分的Mr為3 124.89(見圖5),圖5中m/z 1 562.93為F2組分的雙電荷離子峰。實際測得的F2組分的Mr與LfcinB計算值接近,故初步判定F2組分為LfcinB。
對F2組分進行肽指紋圖譜鑒定,掃描范圍為m/z800~1 500,F2組分指紋圖譜中共有4段肽段與LfcinB的理論肽段匹配(見圖6),分別是m/z 831.46,m/z1 073.60,m/z1 201.70和m/z 1 229.68,其質譜峰歸屬見表1。

圖5 圖2中F2組分的MALD I-TO F M S一級質譜圖Fig.5 MALD I-TO F M S spectrum of F2 component in Fig.2
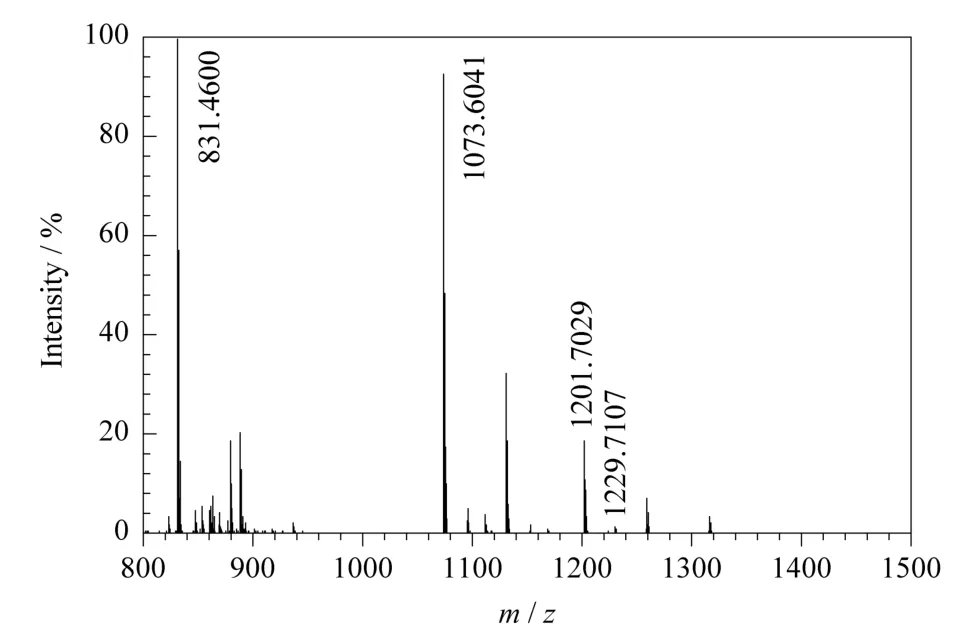
圖6 圖2中F2組分的質量指紋質譜圖Fig.6 mass fingerprint spectrum of F2 component in Fig.2
選擇F2組分質量指紋圖譜中信號強度高的m/z831.46和m/z1 073.60肽段進行MS/MS序列分析。在m/z831.46和m/z1 073.60的二級質譜圖中都可以看到連續的b和y離子峰(見圖7和圖8),表明2個豐度很高的m/z831.46和m/z 1 073.60肽段與LfcinB的氨基酸序列RWQWR和LGAPSITCVR匹配。因此,根據一級質譜和二級質譜的鑒定結果,可以確認F2組分為LfcinB。

表1 F2組分與LfcinB的理論肽段匹配的質譜峰歸屬Table1 M Speak attributions of F2component

圖7 圖6中m/z831.46(肽段RWQWR)的MALD I-TO F/TO F M S二級質譜圖Fig.7 MALD I-TO F/TO F M S spectrum of m/z831.46(p ep tide RWQWR)in Fig.6

圖8 圖6中m/z1073.60(肽段LGA PS ITCVR)的MALD I-TO F-TO F-M S二級質譜圖Fig.8 MALD I-TO F/TO F M S spectrum of m/z1073.60(p ep tide LGAPS ITCVR)in Fig.6
3 結論
本方法選用牛乳鐵蛋白為原料,采用離子色譜、反相液相色譜方法分離LfcinB,經抗菌活性分析和MALD I-TO F-TO F-MS鑒定,得到具有抗菌活性的組分LfcinB,其Mr為3 124.89,蛋白質的質量濃度為18.20μg/mL。同時,采用MALD I-TO F-TO F-MS對分離得到的目標產物進行鑒定,具有精度高、分析速度快和分辨能力強等優點,是其他傳統的分析鑒定LfcinB方法所無法比擬的。致謝 衷心感謝北京蛋白質組研究中心的賀福初院士、錢小紅老師、蔡耘老師、田芳老師和宋麗娜老師在實驗過程中給予的指導與幫助。
[1] Cornish J,Palmano K,Callon K E,et al.Biochem Cell Biol,2006,84:297
[2] Lorget F,Clough J,Oliveira M,et al.Biochem Biophys Res Commun,2002,296:261
[3] Gifford J L,Hunter H N,Voge H J.Cellmol Life Sci,2005,62:2588
[4] Jenssen H.CellMol Life Sci,2005,62:3002
[5] Dionysius D A,Milne J M.J Dairy Sci,1997,80:667
[6] Hoek K S,Milne J M,Grieve P A,et al.Antimicrob Agents Chem other,1997,41(1):54
[7] M ader J S,Salsm an J,Conrad D M,et al.mol Cancer Ther,2005,4(4):612
[8] M ader J S,Richardson A,Salsman J,et al.Exp Cell Res,2007,313:2634
[9] Furlong S J,Ridgway N,Hoskin D W.Int J Oncol.2008,32:537
[10] Tomita M,BellamyW,Takase M,et al.J Dairy Sci,1991,74:4137
[11] Shimazaki K,Tazume T,U ji K,et al.J Dairy Sci,1998,81:2841
[12] Hu Z H,Feng F,Pang G C.Food Science(胡志和,馮飛,龐廣昌.食品科學),2008,29(7):166
Separation and identification of bovine lactoferricin by high performance liquid chroma to graphy-matrix-assisted laser desorption/ionization time of flight/time of flight mass spectrometry
AN Meichen,LIU Ning*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
O658
A
1000-8713(2010)02-0180-05
*通訊聯系人:劉 寧,博士,教授,研究方向為營養與乳制品加工.Tel:(0451)55191827,E-m ail:ningliu6666@yahoo.com.cn.
東北農業大學創新團隊基金項目(No.CXT007-3-1).
2009-06-30
DO I:10.3724/SP.J.1123.2010.00180

