基質輔助激光解吸電離質譜和電噴霧電離質譜在辣根過氧化物酶糖肽結構分析中的應用
陳瑤函, 晏國全, 周新文, 楊芃原*
(1.復旦大學化學系,上海200032;2.復旦大學生物醫(yī)學研究院,上海200032)
基質輔助激光解吸電離質譜和電噴霧電離質譜在辣根過氧化物酶糖肽結構分析中的應用
陳瑤函1,2, 晏國全1, 周新文2, 楊芃原1,2*
(1.復旦大學化學系,上海200032;2.復旦大學生物醫(yī)學研究院,上海200032)
糖鏈結構的質譜解析是今后糖蛋白分析中的重要研究內容,其中完整糖肽的分析,由于可以同時獲得糖基化位點和對應糖鏈的結構信息,更具有重要意義和研究前景。本工作對質譜軟電離技術在完整糖肽分析中的應用進行了研究,其中包括了基質輔助激光解吸電離(matrix-assisted laser desorption ionization,MALD I)和電噴霧電離(electrosp ray ionization,ESI)技術。通過平行使用兩種串聯(lián)質譜(tandem mass spectrometry,MS/MS)分析策略:MALD I-MS/MS和ESI-MS/MS對目標糖蛋白——辣根過氧化物酶進行分析,并討論了其互補性。結果表明,MALD I和ESI技術各有優(yōu)劣,結合串聯(lián)質譜分析,可獲得糖肽的糖鏈結構信息;兩條路線互補使用,在揭示蛋白質糖基化修飾(位點和結構)的研究中十分必要。
基質輔助激光解吸電離質譜;電噴霧電離質譜;串聯(lián)質譜;液相色譜;辣根過氧化物酶;糖肽
Abstract:The mass spectrometric analysis of glycan composition and structure is a difficult but essential part in future study following the present glycoprotein identification.Intactgly copeptides analysis is an attracting field,in considering its capability to provide glycosite and corresponding glycan structure information at the same time.mass spectrometry has been proven to be an important and a key tool for glycan analysis over the past few years.Making use of two soft ionization techniques—matrix-assisted laser desorp tion ionization(MALD I)and electrospray ionization(ESI),through tandem mass spectrometry(MS/MS)analysis,the information for glycans of the glycopep tides can be obtained in the investigation.Meanwhile,by comparing the MALD I-MS/MS and ESI-MS/MS app roaches using model glycoprotein(horseradish peroxidase,HRP),the complementary results have been verified experimentally.We believe that the combination of the two techniques is necessary and will provide useful information for the understanding of protein glycosylation.
Key words:matrix-assistedlaser desorp tionionization(MALD I);electrosp rayionization(ESI);tandem mass spectrometry(MS/MS);liquid Chromatography(LC);horseradish peroxidase;glycopep tide
蛋白質的糖基化是生物體中最普遍和最重要的蛋白質翻譯后修飾之一,人體中大約有50%的蛋白質發(fā)生糖基化[1]。糖基化與蛋白質的物理化學性質、生物功能密切相關,涉及蛋白質折疊、定位、信號傳導、細胞黏附等等生物過程的眾多方面。一些疾病也和蛋白質的糖基化水平、糖鏈結構的變化相關[2,3]。糖蛋白的研究正得到越來越多的關注。
目前研究較多的糖基化蛋白質主要是N-鏈接糖蛋白和O-鏈接糖蛋白。前者的糖基化發(fā)生在氨基酸序列Asn-Xxx-Ser/Thr(Xxx≠Pro)的Asn殘基上,糖鏈具有由2個乙酰葡糖胺(N-acetylglucosam ine,G lcNAc)和3個甘露糖(m annose,M an)組成的五糖核心結構;后者發(fā)生在Ser或Thr殘基上,沒有明顯的氨基酸序列特征,且糖鏈核心結構不單一。蛋白質的糖基化具有宏觀和微觀的不均一性,即糖基化位點的多樣性以及同一位點糖鏈結構的多樣性,這都增加了糖蛋白研究的難度。
糖鏈結構的質譜分析方式主要有兩種:一種是將已從蛋白質或肽段上切除的糖鏈進行衍生化,通過凝集素、色譜、質譜等手段進行分析,即糖組學(glycomics)分析;另一種方式不將糖鏈與蛋白質或肽段分離,直接進行完整的糖肽的串聯(lián)質譜分析(tandem mass spectrometry,MS/MS),獲得肽段序列和糖鏈結構信息。前者可以針對性地對某類糖型(pattern)進行研究,或者對整個體系中某些糖型的變化趨勢進行反映,現(xiàn)已形成大量的研究成果[9-11];后者可以將位點和糖鏈結構對應起來[12,13],提供了解糖鏈與蛋白質功能關系的重要信息,但是由于受到分離方式、富集特異性以及糖肽在質譜中響應等的限制,目前該領域還處在不斷的發(fā)展之中,實現(xiàn)高通量的分析仍有距離[14]。
鑒于從完整糖肽獲得糖基化位點和結構信息的重要性,我們對最常用的兩種軟電離離子化方式在完整糖肽分析中的應用進行了比較。采用MALD IMS/MS和LC/ESI-MS/MS兩條路線,用一個具有多個糖基化位點的糖蛋白——辣根過氧化物酶(horseradish peroxidase,HRP)作為測試對象,目標是準確、詳盡地獲得酶解產物中的糖基化信息,以對實際樣品中目標糖蛋白的研究進行指導。結果表明,MALD I和ESI兩種模式均有其優(yōu)點,但要全面獲得糖肽信息,兩種方法的結合使用是十分必要的。
1 實驗部分
1.1 試劑與儀器
標準蛋白質辣根過氧化物酶、酶解用碳酸氫銨(NH4HCO3)、2,5-二羥基苯甲酸(2,5-dihydroxybenzoic acid,DHB)均購自Sigm a-A ldrich公司。測序級胰蛋白酶(sequencing grade modified trypsin)購自Prom ega公司。甲酸、三氟乙酸購自Fluka公司。乙腈購自Fisher Scientific公司。實驗用水為M illi-Q Filtration System(M illipore公司)二次純化水。其他試劑若無特別說明均為國產分析純。
AX IMA-Q ITTMMALD I TO F MS購自Shimadzu Biotech公司(Kyoto,Japan)。LTQ-O rbitrap XL System購自Therm o Electron公司(B rem en,Germ any)。
1.2 樣品前處理
標準蛋白質HRP溶解于25mmol/L NH4HCO3中,使蛋白質的終質量濃度為50~100ng/μL,熱變性[15]。溶液冷卻后,加入胰蛋白酶(按照胰蛋白酶與標準蛋白質質量比為1∶50的比例加入),于37℃下酶解過夜。將酶解溶液真空離心干燥,以備后續(xù)實驗使用。
1.3 色譜和質譜條件
MALD I質譜分析在AX IMA-Q ITTMMALD I TO F MS上進行。DHB溶解于含0.1%(體積分數(shù),下同)三氟乙酸的30%乙腈水溶液中,終質量濃度為12.5m g/mL,作為基質。點樣方式選擇“基質-樣品-基質”式[15]。另外,為了提高每次實驗樣品點之間的重復性,在最后一層基質結晶以后,用小于基質體積的乙醇對樣品點進行重結晶,以提高結晶的均一性[16]。MALD I質量掃描范圍分為m/z750+,m/z2 000+,m/z3 000+幾個區(qū)域,依據(jù)母離子和碎片離子的質量選擇最佳的質量掃描范圍。
ESI質譜分析在LTQ-O rbitrap XL System s上進行。真空離心干燥的蛋白酶解肽段溶于0.1%甲酸水溶液后上樣,通過Waters公司的nanoACQUITY U PLC BEH C18柱(200mm×75μm,1.7 μm)分離后,進行在線電噴霧串聯(lián)質譜分析。流動相A為含0.1%甲酸的水,流動相B為含0.1%甲酸的乙腈,梯度洗脫程序為50m in內流動相B的體積分數(shù)由初始的5%上升至最終的50%,流速為300 nL/m in。肽段串級分析為data-dependent模式(data-dependentMS/MS acquisition),選擇信號強度在前6位的母離子,動態(tài)排除0.5m in。
2 結果與討論
由于研究目標是準確、詳盡地獲得目標蛋白的糖基化信息以對實際樣品的研究進行指導,因此在對HRP進行分析時,將其看作一個經過分離得到的、確定發(fā)生N-糖基化的目標蛋白質,且蛋白質的序列已知(質譜鑒定,此處略),后續(xù)的糖肽結構分析在此基礎上進行。
2.1 MALD I-M S/M S糖肽分析
對于已知蛋白質的糖肽,MALD I-MS/MS分析中未進行糖肽水平上的富集,關鍵是在肽質譜指紋(pep tide mass fingerp rint,PM F)圖譜中尋找糖肽并手動進行串聯(lián)質譜分析。研究從已知的蛋白質序列入手,找出包含潛在糖基化位點的理論酶解肽段,在大于這些理論肽段相對分子質量(Mr)的范圍內進行PM F的篩選。對于N-糖基化,糖鏈的存在一般會造成至少892(五糖核心Mr)的Mr增量。基于這種思路,我們對大量的在一級譜圖中有足夠信號強度的質譜峰進行了串聯(lián)質譜分析。結果表明,具有特征糖鏈碎裂的MS/MS譜圖基本來自m/z2 000+范圍。值得說明的是,HRP無法用常見的糖苷酶PNGase F切除糖鏈的N-糖蛋白,因此尋找它的糖肽比較繁瑣(或需選用其他的糖苷水解酶)。對于其他PNGase F酶可以發(fā)揮作用的糖蛋白,對比其切除糖鏈前后的PM F譜圖,可以較快捷地尋找其糖肽。
在CID(collision induced dissociation)模式下,糖苷鍵比肽鍵更易碎裂。糖肽的最終確定是根據(jù)MALD I-MS/MS分析中糖鏈的碎裂特征實現(xiàn)的[17-19]。圖1列舉了兩張?zhí)请拇?lián)質譜圖,它們反映了將MALD I-MS/MS用于糖肽分析時產生的普遍特征。組成糖鏈的單糖具有特定的Mr,產生了特征質譜峰間距(N-乙酰葡萄糖胺(GlcNAc,203),甘露糖(m annose,162),海藻糖(fucose,146),木糖(xylose,132)等),如圖1中兩譜圖峰間水平箭頭上方數(shù)值標示。與糖基化位點Asn直接連接的GlcNAc(inner-most GlcNAc),在串聯(lián)質譜分析時發(fā)生跨環(huán)斷裂(cross-ring cleavage)會形成具有特定的質量差(83和120)的3個連續(xù)峰,如圖1中兩譜圖中標注為P,P*,P-GlcNAc的質譜峰,分別代表了上述3個特征連續(xù)峰。Mr最小者(P)即可指示該糖肽肽段部分的Mr,若與預測的潛在糖基化位點所在肽段吻合,則初步獲得了糖基化位點的信息(一般適于只含有一個潛在位點的肽段)。另外,在低Mr段也能發(fā)現(xiàn)少量對應于該肽段的部分酰胺鍵碎裂產生的離子(b和y離子),可進一步地證實糖基化位點。
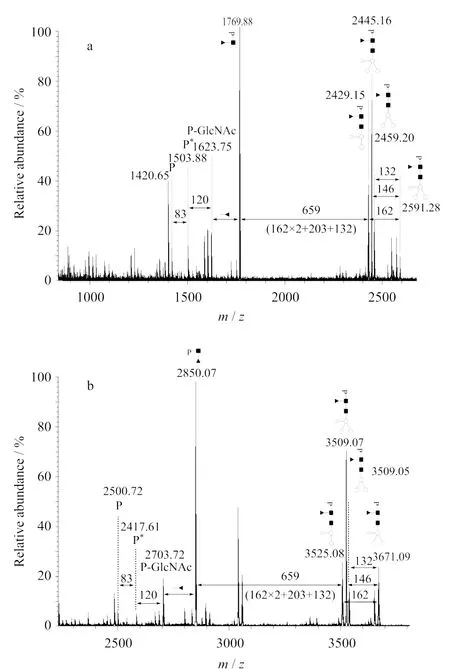
圖1 糖肽((a)m/z2591.3和(b)m/z3671.1)的MALD I-M S/M S譜圖Fig.1 Tandem mass spectra of two glycopeptides of(a)m/z2591.3and(b)m/z3671.1by MALD I analysis
2.2 HPLC/ES I-M S/M S糖肽分析
LC連接ESI質譜在線分析,理論上來說,只要樣品量足夠多和液相色譜的分離效果足夠好,自動獲取的串聯(lián)質譜圖中即包含了糖肽的信息。與MALD I-MS/MS類似,C ID模式下ESI-MS/MS分析中的糖肽譜圖也具有一定的特征,除了同樣具有反映組成糖鏈的單糖的Mr的特征質譜峰間距之外,在譜圖的低分子質量端,還具有特征地從糖肽主體碎落的寡糖碎片離子(glycan fragment ions,如[G lcNAc+H]+(204),[G lcNAcM an+H]+(366),[G lcNAcManM an+H]+(528)等)。通過提取離子色譜圖(extracted ion Chromatogram,XIC),可以初步確定糖肽的色譜保留時間,對產生這些特征寡糖碎片離子的串聯(lián)質譜圖進行篩選,可進一步縮小尋找范圍。
圖2列舉了兩張?zhí)请腅SI-MS/MS串聯(lián)質譜圖。帶多電荷的母離子在碎裂過程中大致產生了兩類容易識別的子離子,即寡糖碎片離子和糖肽相關離子(包括丟失部分寡糖的糖肽)。前者(圖2中實線方框標識部分)即用作XIC篩選,后者在譜圖中表現(xiàn)為具有單糖特征的質量差值的一組質譜峰(圖2中虛線方框標識部分)。另外,僅帶最內側乙酰葡糖胺的糖肽峰(圖2中橢圓框標識部分)在實驗中往往呈現(xiàn)出較高的峰強,該離子常被挑選作為第三級質譜分析對象,以進一步確定糖基化位點。
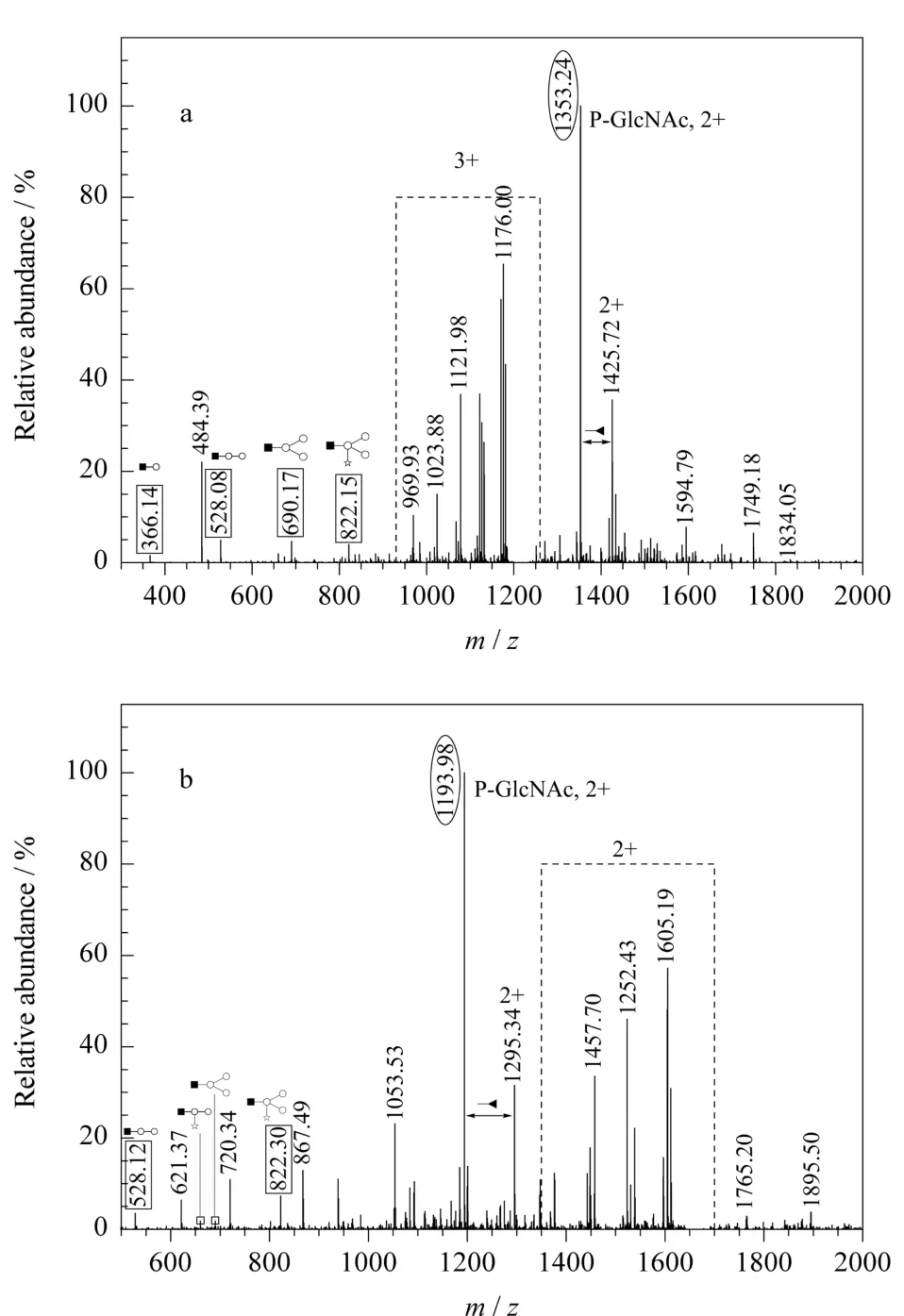
圖2 糖肽((a)m/z1225.2,正三價離子(3+)和(b)m/z 1678.2,正二價離子(2+))的ES I-M S/M S譜圖Fig.2 Tandem mass spectra of two glycopeptides of(a)m/z1225.2,chargestate3+and(b)m/z 1678.2,chargestate2+by ES Iana lysis The symbols are the same as in Fig.1.
2.3 MALD I和ES I-M S/M S解析糖肽的比較
我們對兩種方式產生的串聯(lián)質譜圖進行了詳盡的篩選和確認,以盡可能獲得全面的目標蛋白質的糖基化信息,結果如表1所示,得到確認的位點(包括其糖鏈結構)為7個。根據(jù)N etNG lyc(蛋白質的N-型糖基化位點預測軟件(http://www.cbs.dtu.dk/services/N etNG lyc/)的預測,HRP氨基酸序列中的9個NXS/T結構發(fā)生糖基化的可能性(表1中的potential)各有不同,例如,N287在進行蛋白質鑒定時即已被覆蓋,說明其未發(fā)生糖基化(或僅部分發(fā)生糖基化),這與預測結果相符(“-”),表現(xiàn)合理。另外,位點N187(“++”)所在糖肽實際上也被檢測到,但是由于該糖肽包含兩個發(fā)生糖基化的位點(另一個為N199),我們未能通過手工分析從其譜圖中獲取足夠的信息說明該位點的糖鏈結構。
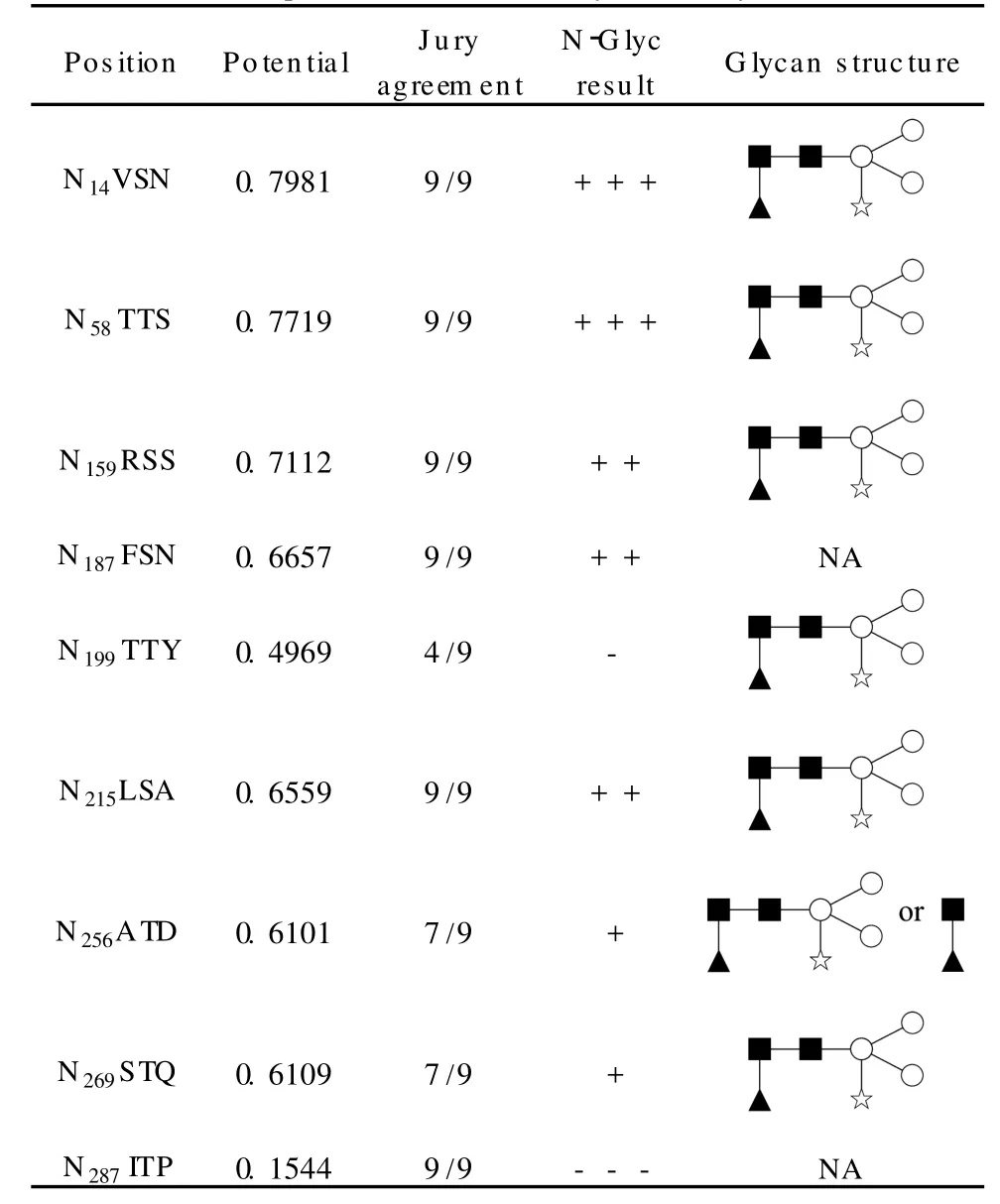
表1 HRP糖基化位點和相應的糖鏈結構及N e tNG lyc預測結果*Table1 Glycosites and corresponding glycanstructures and prediction results by NetNGlyc*
MALD I和ESI質譜在CID模式下產生的糖肽串聯(lián)質譜圖均主要表現(xiàn)為糖鏈的碎裂,而肽段部分碎裂處于次要。在涉及具體的結構解析和位點確定時,兩種方式各有優(yōu)劣。首先,對于未在肽段水平上進行富集的樣品,在定位糖肽方面,LC-ESI方式較MALD I更客觀、方便:ESI-MS/MS低分子質量端呈現(xiàn)的寡糖碎片是對糖肽進行定位和確認的重要依據(jù)之一,XIC方式可便捷地提供這樣的信息,這較于MALD I方式(受到基質峰和掃描范圍限制)只能在PM F中手工尋找更為方便。其次,對于糖鏈結構的解析,ESI方式提供的糖鏈組成信息更完全:糖肽相關峰特別是糖鏈最內側G lcNAc后端糖鏈丟失后的相關的質譜峰(如圖3中虛線框內部分),在ESIMS/MS中表現(xiàn)為有特征質量差值的峰連續(xù)出現(xiàn)(如圖2虛線框標識);而MALD I-MS/MS中呈現(xiàn)出一個斷層(如圖1中659的質量差),雖然單糖有特征質量,可以從質量差上面推導出其組成,但若遭遇結構比較復雜的糖肽其可靠性則有待考察。再次,對于糖基化位點的確定,MALD I方式能較為準確地指示肽段的Mr:MALD I-MS/MS引起最內側G lc-NAc跨環(huán)斷裂,產生具有特征質量差值的3個連續(xù)峰(P,P*,P-G lcNAc)是N-糖基化肽碎裂的普遍特征,而ESI方式在肽段部分雖然也有一定的規(guī)律(如圖2),在實驗中P-G lcNAc均表現(xiàn)為強度最強的峰,但僅憑強度來判斷比較牽強,易受干擾,一般需要三級質譜確定(三級譜圖中會出現(xiàn)類似MALD I二級譜圖的3個特征連續(xù)峰,圖略)。
圖3 HRP糖鏈結構示意圖Fig.3 G lycan structu re of HRP
另外,兩者同樣都遇到譜圖解析的問題:首先,此處HRP糖鏈較短,結構容易根據(jù)生物學合成方式推斷,對于其他帶較長糖鏈的肽段,連接方式的各種可能性大量增加,僅靠串聯(lián)質譜圖中的單糖特征質量差來判斷,信息量顯然不足,這需要軟件的協(xié)助以及結合其他分析手段(如氣相色譜-質譜聯(lián)用等);其次,譜圖中存在的可以進一步證明肽段來源和糖基化位點的b和y離子(包括帶糖鏈或不完整糖鏈的b和y離子),在人工分析不完善的情況下,若有軟件協(xié)助挖掘,則可充分利用串聯(lián)質譜圖獲得更可靠的糖基化信息。
3 結論
完整糖肽結構的分析因其重要性備受科研工作者的關注。由于目前沒有一種方法能全面地獲得糖肽結構的所有信息,所以各種手段的聯(lián)合使用顯得尤為重要。除了互補地使用MALD I和ESI兩種軟電離技術之外,負離子檢測模式[20]以及C ID和ETD(electron transfer dissociation)兩種離子化方式的聯(lián)合[21],雖還未形成通量化的成果,但也正在越來越多地應用到這個領域。另外,糖肽解析軟件也亟待開發(fā)完善,以便快速、客觀、全面地獲得糖肽結構信息。
[1] Apweiler R,Herm jakob H,Sharon N.Biochim Biophys Acta,1999,1473(1):4
[2] Dube D H,Bertozzi C R.Nat Rev Drug Discov,2005,4(6):477
[3] Taylor A D,Hancock W S,Hincap e M,et al.Genome M ed,2009,1(6):57
[4] Sun BY,Ranish J A,U tleg A G,et al.Mol Cell Proteomics,2007,6(1):141
[5] Liu T,Q ian W J,Gritsenko M A,et al.mol Cell Proteomics,2006,5(10):1899
[6] Schiess R,M ueller L N,Schm idt A,et al.mol Cell Proteomics,2009,8(4):624
[7] Cao J,Shen C P,Wang H,et al.J Proteome Res,2009,8(2):662
[8] Chen R,Jiang X N,Sun D G,et al.J Proteome Res,2009,8(2):651
[9] Alvarez-Manilla G,Warren N L,Abney T,et al.Glycobiology,2007,17(7):677
[10] Toyoda M,Ito H,Matsuno Y,et al.Anal Chem,2008,80(13):5211
[11] Kim Y G,Gil G C,Jang K S,et al.J mass Spectrom,2009,44(7):1087
[12] Seipert R R,Dodds E D,Levrilla C B.J Proteom e Res,2009,8(2):493
[13] Peltoniem i H,Joenvaara S,Renkonen R.Glycobiolgy,2009,19(7):707
[14] Dalpathado D S,Desaire H.Analyst,2008,133(6):731
[15] Zhou W,Liu X H,Zhou X W,et al.Chinese Journal of Chromatography(周瑋,劉曉慧,周新文,等.色譜),2007,25(5):623
[16] Morelle W,M ichalski J C.Nat Protoc,2007,2(7):1585
[17] WuhrerM,Catalina M I,DeelderA M,et al.J Chromatogr B,2007,849(1/2):115
[18] Wada Y,TajiriM,Yoshida S.Anal Chem,2004,76(22):6560
[19] Dom on B,Costello C E.Glycoconjugate J,1988,5(4):397
[20] Motari E,Zheng X C,Su X D,et al.Am J B iom ed Sci,2009,1(1):1
[21] Perdivara I,Petrovich R,Allinquant B.J Proteom e Res,2009,8(2):631
Combination of matrix-assisted laser desorption ionization and electrospray ionization mass spectrometry for the analysis
of in tactgly copeptides from horse radish peroxidase
CHEN Yaohan1,2,YAN Guoquan1,ZHOU Xinwen2,YANG Pengyuan1,2*
(1.Department of Chemistry,Fudan University,Shanghai 200032,China;2.Institutes of Biomedica l Sciences,Fudan University,Shanghai 200032,China)
O658
A
1000-8713(2010)02-0135-05
*通訊聯(lián)系人:楊芃原,教授,博士生導師.Tel:(021)54237416,E-m ail:pyyang@fudan.edu.cn.
國家自然科學基金課題(Nos.20735005,20975024)、國家“863”課題(No.2006AA02A308)和上海市科委課題(No.07JC140030).
2009-10-17
DO I:10.3724/SP.J.1123.2010.00135

