基于在線二維色譜的不同生長時期鹿茸的比較蛋白質組分析
高 亮, 喬曉強, 梁 振, 張麗華*, 霍玉書, 張玉奎
(1.中國科學院大連化學物理研究所,中國科學院分離分析化學重點實驗室,國家色譜研究分析中心,遼寧大連116023;2.中國科學院研究生院,北京100039;3.美國得克薩斯大學,圣安東尼奧78229-3900)
基于在線二維色譜的不同生長時期鹿茸的比較蛋白質組分析
高 亮1,2, 喬曉強1,2, 梁 振1, 張麗華1*, 霍玉書3, 張玉奎1
(1.中國科學院大連化學物理研究所,中國科學院分離分析化學重點實驗室,國家色譜研究分析中心,遼寧大連116023;2.中國科學院研究生院,北京100039;3.美國得克薩斯大學,圣安東尼奧78229-3900)
建立了基于在線二維弱陰離子交換色譜-反相液相色譜(2D-WAX-RPLC)的蛋白質分離系統,并用于不同生長時期鹿茸的比較蛋白質組分析。以5種標準蛋白質的混合物為樣品,考察了系統的重現性。通過改變標準蛋白質之間的濃度比,研究了該系統進行蛋白質相對定量的能力。在此基礎上,針對4個不同生長時期的鹿茸樣品,分別采用5種不同的方法進行蛋白質提取,經2D-WAX-RPLC分離后,收集各生長時期對應蛋白質的峰高最大比超過2的組分。酶解后,采用微柱反相液相色譜-串聯質譜(μRPLC-MS/MS)進行肽段的分離鑒定;共從9個差異蛋白質峰中鑒定到了22個差異蛋白質。研究結果表明,利用基于蛋白質水平的在線二維液相色譜分離技術找尋差異蛋白質,具有重現性好、自動化程度高等優點,可用于開展比較蛋白質組學的研究。
在線二維液相色譜;鹿茸;蛋白質組;不同生長時期;比較蛋白質組學
Abstract:A method of on-linetwo-dimensional weak anion exchange Chromatography-reversed-phase liquid Chromatography(2D WAX-RPLC)was established,and applied for the comparative proteome study of antlers with four different grow ing stages.A five-p rotein-mixture was used as the sample to evaluate the reproducibility of the system.In addition,the capacity of such a system for the relative quantitative analysis was demonstrated by analyzing protein mixtures with different concentration ratios.Furtherm ore,five different lysis buffers were used to extract proteins from antlers with different growing stages.After the protein separation with2D WAX-RPLC,the fractions with maximum peak height ratio larger than2were collected,digested,and further identified by micro-reversed-phaseliquid Chromatography-tandem mass spectrometry(μRPLC-MS/MS).In total,22differential proteins were identified from9 fractions.Our experimental results dem onstrated that2D WAX-RPLC based protein separation has the advantages of good rep roducibility and automation,and might be a complementary method of two-dimensional gel electrophoresis for comparative proteome study.
Key words:on-line two-dimensional liquid Chromatography(2D LC);antler;proteom e;different growing stages;comparative proteomics
鹿茸是哺乳動物獨立的最迅速的再生器官。它可在60d內迅速生長發育成含有強大的血管系統,并具有成骨、造血、神經、表皮生長、生毛等功能的成熟器官[1,2];在成熟后,血管又可在3~5d大量凋亡,同時軟骨迅速骨化[3]。鹿茸從新生到凋亡是各種大分子活性蛋白質與小分子輔助因子共同作用的結果。因此,作為神經、血管、結締組織、軟骨、皮膚和骨骼協調的快速再生模型,鹿茸的研究一直受到人們的關注[4,5]。以鹿茸為模型,開展不同生長階段中鹿茸蛋白質變化的研究,可以幫助我們在短時間內探討生命體修復與再生現象。
近年來,研究不同生物學狀態下蛋白質表達差異的比較蛋白質組學已成為后基因組時代的研究熱點之一[6]。傳統的比較蛋白質組學研究主要基于二維凝膠電泳(2D-PAGE)技術[7,8]。在完成蛋白質分離后,用考馬斯亮藍染色法或銀染法對蛋白質染色,切取感興趣的差異組分,酶解后進行質譜鑒定[9-11]。然而該方法不僅靈敏度低、重現性差,而且操作費時,容易造成樣品損失。U nlu等[12]提出的雙向差異凝膠電泳(D IGE)正逐漸成為比較蛋白質組學研究的主流技術。該方法主要采用3種不同的熒光染料(Cy2、Cy3、Cy5)對擬比較的蛋白質樣品進行熒光標記[13],等量混合后在同一塊膠上運行D IGE分離。經不同波長掃描,即可得到3個樣品的圖像,并通過蛋白點不同熒光信號間的比值來確定差異蛋白質[14-18]。盡管該方法的靈敏度和重現性較傳統的2D-PAGE已有提高,但其在極酸、極堿、極大、極小和極疏水性等蛋白質的分離方面仍有局限性[19,20]。此外,Cy2、Cy3和Cy5的水溶性較差,在標記過程中可能引起蛋白質沉淀。這都會限制該技術在比較蛋白質組學研究中的應用。
另一類比較蛋白質組學研究的常用技術是基于高效液相色譜-串聯質譜(HPLC-MS/MS)的技術。目前主要通過對標簽修飾的肽段進行分離、鑒定和比較。常用的標記方法可分為同位素親和標簽(ICAT)技術和相對和絕對定量同位素標記(iTRAQ)技術。前者采用含輕重同位素和生物素的親和標簽標記半胱氨酸,利用親和素富集后進行HPLC-MS/MS分析[21];后者利用能與氨基反應的同位素標簽同時對多個樣品的酶解產物標記后,再根據HPLC-MS/MS的分析結果進行比較蛋白質組學研究[22,23]。這兩種方法均是在肽段水平上對蛋白質進行定量分析。然而,和蛋白質水平的分離相比,肽段的數目巨大,影響了分離鑒定的分辨率和準確性[24,25]。
本文發展了一種基于二維弱陰離子交換色譜-反相液相色譜(2D-WAX-RPLC)的蛋白質水平分離的比較蛋白質組學研究方法,并將其成功應用于不同生長時期的鹿茸蛋白質的差異分析。
1 實驗部分
1.1 儀器和試劑
WAX采用Jasco HPLC儀,包括四元梯度泵(PU-2089Plus)、自動進樣器(AS-2055Plus)、紫外檢測器(UV-2075Plus)和LC-N etⅡ/ADC控制系統(Jasco公司,日本)。蛋白質分離的WAX色譜柱為TSKgel D EAE-5PW(75mm×7.5mm,100nm(1 000)(TOSOH公司,日本)。
自動十通閥為Rheodyne MX7960(Upchurch公司,美國)。捕集柱為自填裝C8柱(50mm×4.6 mm,5μm,30nm(300A。),大連思譜精工公司)。
RPLC分離在Jasco HPLC儀(包括泵(PU-1580)、梯度控制單元(LG-1580-04)和紫外檢測器(UV-1575))上進行。蛋白質分離的RPLC色譜柱為自填裝C8柱(250mm×4.6mm,5μm,30nm(300),大連思譜精工公司)。
質譜儀為LCQ DUO離子阱質譜(Therm o Fisher公司,美國),與paradigm GM4μHPLC系統(M ichrom B ioresources Inc.,美國)聯用。肽段分離的μRPLC色譜柱為自填裝C18柱(50mm×0.3 mm,5μm,20nm(200A。),天津博納公司)。
三羥甲基氨基甲烷(Tris)、鹽酸胍、二硫蘇糖醇(D TT)、細胞色素C(相對分子質量(Mr)為14 000,p I=9.6)、肌紅蛋白(Mr=16 890,p I=7.2)、碳酸酐酶(Mr=29 023,p I=6.6)、牛血清白蛋白(BSA,Mr=69 000,p I=5.8)、β-乳球蛋白(Mr=35 000,p I=5.1)和胰蛋白酶購自美國Sigm a公司;三氟乙酸(TFA)購自比利時Acros公司;乙二胺四乙酸鈉(ED TA)、HC l和N aOH購自天津科密歐試劑公司;色譜純乙腈購自德國M erck公司;實驗用水經法國M illi-Q系統純化。
生長期分別為15,30,50和90d的馬鹿鹿茸采自撫順清原馬鹿養殖場。
1.2 實驗方法
1.2.1 樣品制備
分別配制6m g/mL的細胞色素C、肌紅蛋白、碳酸酐酶、牛血清白蛋白和β-乳球蛋白儲備液,等體積混合后用于評價2D-WAX-RPLC系統。
依次記生長期分別為15,30,50和90d的馬鹿鹿茸為生長期1,2,3和4。將鹿茸在液氮條件下冷凍后研磨粉碎,分別加入1.2mol/L HCl、2 mol/L N aOH、100mmol/L Tris+6mol/L鹽酸胍、100mmol/L Tris+6mol/L鹽酸胍+0.5mol/L ED TA以及100mmol/L Tris+6mol/L鹽酸胍+0.5mol/L ED TA+65mmol/L D TT5種溶液(均含1%蛋白酶抑制劑Cocktail Set I)(按1g鹿茸加入4mL的比例加入每種溶液)。在4℃下提取蛋白質24h,依次標記為蛋白質提取液1,2,3,4和5。離心后取上清液過0.45μm濾膜,并用B radford法測定蛋白質濃度[26]。將5種蛋白質提取液等體積混合并除鹽后,用WAX初始流動相復溶。
1.2.2 2D-WAX-RPLC分離
利用十通閥連接WAX和RPLC,并采用兩根C8捕集柱交替地將第一維洗脫組分捕集后,送入RPLC色譜柱進行進一步的分離,系統示意圖見圖1。

圖1 2D-WAX-RPLC系統示意圖Fig.1 Schem a tic d iagram of2D WAX-RPLC
采用5種標準蛋白質的混合物評價2D-WAXRPLC系統的重現性。第一維WAX的色譜條件:流動相A為50mmol/L Tris-HC l(pH8.0),流動相B為50mmol/L Tris-HC l+1mol/L N aC l(pH8.0);流速1mL/m in;4個臺階梯度依次為10%B,25%B,40%B和55%B;檢測波長為214nm。第二維RPLC的色譜條件:流動相A為水(含0.1%TFA),流動相B為95%乙腈(含0.1%TFA);流速1 mL/m in;梯度洗脫程序:0-10m in,5%B;10-40 m in,30%B-60%B;檢測波長為214nm。
在分離不同生長時期的鹿茸蛋白質樣品時,第一維WAX的色譜條件:流動相A為50mmol/L Tris-HCl(pH9.0),流動相B為50mmol/L Tris-HC l+1mol/L N aCl(pH9.0);流速1mL/m in;9個臺階梯度依次為0%B,4%B,8%B,12%B,20%B,30%B,40%B,50%B和100%B;檢測波長為214nm。第二維RPLC的色譜條件:流動相A為水(含0.1%TFA),流動相B為95%乙腈(含0.1%TFA);流速1mL/m in;梯度洗脫程序:0-10 m in,2%B;10-70m in,25%B-60%B;70-80 m in,80%B;檢測波長為214nm。
1.2.3 差異蛋白質的鑒定
根據2D-WAX-RPLC分離的二維譜圖,選取對應蛋白質峰的峰高最大比超過2的餾分進行收集,作為4個生長時期之間有顯著差異的蛋白質。將這些餾分凍干后重溶于50mmol/L Tris-HC l(pH 8.3)緩沖液,按照蛋白質與酶的質量比為50∶1的比例加入胰蛋白酶,于37℃振蕩酶解24h后,加入甲酸終止酶解反應。
采用μRPLC-MS/MS分離鑒定差異蛋白質的酶解產物,重復進樣3次。色譜條件:流動相A為0.1%甲酸+98%水+2%乙腈,流動相B為0.1%甲酸+98%乙腈+2%水;流速5μL/m in;梯度洗脫程序:0-10m in,0%B;10-55m in,0%B-40%B;55-60m in,40%B-80%B。質譜采用正離子掃描模式,噴霧電壓2.0kV,加熱毛細管溫度150℃,掃描范圍:m/z400~2 000;二級質譜采集選擇數據依賴模式,取一級質譜圖中豐度最高的兩個離子作為母離子,碰撞能量35%。
1.2.4 數據分析
質譜數據采用B iow orks3.1檢索系統(Therm o Fisher公司)進行檢索。哺乳動物數據庫下載自美國國立生物技術信息中心(NCB I)網站(2007年7月11日)。母離子和子離子質量容忍范圍分別為2和1。采用胰蛋白酶全酶切對肽段結果進行搜索,最高允許兩個漏切位點。搜索結果采用Xcorr函數進行過濾,單電荷離子Xcorr≥1.90,雙電荷離子Xcorr≥2.20,三電荷離子Xcorr≥3.75。
2 結果與討論
2.1 在線2D-WAX-RPLC分離標準蛋白質混合物
如圖1所示,WAX模式下蛋白質根據帶電情況進行分離;經臺階梯度洗脫后,各組分交替捕集到位于十通閥上的兩個平行C8捕集柱上;隨后,依次進入RPLC色譜柱,根據蛋白質的疏水性進行分離。由于兩維之間的分離機理具有正交性,從而確保了2D-WAX-RPLC系統具有較高的分辨率和峰容量。
選取質量濃度均為1.2m g/mL的5個標準蛋白質的混合物對2D-WAX-RPLC系統進行了評價。從基于Transform軟件制作的2D-WAX-RPLC譜圖(圖2a)可以看出,在WAX柱上,細胞色素C、肌紅蛋白和碳酸酐酶在第二個臺階內被洗脫;β-乳球蛋白和牛血清白蛋白在第三個臺階內被洗脫。這兩組蛋白質在第二維RPLC柱上均得到了進一步分離,實現了5種蛋白質的完全分離。
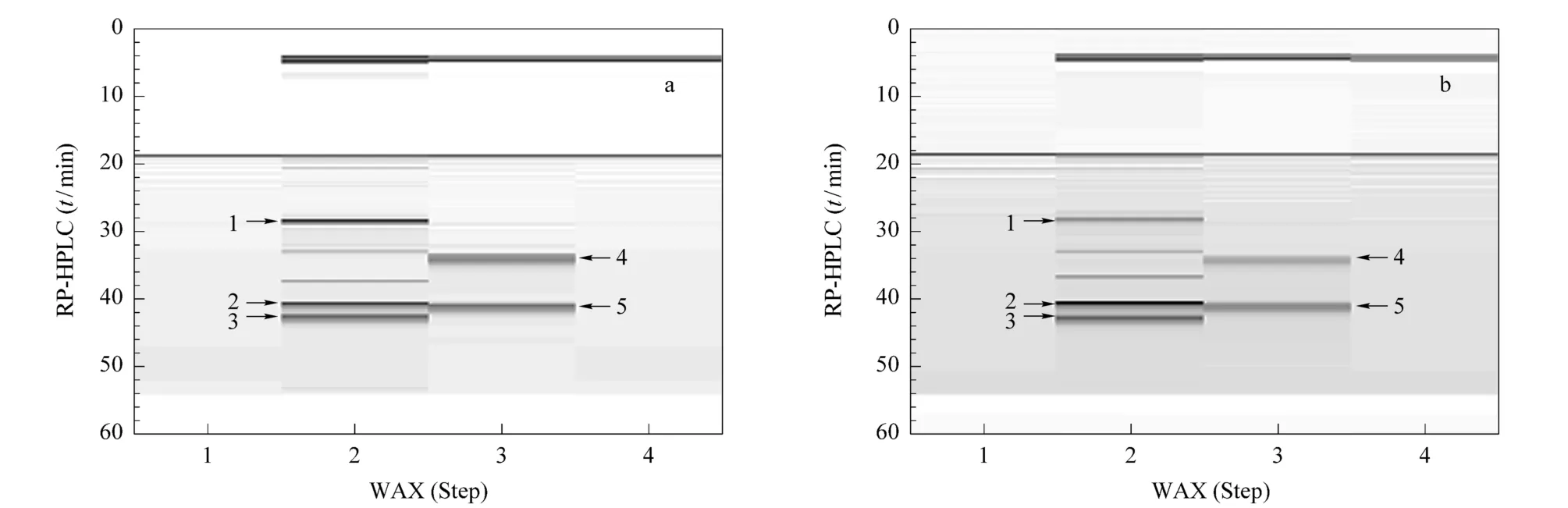
圖2 5種標準蛋白質混合溶液的2D-WAX-RPLC分離二維投影圖Fig.2 two-dim ensiona l con tou r p lo ts of a five-p rote in mixture sepa ra ted by2D-WAX-RPLC
為了進一步考察該2D-WAX-RPLC系統進行蛋白質相對定量分析的能力,將蛋白質混合物中細胞色素C和牛血清白蛋白的濃度降低一半,肌紅蛋白濃度增加一倍,其余蛋白濃度不變。如圖2b所示,相對于圖2a,細胞色素C和牛血清白蛋白的峰強度降低了約一半;肌紅蛋白的峰強度增加了約一倍;其余色譜峰強度不變。這均與其濃度變化一致,表明該系統可用于開展蛋白質的相對定量研究。
為了確保相對定量的準確性,考察了2D-WAXRPLC系統對蛋白質混合物分離的重現性。從表1可看出,在6次連續運行中,5種標準蛋白質保留時間和峰面積的相對標準偏差(RSD)均小于1%;在連續5d運行中,保留時間和峰面積的RSD值均小于3%。充分證明該系統具有很好的重現性。

表1 5種標準蛋白質的保留時間和峰面積的日內、日間重現性Table1 Intraday and interday reproducibilities of the re tention times and peak areas of fivestandard prote ins%
2.2 不同生長時期鹿茸蛋白質的分離
將在線2D-WAX-RPLC系統用于4個不同生長時期鹿茸蛋白質樣品的分離。由于樣品較復雜,將第一維WAX的臺階梯度增加為9個,第二維RPLC的梯度時間延長為80m in。由Transform軟件制作的2D-WAX-RPLC分離圖見圖3。可看出4個生長時期的鹿茸蛋白質有著較為明顯的差異。
收集上述二維圖中對應蛋白質峰的峰高最大比超過2的餾分(如圖3中圈示)作為4個生長時期之間有顯著差異的蛋白質。
2.3 不同生長時期鹿茸差異蛋白質的比較
將上述收集的具有顯著差異的蛋白質餾分凍干后酶解,并用μRPLC-MS/MS進行分離鑒定。在對不同生長時期的鹿茸差異蛋白質進行比較時,選取至少兩次進樣都能鑒定得到的蛋白質。其中一些蛋白質,包括線粒體內膜蛋白α螺旋結構域、依賴cAM P的蛋白激酶、泛素蛋白連接酶、轉錄調節因子和神經膠質絲狀酸性蛋白等在4個生長時期鹿茸中均能鑒定得到。這可能是受平臺分離能力所限,這些蛋白質和與之性質接近的差異蛋白質共流出,或者這些蛋白質在不同生長時期的鹿茸中存在量的差異,而不是有無的差異。
根據蛋白質有無的差異,從9個差異蛋白質餾分中共計鑒定得到了22個在4個生長時期中有顯著差異的蛋白質(見表2),其中Mr大于100 000的蛋白質有8個,占差異蛋白質總數的36%;而Mr小于20 000的蛋白質有兩個,占差異蛋白質總數的9%。這表明,采用2D-HPLC進行蛋白質分離,能在一定程度上改進二維凝膠電泳在分離極大和極小蛋白質方面的不足。

圖3 4個生長時期鹿茸蛋白質的2D-WAX-RPLC分離二維投影圖Fig.3 two-dimensional contour plots of antler proteins from the antler with four growing stages separated by 2D-WAX-RPLC(Cycled fractions with relative peak height ratios over2we recollected for further prote in ide tification.)
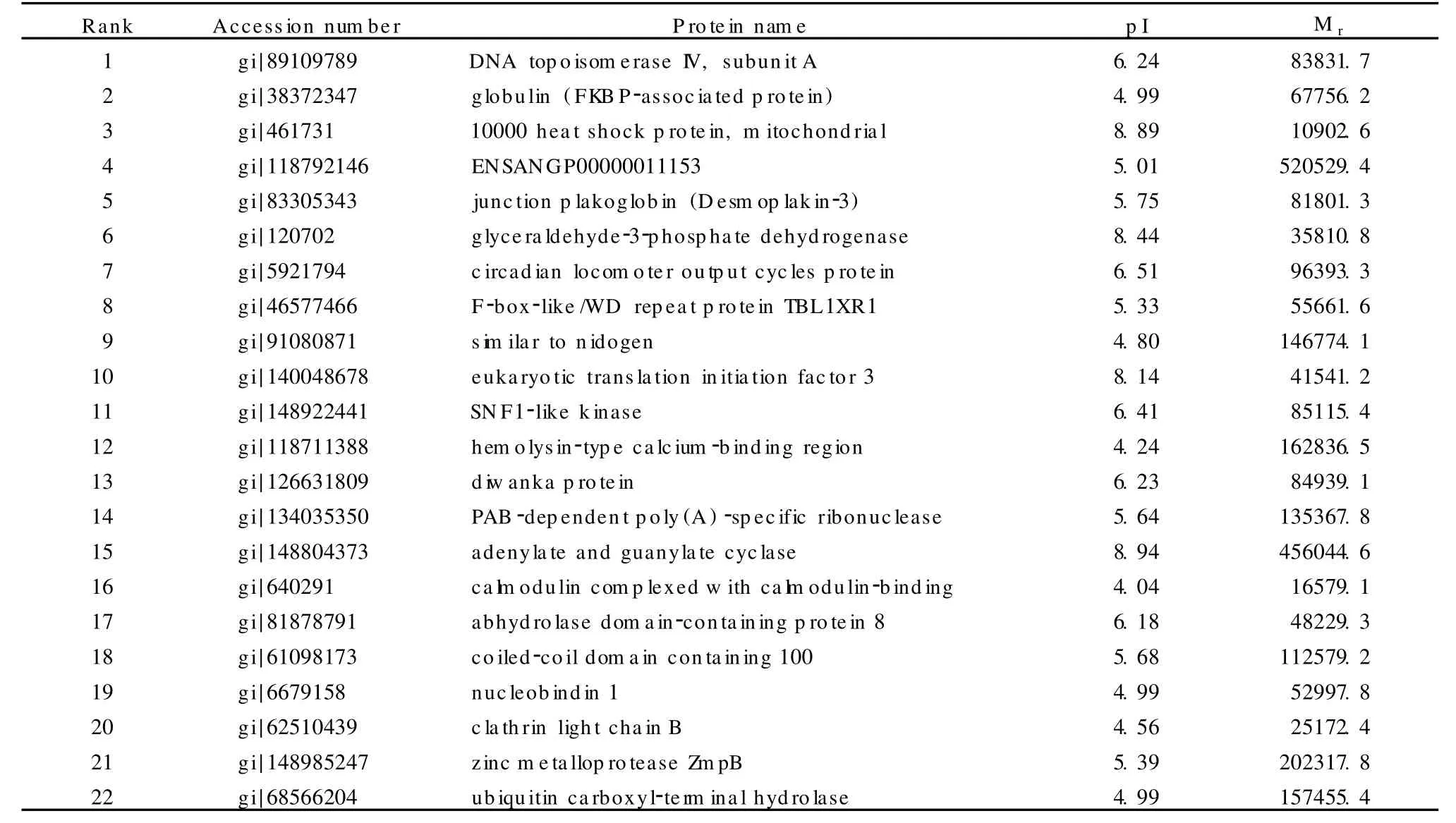
表2 4個生長時期鹿茸中的差異蛋白質Table2 Differential proteins identified from antlers from four growing stages
對發現的22個差異蛋白質的功能進行了研究,發現其中包括了與代謝相關的蛋白質8個(占36%),與復制、轉錄、翻譯相關的蛋白質6個(占27%),與細胞生長及分裂相關的蛋白質4個(占18%),與信號轉導及磷酸化相關的蛋白質2個(占9%),結構蛋白質1個(占5%)和未知功能蛋白質1個(占5%)。其中占多數的是與代謝相關的蛋白質,8個與代謝相關的蛋白質中的7個在生長期為1和2的鹿茸中鑒定得到,這可能與鹿茸生長前期代謝較為旺盛,而后期由于骨化形成、代謝變緩有關。
3 結論
本文建立了一種基于蛋白質的在線二維液相色譜分離的比較蛋白質組研究方法,并將其用于4個不同生長時期鹿茸差異蛋白質的分析。共從9個蛋白質差異峰中鑒定得到了22個差異蛋白質。實驗結果表明,這種基于蛋白質水平的液相色譜分離的方法具有很好的重現性和鑒定差異蛋白質的能力。
通過進一步提高系統的分離能力和檢測靈敏度,該方法將有望為開展比較蛋白質組學研究提供一種新的技術。
[1] Price J S,Oyajobi B O,Nalin A M,et al.Dev Dynam ics,1996,203:332
[2] Szuw art T,Kierdorf H,Kierdorf U,et al.Anat Anz,1998,180:501
[3] ColittiM,Allen S P,Price J S.J Anat,2005,207(4):339
[4] Goss R J.Nature,1968,220:83
[5] Gray C,Hukkanen M,Konttinen Y T,et al.Neuroscience,1992,50:953
[6] Pandey A,M ann M.Nature,2000,405:837
[7] O’Farrell P H.J B iol Chem,1975,250:4007
[8] Gygi S P,Corthals G L,Zhang Y,et al.Proc NatlAcad Sci USA,2000,97:9390
[9] Page M J,Am ess B,Tow nsend R R,et al.Proc Natl Acad Sci USA,1999,96:12589
[10] Srisom sap C,Subhasitanont P,O tto A,et al.Proteom ics,2002,2:706
[11] Na H K,Huang Q Y,Chen Y Y,et al.Chinese Journal of Chromatography(那宏坤,黃清育,陳盈盈,等.色譜),2008,26(6):662
[12] Unlu M,M organ M E,M inden J S.Electrophoresis,1997,18:2071
[13] Tonge R,Shaw J,M iddleton B,et al.Proteom ics,2001,1:377
[14] Gom ez A,Lopez J A,Pintos B,et al.Proteom ics,2009,9:4355
[15] B iller L,Schm idt H,Krause E,et al.Proteom ics,2009,9:4107
[16] Langereis J D,Prinsen B H C M T,de Sain-van der Velden M G M,et al.J Proteom e Res,2009,8:3824
[17] Pastorino B,Boucom ont-Chapeaublanc E,Peyrefitte C N,et al.Mol Cell Proteom ics,2009,8:1623
[18] Grzeskow iak J K,Tscheliessnig A,Toh P C,et al.J Chromatogr A,2009,1216:4902
[19] Pandey A,Ong S E.B iomol Eng,2001,18:195
[20] Gygi S P,Corthals G L,Zhang Y,et al.Proc NatlAcad Sci USA,2000,97:9390
[21] Gygi S P,RistB,Gerber S A,et al.Nat B iotechnol,1999,17:994
[22] Ross P L,Huang YN,M archese J N,et al.mol Cell Proteom ics,2004,3:1154
[23] Zhu L,N i G X,Zhang Z X,et al.Chinese Journal of Chromatography(朱鐳,倪國新,張政希,等.色譜),2009,27(3):270
[24] W itzel K,Surabhi G K,Jyothsnakum ari G,et al.J Proteom e Res,2007,6:1325
[25] Guina T,Purvine S O,Yi E C,et al.Proc Natl Acad Sci USA,2003,100:2771
[26] Bradford M M.Anal Biochem,1976,72:248
Application of on-line two-dimensional bliquid chromatography in comparative proteome analysis of antlers with different growing stages
GAO Liang1,2,Q IAO Xiaoqiang1,2,LIANG Zhen1,ZHANG Lihua1*,HUO Yushu3,ZHANG Yukui1
(1.Key Laboratory of Separation Science for Analytical Chemistry,National Chromatographic R.& A.Center,Dalian Institute of Chemica l Physics,Chinese Academy of Sciences,Da lian 116023,China;2.Graduate School of Chinese Academy of Sciences,Beijing 100039,China;3.The University of Texas,San Antonio,Texas 78229-3900,USA)
O658
A
1000-8713(2010)02-0146-06
*通訊聯系人:張麗華,博士,研究員,主要研究方向為蛋白質組學分離鑒定新技術新方法的研究.Tel:(0411)84379720,E-m ail:lihuazhang@dicp.ac.cn.
國家重大科學研究計劃項目(No.2007CB914100)和國家自然科學基金項目(No.20775094).
2009-12-28
DO I:10.3724/SP.J.1123.2010.00146

