缺血性腦損傷中大鼠海馬CA1區熱休克相關因子變化的研究*
宋遠見,劉紅芝,溫相如,劉永民
(徐州醫學院:1.基礎學院;2.公共教育學院,江蘇 221004)
缺血性腦損傷常因腦血液循環障礙所致,患者常表現為猝然昏撲、不省人事或突然發生口歪眼斜、舌強言蹇、半身不遂、智力障礙等臨床特征。據報道,每年約460萬人死于腦卒中,其中約86%因缺血所致。因此,積極探索缺血性腦損傷中所涉及關鍵因子的狀況,具有極其重要的醫學價值。熱休克蛋白72(heat shock proteins72,HSP72)是HSP家族中最重要的成員,也是應激誘導表達最多的成員。作為重要的分子伴侶,HSP72能夠結合各種變性蛋白,以防這些蛋白遭受免疫細胞的攻擊[1],因此HSP72對維持細胞穩態和細胞存活具有重要意義。本實驗以大鼠雙側頸總動脈結扎腦缺血動物模型為基礎,研究HSP72 mRNA和HSP72蛋白在缺血再灌注不同時期的表達情況,可望為進一步探討HSP72在缺血性腦損傷中的作用機制提供可靠的實驗基礎。
1 材料與方法
1.1 動物及分組 雄性健康SD大鼠80只,體質量為250~300 g,均為清潔級。將大鼠隨機均分為甲、乙兩組,甲組用于檢測HSP72 mRNA的表達,乙組用于檢測HSP72蛋白的表達。甲、乙每個組又分別分為 8組,即假手術組(Sham)、缺血再灌注30 min組(I/R30 min)、缺血再灌注3 h組(I/R3 h)、缺血再灌注12 h組(I/R12 h)、缺血再灌注1 d組(I/R1 d)、缺血再灌注3 d組(I/R3 d)、缺血再灌注 5 d組(I/R5 d)和缺血再灌注7 d組(I/R7 d),每組5只。
1.2 實驗方法
1.2.1 動物模型制備 腹腔注射20%水合氯醛(300~350 mg/kg)麻醉動物后,分離雙側頸總動脈并以寬松繩線套住但不結扎,電凝雙側椎動脈[2-3]。手術第2天在動物清醒狀態下結扎雙側頸總動脈,全腦缺血15 min,然后再灌注不同的時間。缺血時保持直腸溫度為36.5~37.5℃。假手術組實施與實驗組相同的處理,但不結扎雙側頸總動脈。
1.2.2 樣品制備和免疫印跡檢測 甲組參照Nikaido等[4]使用的方法,使用Trizol試劑盒抽提樣品中總RNA,使用 RTPCR試劑盒進行檢測,引物序列為:5′-CCG GAG AGA AGG AGT AAC TTG ATA AG-3′,5′-TGG ATT AGA GGC TTT TCT GGC TC-3′。以β-肌動蛋白(β-actin)作為內參照,引物序列為 :5′-TGA ACA CGG CAT TGT AAC CAA C-3′,5′-CAG TGG TACGAT GTA ACC AAC-3′。擴增產物經2%瓊脂糖電泳,利用Sensiansy凝膠圖像分析軟件進行拍照并進行電泳圖像分析。以I/R3 h組為基準(假設為1),其余各組與之相除所得比值見表1。
表1 海馬CA1區HSP72 m RNA表達情況(±s)

表1 海馬CA1區HSP72 m RNA表達情況(±s)
檢測指標 Sham I/R30 min I/R3 h I/R12 h I/R1 d I/R3 d I/R5 d I/R7 d HSP72 m RNA 0.12±0.12 0.25±0.13 1 1.51±0.23 2.34±0.15 5.66±0.19 3.13±0.24 1.89±0.17
乙組于大鼠快速斷頭取腦后,分離出雙側海馬CA 1區,置液氮中凍存。下面步驟中的操作均在冰水浴中實施。由液氮中取出海馬CA1區,注入1.5 mL內含蛋白酶抑制劑的勻漿緩沖液,勻漿(10 s×6次)后,800×g離心 10 min,棄去上清液,加入0.6 m L buffer B振蕩搖勻,12 000×g離心10 min,取上清液,按改良Lowry法,用牛血清清蛋白作為標準蛋白測蛋白后分裝,置于-80℃冰箱備用。按宋遠見等[5]的方法,等量蛋白樣品經7.5%SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離后,電轉移至NC膜上。轉移后的NC膜經3%BSA室溫封閉3 h后加入HSP72一抗,4℃過夜。用洗滌緩沖液洗膜3遍,加入二抗IgG,37℃孵育2 h,再用洗滌緩沖液洗膜3遍。用NBT/BCIP顯色,雙蒸水沖洗以終止反應。結果用圖像處理儀(Gene Company)分析處理。
1.3 統計學方法 采用SPSS10.0統計軟件,所得數據以±s表示,組間比較采用方差分析。以P<0.05為差異有統計學意義。
2 結 果
HSP72 mRNA表達見表1,HSP72蛋白表達見圖1。
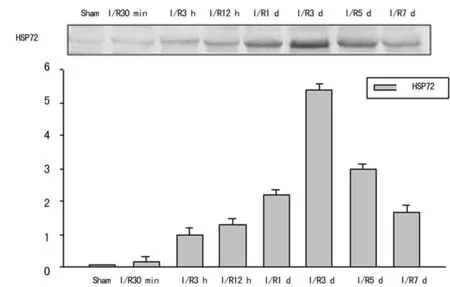
圖1 海馬CA 1區HSP72蛋白表達情況
3 討 論
HSP72是HSP家族中最重要的成員,也是應激誘導表達最多的成員。正常情況下,HSP72主要位于細胞漿中,當細胞遭受感染或氧化應激時,HSP72有一部分向細胞核內移位,發揮細胞保護和免疫調節作用[6]。有研究發現,H2O2和HS(heat shock)等刺激能夠促進巨噬細胞HSP72發生核移位,核聚集的HSP72能夠與多種核蛋白發生相互作用,隨著刺激時間延長,HSP72又能夠回到細胞漿中[7]。HSP72中存在一個重要結構域即PBD結構域,通過該結構域HSP72能夠與蛋白激酶C和JNK1、Akt等多種蛋白結合,進而發揮生物學功能。另外,該結構域可以通過基因重組方法去除,從而影響HSP72的功能,但并不影響HSP72的核移位[8-9]。作為重要的分子伴侶,HSP72能夠結合各種變性蛋白,以防這些蛋白遭受免疫細胞的攻擊[10],因此HSP72對維持細胞穩態和細胞存活具有重要意義。
以SD大鼠腦缺血模型為基礎研究HSP72 mRNA和蛋白的表達時間窗,是研究缺血性腦損傷中熱休克作用機制的重要實驗基礎。本研究結果顯示,HSP72 mRNA和蛋白在假手術組和缺血再灌注早期沒有表達,從再灌注3 h開始有少許表達,至再灌注3 d表達量達到最高峰,隨之漸漸下降。這一結果初步提供了HSP72 mRNA和蛋白在缺血性腦損傷過程中表達的時間趨勢,可望為進一步研究熱休克作用的相關機制提供一定的依據。
[1] Hartl FU.Molecular chaperones in cellular protein folding[J].Nature,1996,381(6583):571.
[2] 宋遠見,劉紅芝,裴冬生,等.Akt信號通路介導腦缺氧缺血后豐富環境對幼鼠海馬神經元的影響[J].江蘇醫藥,2009,35(3):299.
[3] 宋遠見,劉紅芝,裴冬生,等.缺氧缺血性腦損傷后豐富環境刺激對大鼠海馬CA 1區神經元凋亡的影響[J].第三軍醫大學學報,2008,30(22):2119.
[4] Nikaido H,Tsunoda H,Nishimura Y,et al.Potential role for heat shock protein 72 in antagonizing cerebral vasospasm after rat subarachnoid hemorrhage[J].Circulation,2004,110(13):1839.
[5] 宋遠見,劉紅芝,裴冬生,等.一氧化氮對大鼠腦缺血再灌注后 JNK3、Bad(ser128)和c-Jun磷酸化的影響[J].中國現代醫學雜志,2009,19(12):1817.
[6] Cowan KJ,Diamond MI,Welch WJ,et al.Polyglutamine protein aggregation and toxicity are linked to the cellular stress response[J].Hum Mol Genet,2003,12(12):1377.
[7] Lee WC,Wen HC,Chang CP,et al.Heat shock protein 72 overexpression protects against hyperthermia,circulatory shock,and cerebral ischemia during heatstroke[J].JAppl Physiol,2006,100(6):2073.
[8] Mariucci G,Tantucci M,Giuditta A,et al.Permanent brainischemia induces marked increments in HSP72 expression and local protein synthesis in synapses of theischemic hemisphere[J].Neurosci Lett,2007,415(1):77.
[9] Gao T,Newton AC.The turn motif is a phosphorylation switch that regulates the binding of HSP70 to protein kinase C[J].JBiol Chem,2002,277(35):31585.
[10]Hartl FU.Molecular chaperones in cellular protein folding[J].Nature,1996,381(6583):571.

