熔鹽電脫氧法制備CoSn合金
張慶軍,屈梅玲,王 嶺,戴 磊,田 穎,崔春翔
(1. 河北工業大學 材料學院,天津 300130;2. 河北理工大學 材料學院,唐山 063009;3. 河北理工大學 化工與生物技術學院,唐山 063009)
熔鹽電脫氧法制備CoSn合金
張慶軍1,2,屈梅玲2,王 嶺3,戴 磊3,田 穎2,崔春翔1
(1. 河北工業大學 材料學院,天津 300130;2. 河北理工大學 材料學院,唐山 063009;3. 河北理工大學 化工與生物技術學院,唐山 063009)
在850 ℃的CaCl2熔鹽中,以燒結后的Co3O4-SnO2片體為陰極,高純石墨棒為陽極,采用恒電壓電解,制備CoSn合金,研究燒結溫度、電解時間對電解過程的影響。采用電子掃描顯微鏡(SEM)和X射線衍射儀(XRD)分析樣品的微觀形貌和電解產物的相組成,并采用循環伏安法研究其反應機理。結果表明:經850 ℃燒結的混合氧化物試樣,在2.1 V工作電壓下電解12 h,可制備出海綿狀純相的CoSn合金。在電脫氧過程中,單質Co首先分步還原,錫的氧化物與熔鹽反應后在單質Co表面還原,形成CoSn合金。
電脫氧;CoSn;氧化物;熔鹽
Abstract:The CoSn alloy was prepared in molten CaCl2at 850 ℃ by constant voltage (2.1 V) electrolysis using sintered pellet of SnO2and Co3O4mixture as cathode and pure graphite rod as anode. The effects of the sintering temperature and electrolysis time on the electro-deoxidization process were studied. The morphologies and phases composition of products of the electro-deoxidization were examined by SEM and XRD, respectively. The mechanism of the electro-deoxidization process was studied by cyclic voltammetry. The results show that that pure spongy CoSn can be prepared by direct electrochemical electrolysis of Co3O4/SnO2mixture pellets sintered at 850 ℃ in molten CaCl2at 2.1 V for 12 h. During the electro-deoxidization process, in the mixed oxide, Co3O4is realuced to Co step by step, followed by the reaction of Sn oxide with molten on the surface of the newly-formed Co to form CoSn alloy.
Key words:electro-deoxidization; CoSn; oxide; molten salt
錫基合金作為鋰離子電池的負極材料,具有比容量高、循環性能好及與電解液的相容性好等優點,引起人們的廣泛關注[1?3]。目前,錫基合金常用的制備方法有機械合金化法、化學共還原法、電沉積法和碳熱還原法等[4?9]。
熔鹽電脫氧法制備金屬或合金是一種新型的綠色冶金工藝[10]。該工藝具有操作簡單、合金成分易控制、生產成本低等優點,電解產物為粉末狀,非常適用于電池電極材料的制備。目前,采用該方法已成功地制備了Ti、 Cr、Nb、TbNi5、CeNi5和TbFe2等[11?16]。本文作者使用熔鹽電脫氧法,在CaCl2熔鹽中,以SnO2和 Co3O4混合氧化物為原料,電解制備粉末狀 CoSn合金,研究燒結溫度和電解時間等對電解過程、產物組成和形貌的影響,探討電脫氧過程中合金生成的機理。
1 實驗
將分析純SnO2、Co3O4粉末按n(Co):n(Sn)為1:1配料,物料在球磨機中濕磨6 h并干燥,在30 MPa下壓制成型,得到圓柱型片(直徑為 10 mm,質量為2.5 g),將其分別在850、1 050、1 250 ℃下燒結4 h后備用。
電解在配有程序溫度控制器的鐵鉻鋁絲電阻爐中進行。將干燥的CaCl2放入氧化鋁坩堝中,置于反應器底部,待反應器升溫至850 ℃后,將懸掛在鐵鉻鋁絲上的氧化物燒結片和高純石墨棒插入到已經熔化的CaCl2中。在Ar氣氛中,分別以氧化物燒結片和高純石墨棒作為陰極和陽極,在2.1 V電壓下進行恒壓電解。電解完成后將陰極產物取出,用蒸餾水洗凈、干燥。
采用KYKY?3400型掃描電鏡分析陰極片電解前后的微觀形貌,采用XRERT-PRO型X射線衍射儀(Cu Kα)分析電解產物的相組成。
采用純鉬薄(長20 mm, 寬10 mm,厚0.5 mm)制備成金屬孔腔電極(孔徑1 mm)。將球磨過的SnO2和Co3O4粉末裝進小孔中作為工作電極,以高純石墨棒作為輔助電極,以鐵鉻鋁絲作為參比電極,在850 ℃的CaCl2熔鹽中進行循環伏安測試。
2 結果及討論
2.1 燒結溫度對氧化物陰極片形貌及相組成的影響
試樣在不同溫度燒結后的微觀形貌如圖1所示。由圖1可看出,經850 ℃燒結后,試樣的微觀形貌與燒結前(見圖1(a))相比,無明顯差別,顆粒尺寸較小(見圖 1(b));隨著燒結溫度的升高,顆粒逐漸長大(見圖1(c)和(d))。圖2所示為不同溫度下燒結后試樣的XRD譜。由圖2可看出,經850 ℃燒結后,樣品的相組成未發生變化,為SnO2和Co3O4的混合物;在1 050 ℃和1 250 ℃燒結的試樣中,Co3O4與部分SnO2反應生成Co2SnO4,Co3O4已完全消失。
2.2 不同燒結溫度試樣的電解過程及產物分析

圖1 不同溫度下燒結4 h后Co3O4-SnO2試樣的SEM像Fig.1 SEM images of Co3O4-SnO2pellets sintered at different temperatures for 4 h: (a) Before sintering; (b) 850 ℃; (c) 1 050 ℃;(d) 1 250 ℃
圖3所示為在2.1 V電壓下電解時,不同燒結溫度的試樣電流隨時間的變化曲線。由圖3可看出,在電解開始時,遷移到樣品表面的電子很快使表面的金屬離子還原, 并擴散到熔鹽中,因此電極表面的反應速度較快,電流較大;隨著反應的進行,當樣品表面電脫氧完成后,樣品內部氧化物的還原需要 O2?從內部擴散到熔鹽中才能完成,受擴散控制,由于擴散速度較慢,所以電流迅速下降,直至達到完全電解后的殘余電流[16?17]。隨著燒結溫度的升高,顆粒尺寸逐漸變大,與熔融CaCl2接觸的面積逐漸減小,同時增大了電解過程中 O2?的傳輸距離,因此,電解電流隨燒結溫度的升高而減小,不利于電脫氧過程的進行[16?17]。
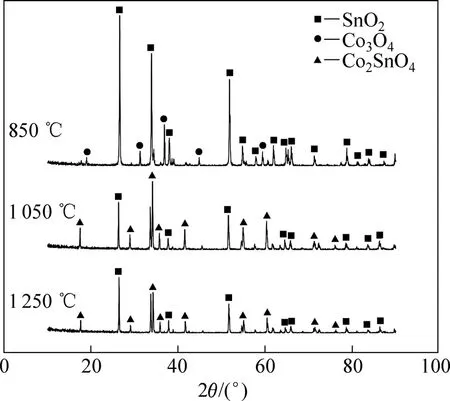
圖2 不同溫度下燒結4 h后Co3O4-SnO2試樣的XRD譜Fig.2 XRD patterns of Co3O4-SnO2pellets sintered for 4 h at different temperatures
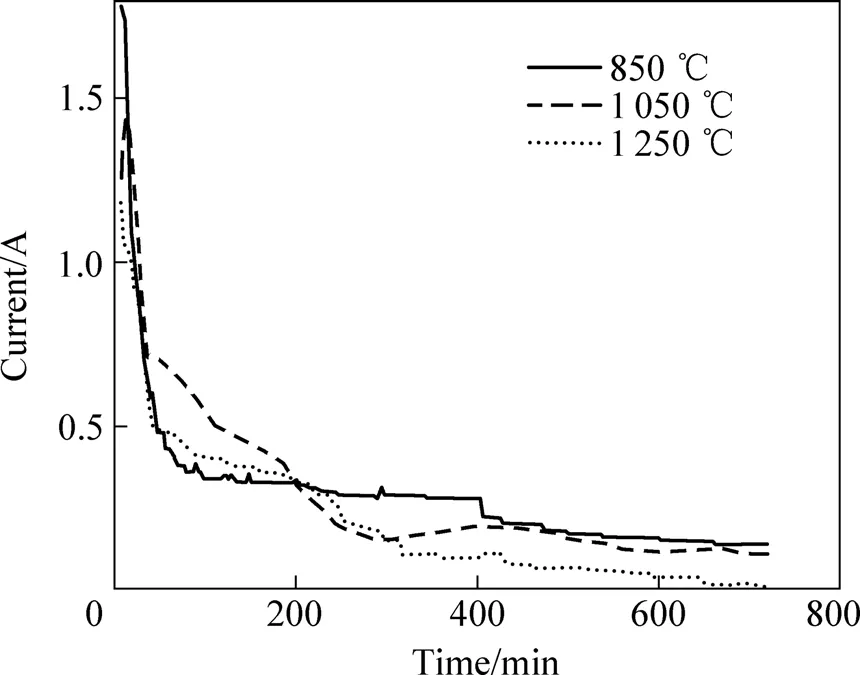
圖3 不同溫度燒結的試樣于 2.1 V電解時的電流—時間曲線Fig.3 Current—time curves of Co3O4-SnO2pellets sintered at different temperatures during electrolyzing at 2.1 V
圖4為不同溫度燒結后試樣在2.1 V電解12 h的產物的XRD譜。由圖4可見,經850 ℃燒結的試樣電解產物為純相CoSn合金;經1 050 ℃和1 250 ℃燒結的試樣的電解產物主要為金屬Sn和金屬Co。這與圖3的電流變化曲線一致,燒結溫度越高,電流越小,越不利于電脫氧過程的進行。
經850 ℃、1 050 ℃和1 250 ℃燒結的試樣電解產物的微觀形貌如圖5所示。由圖5可看出,850 ℃燒結試樣的電解產物呈規則的顆粒形狀,界面清晰,且所得電解產物強度很小,輕輕研磨即成粉末;1 050 ℃和1 250 ℃燒結試樣的電解產物的顆粒主要為層片狀和塊狀,且形狀不規則。

圖4 不同溫度燒結試樣在2.1 V電解12 h后的XRD譜Fig.4 XRD patterns of products sintered at different temperatures after electrolyzing at 2.1 V for 12 h
2.3 電脫氧過程分析
圖6所示為經850 ℃燒結后燒結片在2.1 V電壓下分別電解1、3、6、9、12 h后產物的XRD譜。由圖6可看出,電解1 h后,試樣中的Co3O4完全消失,一部分還原為 CoO,一部分還原為單質 Co。同時,試樣中出現CaSnO3,這是由于電脫氧過程中,O2?從試樣中擴散出來,與Ca2+結合生成CaO,進而與SnO2反應生成CaSnO3[13,18];電解3 h后,除了少量SnO2、CaSnO3和Co之外,出現大量Co3Sn2合金,CoO已全部消失;電解6 h后,電解產物中開始出現CoSn合金;電解9 h后,試樣主要為CoSn合金,但是產物不純,仍然存在少量的CaSnO3;電解12 h后,電解產物的XRD譜中只有CoSn合金的衍射峰,表明氧化物陰極已完全電解。結果表明:電解過程中Co3O4的還原過程是分步進行的,即Co3+→Co2+→Co。與此同時,SnO2與CaCl2發生反應生成CaSnO3,隨后CaSnO3在單質Co表面還原形成Co3Sn2合金,隨著CaSnO3的不斷還原、合金化,最終形成CoSn合金。還原過程經歷了Co→鈷的氧化物→電解質和Co-Sn→CaSnO3→電解質兩種三相反應過程[14,16]。

圖5 不同溫度燒結的試樣電解12 h后的SEM像Fig.5 SEM images of samples sintered at different temperatures after electrolysis for 12 h: (a) 850 ℃; (b) 1 050 ℃;(c) 1 250 ℃
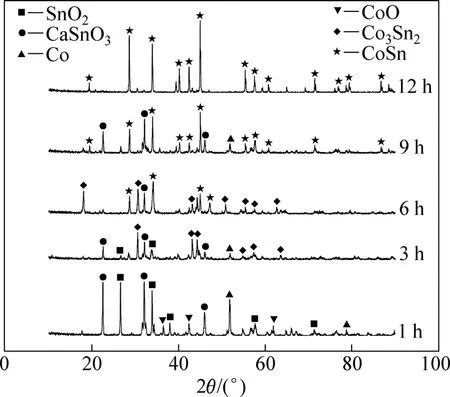
圖6 2.1 V電解電壓下電解不同時間后電解產物的XRD譜Fig.6 XRD patterns of productions after electrolyzing at 2.1 V for different times
圖7所示為在850 ℃的CaCl2熔鹽中Co3O4粉末、Co3O4粉末與SnO2混合粉末的循環伏安曲線。由圖7可看出,空白試樣的電位從0 V開始負向掃描,達到?1.0 V時,電流開始增加,在?1.3 V出現還原峰c2,這是由于CaCl2的還原造成的[17]。隨著電位的負移,Ca2+不斷還原,電流繼續增大,當電位負移至?1.5 V時,在c3峰處電流達到最大值。隨著電位正向掃描,由于Ca2+不斷氧化,在?1.3 V出現氧化峰a1。當電位正移到?1.2 V后,電流下降至背景電流。如Co3O4粉末循環伏安曲線所示,隨著Co3O4粉末電位的負移,由于Co3O4不斷還原為Co單質,在?0.4 V出現還原峰c1。對于Co3O4和SnO2混合粉末的循環伏安曲線,從0 V開始負向掃描,開始階段電流逐漸增大,曲線變化與Co3O4粉末的曲線基本一致,表明此階段只有Co單質還原。隨著電位負移至?0.2 V,較之Co3O4粉末,混合氧化物粉末電極的還原電流明顯增大,表明此時Sn在新生成的Co單質相上還原,形成Co-Sn合金,在?0.6 V附近出現還原峰c4。結合電解不同時間的試樣的XRD圖譜(見圖6),CoSn合金的制備過程按如下過程進行:
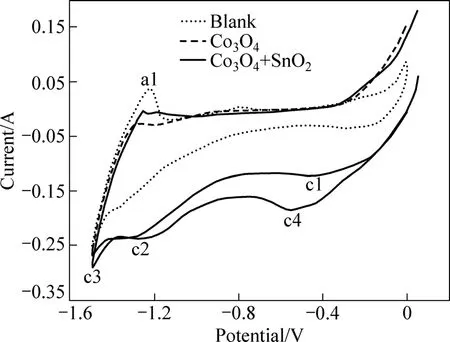
圖7 不同試樣的循環伏安曲線Fig.7 CVs of different samples (CaCl2molten; 850 ℃; Scan rate 10 mV/s)
3 結論
1) 采用熔鹽電脫氧法,在850 ℃的CaCl2熔鹽體系中,當電解電壓為2.1 V,電解時間為12 h 時,可直接由Co3O4和SnO2混合氧化物制備CoSn合金;經1 050 ℃和1 250 ℃燒結的試樣由于生成的Co2SnO4不利于 CoSn的生成,電解產物主要為金屬 Sn和金屬Co。
2) 根據循環伏安曲線和不同電解時間的 XRD譜,可以推測電脫氧制備CoSn合金的機理為Co3O4分步還原成單質Co,隨后SnO2與CaCl2熔鹽反應的產物CaSnO3在單質Co表面還原,最終形成CoSn合金。
REFERENCES
[1] NEEDHAM S A, WANG G X, LIU H K. Electrochemical performance of SnSb and Sn/SnSb nanosize powders as anode materials in Li-ion cells[J]. Journal of Alloys and Compounds,2005, 400: 234?238.
[2] HASSOUN J, PANERO S, SCROSATI B. Electrodeposited Ni-Sn intermetallic electrodes for advanced lithium ion batteries[J]. Journal of Power Sources, 2006, 160: 1336?1341.
[3] 汪 飛, 趙銘姝, 宋曉平. 鋰離子電池錫基負極材料的研究進展[J]. 電池, 2005, 35(2):152–154.WANG Fei, ZHAO Ming-shu, SONG Xiao-ping. Research progress in tin-based negative electrode materials for Li-ion batteries[J]. Battery Bimonthly, 2005, 35(2):152?154.
[4] WANG G X, AHN J H, LINDSAY M J, SUN L, BRADHURST D H, DOU S X, LIU H K. Graphite-tin composites as anode materials for lithium-ion batteries[J]. Journal of Power Sources,2001, 97/98: 211?215.
[5] KIM D G, KIM H, SOHN H J, KANG T. Nanosized Sn-Cu-B alloy anode prepared by chemical reduction for secondary lithium batteries[J]. Journal of Power Sources, 2002,104(2):221?225.
[6] TAMURA N, OHSHITA R, FUJITANI S, KAMINO M,FUJITAN S. Advanced structures in electrodeposited tin base negative electrodes for lithium secondary batteries[J]. Journal of The Electrochemical Society, 2003, 150 (6): A679?A683.
[7] 譚春林, 呂東升, 李偉善, 許夢清, 周代營, 胡社軍. 電沉積錫鎳合金作為鋰離子電池負極的研究[J]. 稀有金屬材料與工程, 2008, 37(2): 472?475.TAN Chun-lin, Lü Dong-sheng, LI Wei-shan, XU Meng-qing,ZHOU Dai-ying, HU She-jun. Study of electrodeposited Sn/Ni alloy as anode materials for Li-ion batteries[J]. Rare Metal Materials and Engineering, 2008, 37(2): 472?475.
[8] XIA Y, SAKAI T, FUJIEDA T, WADA M, YOSHINAGA H.Flake Cu-Sn alloys as negative electrode materials for rechargeable lithium batteries[J]. Journal of the Electrochemical Society, 2001, 148(5): A471?A481.
[9] GUO H, ZHAO H L, YIN C L, QIU G H. Si/SnSb alloy composite as high capacity anode materials for Li-ion batteries[J]. Journal of Alloys and Compounds, 2006, 426:277?280.
[10] CHEN G Z, FRAY D J, FARTHING T W. Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride[J]. Nature, 2000, 407: 361?364.
[11] WANG D H, QIU G H, JIN X B, HU X H, CHEN G Z.Electrochemical metallization of solid terbium oxide[J]. Angew Chem Int Ed, 2006, 45: 2384?2388.
[12] CHEN G Z, ELENA G, FRAY D J. Direct electrolytic preparation of chromium powder[J]. Metallurgical and Materials Transactions B, 2004, 35: 223?233.
[13] 鄧麗琴, 許 茜, 李 兵, 翟玉春, 黃振奇. 電脫氧法由
Nb2O5直接制備金屬鈮[J]. 中國有色金屬學報, 2005, 15(4):541?545.
DENG Li-qin, XU Qian, LI Bing, ZHAI Yu-chun, HUANG Zhen-qi. Preparation of niobium by direct electrochemical reduction of solid Nb2O5[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(4): 541?545.
[14] ZHAO B J, WANG L, DAI L, CUI G H, ZHOU H Z, KUMAR R V. Direct electrolytic preparation of cerium/nickel hydrogen storage alloy powder in molten salt[J]. Journal of Alloy and Compounds, 2009, 468: 379?385.
[15] QIU G H, WANG D H, JIN X B, CHEN G Z. A direct electrochemical route from oxide precursors to the terbium–nickel intermetallic compound TbNi5[J]. Electrochimica Acta, 2006, 51: 5785?5793.
[16] QIU G H, WANG D H, MA M, JIN X B, CHEN G Z.Electrolytic-synthesis of TbFe2from Tb4O7and Fe2O3powders in molten CaCl2[J]. Journal of Electroanalytical Chemistry, 2006,589:139?147.
[17] GORDO E, CHEN G Z, FRAY D J. Toward optimization of electrolytic reduction of solid chromium oxide to chromium powder in molten chloride salts[J]. Electrochimica Acta, 2004,49: 2195?2208.
[18] JIANG K, HU X H, MA M, WANG D H, QIU G H, JIN X B,CHEN G Z. “Perovskitization”-assisted electrochemical reduction of solid TiO2in molten CaCl2[J]. Angew Chem Int Ed,2006, 45: 428?432.
(編輯 李艷紅)
Preparation of CoSn alloy by electro-deoxidization in molten salt
ZHANG Qing-jun1,2, QU Mei-ling2, WANG Ling3, DAI Lei3, TIAN Ying2, CUI Chun-xiang1
(1. College of Materials, Hebei University of Technology, Tianjin 300130, China;2. College of Materials, Hebei Polytechnic University, Tangshan 063009, China;3. College of Chemical Engineering and Biotechnology, Hebei Polytechnic University, Tangshan 063009, China)
TF111.52
A
1004-0609(2010)08-1578-05
河北省自然科學基金資助項目(E2007000594,E2010000941);唐山市科技局資助項目(07150204-2)
2009-06-05;
2010-04-16
王 嶺,教授,博士;電話:0315-2592170;E-mail:tswling@126.com

