辣椒素生物合成途徑基因pal克隆及原核表達分析
郭慶勛,阮文淵,懷鳳濤,郝宏智
(1.吉林大學植物科學學院,長春 130062;2.東北農業大學園藝學院,哈爾濱 150030)
辣椒是全世界范圍內被廣泛消費的蔬菜和香料之一。其主要的辛辣成分是辣椒素(Capsaicin),辣椒素的化學名稱為反-8-甲基-N-香草基-6-壬烯基酰胺[1]。辣椒的次生代謝物辣椒素類物質(Capsaicinoides)是一種機制獨特的植源性抗癌新藥的合成前體。辣椒素的藥理作用包括預防心血管疾病,預防和治療消化道疾病,止痛、抗癌和減肥等[2]。在臨床上常用于治療帶狀皰疹后遺癥所致的神經痛、坐骨神經痛、糖尿病性神經痛等疾患,另外,對于預防老年人吸入性肺炎、腰痛、血尿綜合征以及銀屑病也有顯著療效[3-4]。但另外的一些研究顯示[5],辣椒素可以阻止一些化學致癌物在體內的活化或者將這些化學致癌物去除的能力,因此辣椒素可作為一種化學保護劑。
目前的研究還沒有明確辣椒素生物合成路徑的調控機制,包括關鍵基因的定位、克隆和調控的分子機理,相關基因啟動子的分離和調控作用。辣椒素作為一種天然植物中的有效成分,其來源廣泛,且不良反應較化學合成藥物要少。辣椒素具有相當廣泛的藥理作用,辣椒素在各種疾病的預防和治療方面已經得到了應用[6]。但是目前對涉及辣椒素生物合成的許多酶類缺乏研究,且其合成路線也未完全研究清楚,只做了部分數量有限的研究。如Charles等總結了辣椒素的生物合成途徑,此途徑由香草基胺和C9~C10支鏈脂肪酸兩部分組成[7-8]。參與辣椒素合成途徑中目前已知的酶有:苯丙氨酸裂解酶、肉桂酸水解酶、對香豆酸水解酶和咖啡酸轉甲氧基酶,其中苯丙氨酸裂解酶(Phenylalanine Ammonia-lyase,PAL)是香草基胺支鏈的第一個酶,Mazourek等克隆了該序列[9]。
為此,如何有效提高辣椒素的生物合成量已成為廣大科研工作者關注的焦點。本文則根據pal基因保守序列設計引物,通過PCR擴增得到了辣椒益都紅的pal核苷酸序列。利用苯丙氨酸裂解酶在原核T7強啟動子作用下的高效表達,重組苯丙氨酸裂解酶的獲得為其作用機理及辣椒素合成代謝調控機制的研究提供了基礎。
1 材料與方法
1.1 材料
以辣椒益都紅胎座組織為試驗材料;克隆菌株為大腸桿菌(Escherichia coli)Top10,為本實驗室保存;原核表達載體為pET-32a,由吉林大學張世宏教授饋贈;原核表達菌株為E.coli BL21(DE3),由吉林大學原亞萍教授饋贈。
1.2 試劑
PfuDNA聚合酶(2.5 U·μL-1)(購自 MBI公司),高純 dNTP(2.5 mmol·L-1)和克隆載體 pGM-T Easy vector(均購自天根生化科技(北京)有限公司);RNA提取試劑RNAiso Reagent與核酸限制性內切酶(購自TaKaRa公司);反轉錄試劑盒,Biospin膠回收試劑盒,質粒提試劑盒(購自BioFlux公司);引物(合成于南京金思特科技有限公司);丙烯酰胺(Acr)及甲叉雙丙烯酰胺(Bis)(購自 Bebco公司);過硫酸銨(AP)及四甲基乙二胺(TEMED)(購自Sigma公司);DNA Marker(購自上海生物工程技術服務有限公司);低分子質量標準蛋白(購自天根生化科技(北京)有限公司);其余試劑為國產分析純。
1.3 方法
1.3.1 RNA的提取和cDNA模板的制備
用RNAiso Reagent提取辣椒胎座總RNA,經核酸測定儀和瓊脂糖電泳確認質量和產量后,于-20℃保存備用。反轉錄cDNA的制備參照BioFlux公司反轉錄試劑盒說明書。
1.3.2 pal基因的克隆
根據GenBank中已登錄的pal基因保守序列,設計1對帶有酶切位點的特異引物,即,PAL-F:5'CGGAATTCATGGCATCAACAATTGCAC 3'(下劃線部分為Eco RⅠ酶切位點)和PAL-R:5'TTGCG GCCGCCTAACAGATTGGAAGGGGAG 3'(下劃線部分為NotⅠ酶切位點),進行PCR擴增,其PCR反應體系及條件:10×PCR PfuDNA聚合酶Buffer with MgSO42.5 μL,引物(10 pmol·μL-1)各 1 μL,dNTP(2.5 mmol·L-1)2 μL,PfuDNA 聚合酶(2.5 U·μL-1)0.5 μL,模板 cDNA(60 ng·μL-1)1 μL,ddH2O 17 μL。反應程序為:95℃預變性5 min,94℃變性30 s,53℃退火30 s,72℃延伸4 min,35個循環;72℃延伸10 min,4℃保存。擴增產物克隆于pGM-T Easy載體上,轉化大腸桿菌Top10感受態細胞。載體連接反應體系為:T4Ligase buffer 1 μL,T4Ligase(350 U·μL-1),pGM-T Easy vector(50 ng)1 μL,PCR 產物(60 ng)7 μL,ddH2O 補至10 μL,16℃連接過夜。轉化后的大腸桿菌Top10在37℃、180 r·min-1的搖床上振蕩培養1.5 h之后,吸取100 μL菌液至LB固體培養基(Amp 100 mg·L-1,IPTG 0.5 mmol·L-1,X-gal 40 mg·L-1)上,37℃培養過夜。挑取白色單菌落,經PCR與Eco RⅠ/NotⅠ雙酶切鑒定后送上海生物工程技術服務有限公司測序。
1.3.3 pal基因的生物信息學分析
對測序得到的核酸序列和推導的氨基酸序列分別用BLASTn和BLASTp進行相似性搜索,用DNAMAN 4.0繪制序列聚類圖。
1.3.4 原核表達載體pET-32a-pal的構建
將pGM-pal陽性克隆質粒經核酸限制性內切酶Eco RⅠ/NotⅠ雙酶切后回收pal片段與經Eco RⅠ/NotⅠ雙酶切的pET-32a載體連接。酶切體系為:10×K Buffer 2 μL,Eco RⅠ/NotⅠ各 1 μL,ddH2O補至20 mL,37℃酶切5 h。連接體系:T4Ligase(350 U·μL-1)1 μL,經 Eco RⅠ/NotⅠ酶切的 pET-32a 載體(20 ng)2 μL,回收片段 pal(100 ng)5 μL,ddH2O補至10 μL,16℃過夜連接。轉化大腸桿菌Top10的方法步驟同1.3.2。將挑取的單菌落進行菌液PCR鑒定后,再將PCR陽性菌落進行Eco R I/Not I酶切鑒定。將陽性菌落擴搖提取質粒,于-20℃保存備用。
1.3.5 原核表達條件的優化及SDS-PAGE電泳檢測
將pET-32a-pal轉化BL21感受態細胞,轉化步驟同 1.3.2。挑取陽性菌落 200 r·min-1搖 10~12 h,按10%的接種量進行擴搖,當菌液OD值約0.8左右時,冰浴20~30 min后加入不同 IPTG濃度,在不同溫度條件下誘導不同的時間。收集1.5 mL菌體經PBS洗滌后加入蛋白上樣緩沖液煮沸15 min,12 000 r·min-1離心10 min后將上清與沉淀分開,分別于-20℃保存備用。將上述蛋白樣品進行SDS-PAGE電泳檢測,濃縮膠(5%)電泳電壓80 V,分離膠(12%)電泳電壓160 V。
2 結果與分析
2.1 辣椒pal基因的克隆與測序
2.1.1 pal基因RT-PCR擴增
以益都紅胎座總RNA的反轉錄產物為模板,用PAL-F/PAL-R為引物進行RT-PCR擴增。RTPCR產物經1.0%瓊脂糖凝膠電泳檢測到一條約2 200 bp的特異擴增條帶,與預期結果相符(見圖1)。
2.1.2 重組質粒PCR檢測及酶切鑒定
挑取白色菌落培養,提取質粒經PCR擴增得到約2 200 bp的目的條帶,質粒經NotⅠ和Eco RⅠ雙酶切,得到約2 200 bp的目的條帶和2 700 bp的載體條帶,說明目的基因已克隆到pGEM-T載體中(見圖2)。
以益都紅胎座cDNA為模板,擴增出了1條約2 200 bp目的條帶(見圖1)。測序結果表明,該片段的實際長度為2 157 bp。
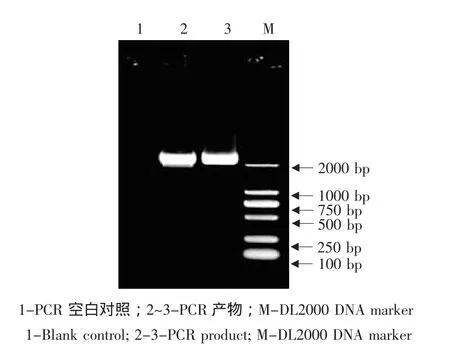
圖1 PCR產物電泳分析Fig.1 Electrophoresis analysis of PCR product
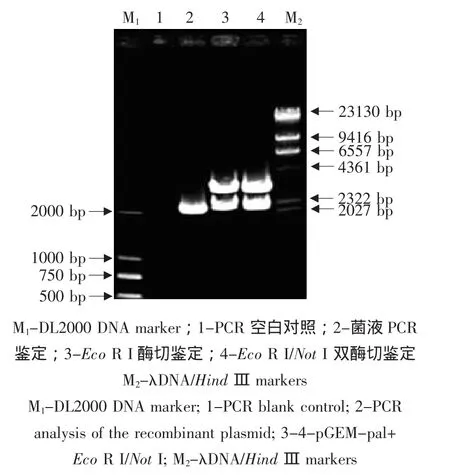
圖2 重組質粒pGM-pal菌液PCR與雙酶切鑒定Fig.2 PCR and restriction analysis of the recombinant plasmid pGM-pal
2.2 辣椒pal基因的序列分析
測序結果表明,該序列含有完整的開放閱讀框,其堿基組成為G+C=44%,A+T=56%,翻譯起始密碼子為ATG,終止密碼子為TAG,編碼718個氨基酸(見圖3)。該DNA序列與GenBank中登錄的其他植物的pal基因同源性較高,大致分布在70%~90%。其中與 Capsicum chinese同源性達99%。
2.3 辣椒pal基因聚類分析
運用DNAMAN自帶的Multiple Sequence Alignment程序分析了不同科屬植物苯丙氨酸裂解酶的進化關系,建立了苯丙氨酸裂解酶的系統進化樹(見圖4)。結果表明,辣椒PAL與所選的14種植物的pal基因可歸為雙子葉、單子葉、和蕨類植物三類。蕨類植物與單子葉植物之間的同源性為57%,單子葉植物與雙子葉植物之間的同源性為65%左右。而與同科同屬的菜椒和朝天椒親緣關系最近。

圖3 辣椒pal基因核酸序列推導的氨基酸序列Fig.3 Protein sequence of pal gene from Capsicum annuum

圖4 pal基因核苷酸序列聚類圖Fig.4 Homology tree of nucleic acid sequence of pal gene
2.4 重組載體pET-32a-pal的鑒定
pGM-pal經Eco RⅠ/NotⅠ酶切后的pal片段與pET-32a酶切后連接轉化大腸桿菌BL21,抗生素篩選后分別進行PCR鑒定和酶切鑒定,鑒定結果如圖5所示,結果表明pET-32a-pal PCR的電泳結果產生2.2 kb左右的條帶,雙酶切后產生一條2.2 kb和5.4 kb左右的條帶;雙酶切產生的大片段與單酶切產生的片段相差約2.2 kb,與預期的結果相符。將陽性結果送上海生物工程技術服務有限公司進一步測序驗證。
2.5 辣椒pal基因在E.coli中誘導表達的SDSPAGE分析
將包含pET-32a-pal的重組菌分別在不同誘導條件下培養,收集菌體煮沸15 min后上樣進行SDS-PAGE,如圖6~8所示,包含pal基因的重組菌誘導后在分子質量約為93 ku處有一條特異性表達條帶。在對照菌中,BL21沒有出現此蛋白表達;包含空載體pET-32a的菌誘導出現了一條約20 ku的特異條帶,與預期相符;因此,試驗組可能為目的表達產物,其分子質量大小(93 ku,等于pal分子質量73 ku加20 ku)與理論值(92.2 ku,預測網站 http://www.expasy.ch/tools/pi_tool.html)相符。由圖6~8分析結果得出pET-32a-pal重組菌的最優誘導表達條件為:IPTG 0.3 mmol·L-1,溫度28℃,時間6 h。
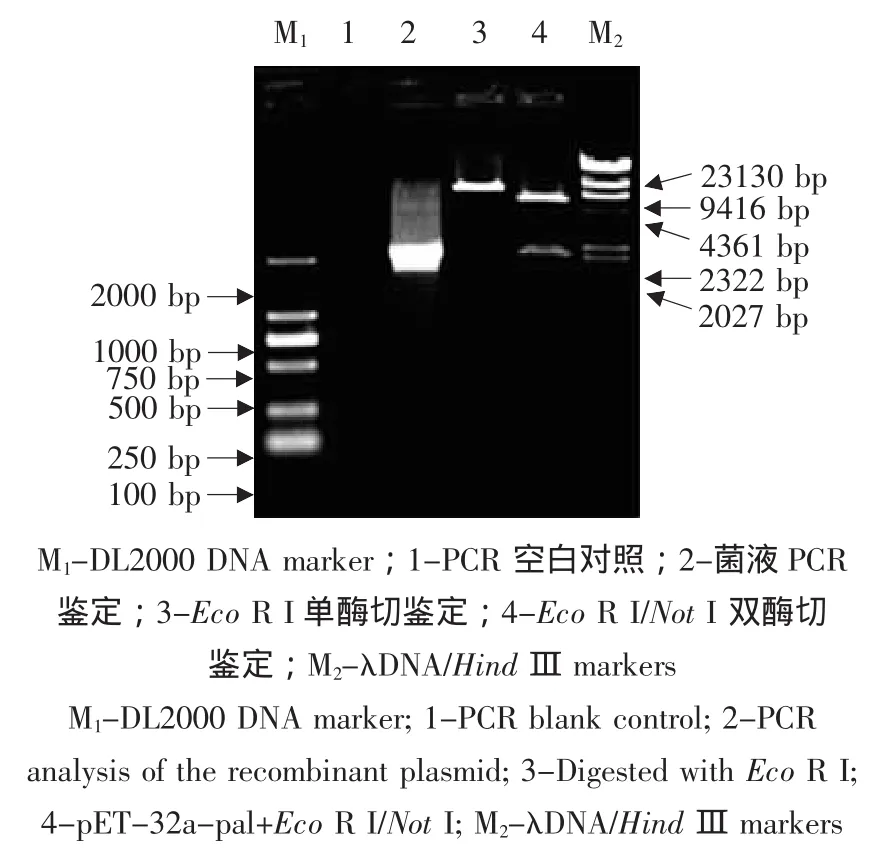
圖5 重組質粒pET-32a-pal菌液PCR與酶切鑒定Fig.5 PCR and restriction analysis of the recombinant plasmid pET-32a-pal
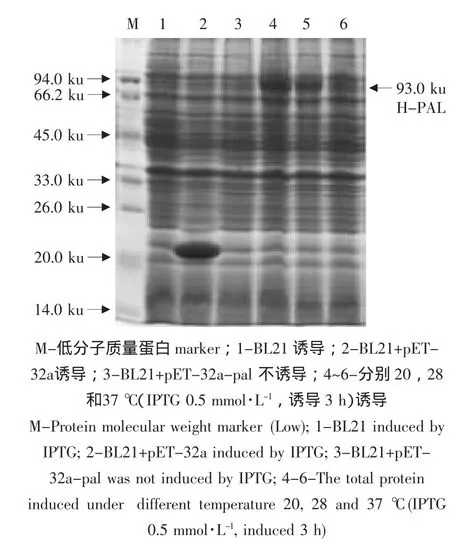
圖6 不同誘導溫度條件下H-PAL融合蛋白在E.coli BL21(DE3)細胞中的表達檢測Fig.6 SDS-PAGE analysis of the recombinant H-PAL protein expression in E.coli BL21(DE3)under different temperature

圖7 不同IPTG誘導濃度條件下H-PAL融合蛋白在E.coli BL21(DE3)細胞中的表達檢測Fig.7 SDS-PAGE analysis of the recombinant H-PAL protein expression in E.coli BL21(DE3)under different IPTG concentration

圖8 不同誘導時間條件下H-PAL融合蛋白在E.coli BL21(DE3)細胞中的表達檢測Fig.8 SDS-PAGE analysis of the recombinant H-PAL protein expression in E.coli BL21(DE3)under different time
3 討論與結論
在辣椒素的生物合成途徑中,苯丙氨酸裂解酶(PAL)是辣椒素合成的第一個酶,辣椒素分子結構中的苯環就來自苯丙氨酸。但辣椒在合成辣椒素的過程中對苯丙氨酸的利用效率是非常低的。Hall與Yeoman等研究報道表明僅有不到1%的苯丙氨酸最終參與合成辣椒素,大部分的酚類物質將轉變為不溶于水的的細胞壁成分,約占50%~70%,25%~35%的轉變為簡單酚類、黃酮及水溶性的酯類,另外約有10%~20%苯丙氨酸生成蛋白質。另外,PAL在植物抗病方面具有重要作用[10]。目前關于PAL活性變化與植物抗病性的關系有3種看法:即正相關、負相關和無相關性。研究結果表明,苯丙氨酸解氨酶的活性變化與辣椒對白粉病的抗性尤其具有密切關系。受白粉菌侵染后,抗、感材料的PAL活性都上升,但是在非親合互作中,PAL的活性變化量高于親合互作中的變化量,因而PAL活性與菜椒白粉病抗病性存在正相關關系。
本試驗獲得的辣椒pal基因的片段長度與其他物種中己報道的苯丙氨酸解氨酶基因長度接近,且具有較高的相似度。與朝天椒、大圓茄等物種的苯丙氨酸解氨酶基因相同。此外,還對pal基因編碼的氨基酸序列進行了一系列的生物信息學分析,與Mazourek等克隆的序列基本一致[9],同源性達99%。通過克隆pal基因與原核表達,為研究辣椒PAL的基因結構、生物活性、表達調控機制以及辣椒素的生物合成機制提供了基礎。
[1]譚仁祥.植物成分功能[M].北京:科學出版社,2003:142.
[2]徐兵,李昕,張莉.辣椒素藥理作用的研究進展[J].中南藥學,2007,5(6):542-545.
[3]郭建明.辣椒的風味化學及其在調味品中的應用[J].中國調味品,1998(7):2-4.
[4]吳明光.新型長效鎮痛藥辣椒堿研究進展[J].中國新藥雜志,1994,3(4):10-13.
[5]Callingham B B A,Lembeck F,Shacman D F.Biochem[J].Phacmaeol,1991(41):l863-1869.
[6]李競蕓.辣椒素類物質生物合成研究進展[J].河北農業科學,2009,13(11):46-48.
[7]Charles S,Mazourek M,Giulia M S,et al.Genetic control of pungency in C.chinense via the Pun1 locus[J].Journal of Experimental Botany,2007,58(5):979-991.
[8]Charles S,Kang B C,Liu K D,et al.The Pun1 gene for pungency in pepper encodes a putative acyltransferase[J].The Plant Journal,2005,42:675-688.
[9]Mazourek M,Pujar A,Borovsky Y P,et al.A dynamic interface for capsaicinoid systems biology[J].Plant Physiol,2009,150(4):1806-1821.
[10]HallRD,YeomanMM.The influence of intracellular pools of phenylalanine derivatives upon the synthesis of capsaicin by immobilized cell cultures of the chili pepper,Capsicum frutescens[J].Planta,1991,185:72-80.

