脫落酸、水楊酸和氯化鈣對番茄幼苗抗冷性的影響
于錫宏,蔣欣梅,刁 艷,王麗麗,劉在民,于廣建
(東北農業大學園藝學院,哈爾濱 150030)
冷害是指在0℃以上的低溫對植物造成的傷害,當植物受到低溫逆境脅迫后,就會啟動自身的抗性機制,最大限度地抗御低溫逆境危害。植物抗逆化學誘導指的是利用外源化學物質模擬逆境信號或作為植物逆境信號傳導的中間信號物質,誘發植物啟動抗性機制,形成致敏,因此,應用外源化學物質對植物進行誘導處理可提高其抗冷性[1-2]。脫落酸(Abscisic Acid,ABA)是介導環境脅迫和植物抗逆反應的調節物質,也稱“逆境激素”,ABA對植物抗冷能力的調控起著重要作用[3]。水楊酸(Salicylic Acid,SA)在植物的抗寒性中,被認為是植物在脅迫反應中產生的一種信號分子,它可以通過抑制膜脂過氧化來維持膜完整性[4]。Ca2+作為一個主要的第二信使,有防止膜損傷和滲漏、穩定膜結構和維持膜的完整性作用,外源Ca2+能提高保護系統活性,使植物抗冷性提高[5]。番茄(Lycopersicon esculentum Mill.)作為一種喜溫蔬菜,溫度低于8℃時生長發育嚴重受阻,溫度低于5℃時生長完全停止[6]。近年來,隨著設施農業的發展,番茄早春生產中造成的低溫冷害問題日益突出,如何提高番茄抗冷性已成為北方寒地番茄生產的重要問題。番茄在不同生育階段的耐寒性表現趨勢基本一致,因此苗期的耐寒性可以代表成株期的耐寒性[7]。我們在前期研究的基礎上[2,8-9],選用ABA、CaCl2和SA這三種外源物質對番茄幼苗進行葉面噴施處理,借以明確其對番茄抗冷性的效果,為番茄抗冷性研究提供技術基礎,同時為北方番茄生產提供有益的理論參考。
1 材料與方法
1.1 材料
試驗在東北農業大學園藝設施中心和黑龍江省教育廳寒地蔬菜生物學重點實驗室進行。供試番茄品種為東農708,由東北農業大學番茄研究所提供;脫落酸、氯化鈣和水楊酸購自哈爾濱中加化工試劑有限公司,均為國產分析純。
1.2 方法
當番茄長至3片真葉展平時,選擇無病、健壯、生長勢均一的幼苗進行外源物質(ABA、CaCl2、SA)葉面噴施處理,其中ABA濃度分別為10、15 mg·L-1,CaCl2濃度分別為 1 400、1 800 mg·L-1,SA 濃度分別為 300、400 mg·L-1,分別以 A1、A2、B1、B2、C1、C2表示。為了提高植株對三種外源物質的吸收效果,在第一次噴施后第5天再進行第2次噴施,每次噴施以葉面均勻附著一層小液珠為準,以清水作為對照1(CK1)。噴施誘導第5天,將植株放在光照培養箱(LRH-250-G型)中進行低溫脅迫(晝溫/夜溫=10±0.5℃/5±0.5℃),光照時間為12 h,光強為4 000 lx,低溫脅迫3 d。在光照培養箱條件下以未進行低溫脅迫(25±0.5℃/15±0.5℃)作為對照2(CK2),以未噴施外源物質的植株在光照培養箱條件下進行低溫脅迫的作為對照3(CK3)。每個處理50株,3次重復。
低溫脅迫3 d后,對冷害指數進行調查,同時隨機選取10株,剪取葉片并混合取樣,進行與抗冷性相關的主要生理指標測定。其中冷害級別參照姜述君等標準[10],分為5級,即0級-幼苗未受冷害;1級-有少數葉片有輕度萎蔫,但沒有葉片發生壞死;2級-半數以下的葉片萎蔫死亡,但主莖未死;3級-超過半數以上的葉片萎蔫死亡,主莖死亡;4級-全株死亡。冷害指數=∑(各級株數×級數)/總株數。相對電導率測定使用MC226型電導儀;丙二醛(Malondialdehyde,MDA)含量測定采用硫代巴比妥酸比色法,葉綠素(Chlorophyll)含量測定采用丙酮-乙醇等量混合液法,游離脯氨酸(Proline,Pro)含量測定采用酸性水合茚三酮法[11]。
2 結果與分析
2.1 ABA、SA和CaCl2對番茄冷害程度的影響
結果見表1。
由表1可知,低溫脅迫3 d后各個處理的植株均表現出不同程度的冷害,而一定濃度的外源ABA、CaCl2、SA噴施處理后,對冷害有一定的緩解作用,提高了植株的抗冷性(見表1)。與噴施清水的對照 3(CK3)相比,除 400 mg·L-1SA 處理(C2)的冷害指數顯著降低外,其他的處理均極顯著地降低。噴施 1 400 mg·L-1CaCl2處理(B1)冷害指數最低,其次為300 mg·L-1SA處理(C1),兩者之間差異不顯著;再次為10 mg·L-1ABA處理(A1)、1 800 mg·L-1CaCl2處理(B2)和 15 mg·L-1ABA 處理(A2),三者之間差異不顯著。從冷害的發生程度來看,噴施 1 400 mg·L-1CaCl2處理(B1)的效果最好,冷害級數只發生到1級。
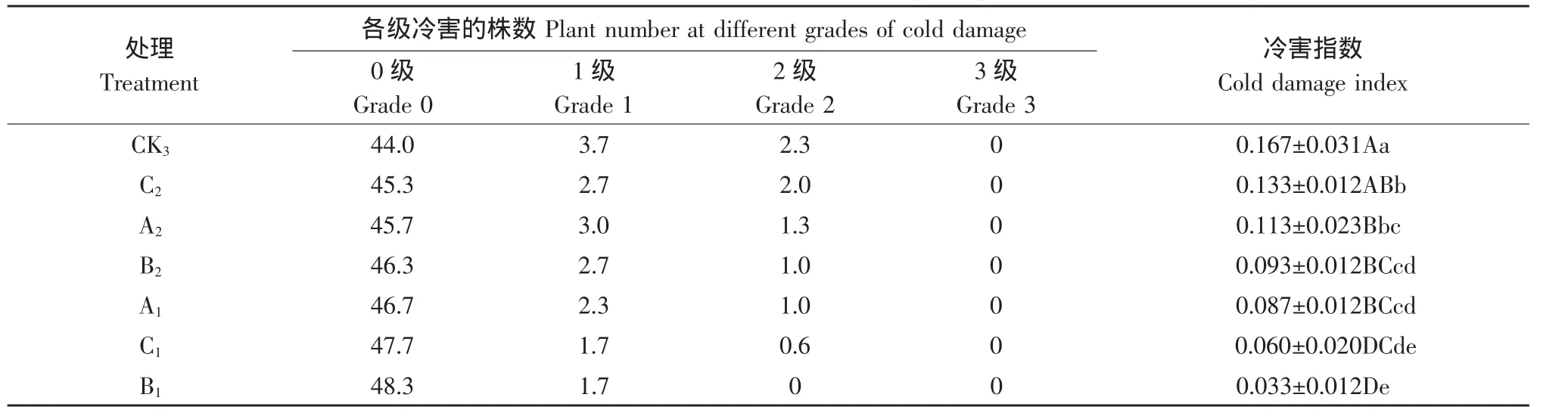
表1 ABA、SA和CaCl2對番茄幼苗冷害程度的影響Table1 Effect of ABA,SA and CaCl2on cold damage degree of tomato seedlings
2.2 ABA、SA和CaCl2對番茄幼苗體內相對電導率和丙二醛含量的影響
結果見圖1、2。
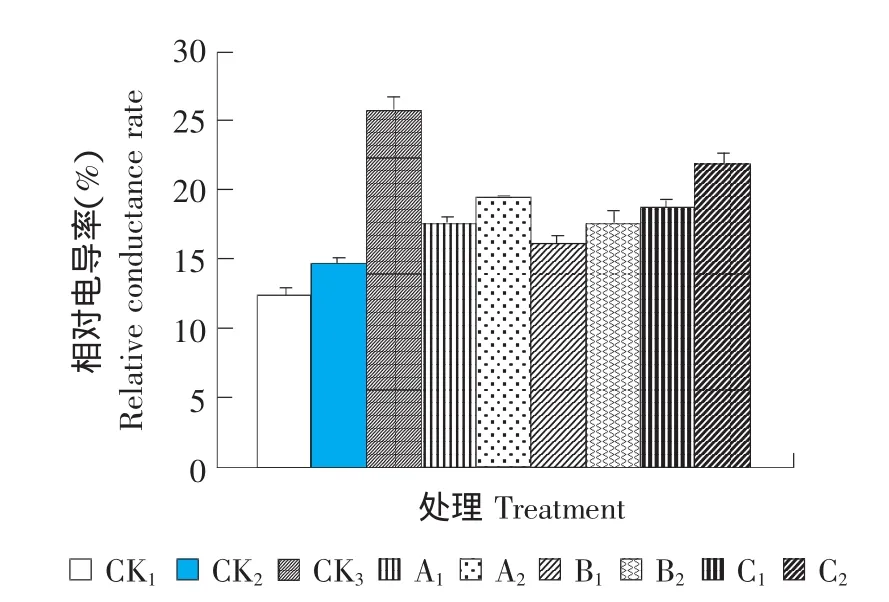
圖1 ABA、SA和CaCl2對番茄幼苗相對電導率的影響Fig.1 Effect of ABA,SA and CaCl2on relative conductance rate of tomato seedlings

圖2 ABA、SA和CaCl2對番茄幼苗MDA含量的影響Fig.2 Effect of ABA,SA and CaCl2on MDA content of tomato seedlings
如圖1、2所示,與室溫條件的CK1和CK2相比,低溫脅迫后番茄植株體內的相對電導率和MDA含量均有不同程度的提高,經過外源ABA、CaCl2、SA處理后的番茄植株,對低溫脅迫有一定的緩解作用,與低溫脅迫條件下的CK3相比,各處理體內相對電導率和MDA含量均明顯降低。每種外源物質中,低濃度處理下(A1、B1和C1)植株體內的相對電導率和MDA含量均低于高濃度處理,特別是A1、B1和C1處理中MDA含量基本接近CK2。
2.3 ABA、SA和CaCl2對番茄幼苗體內葉綠素含量的影響
結果見圖3。
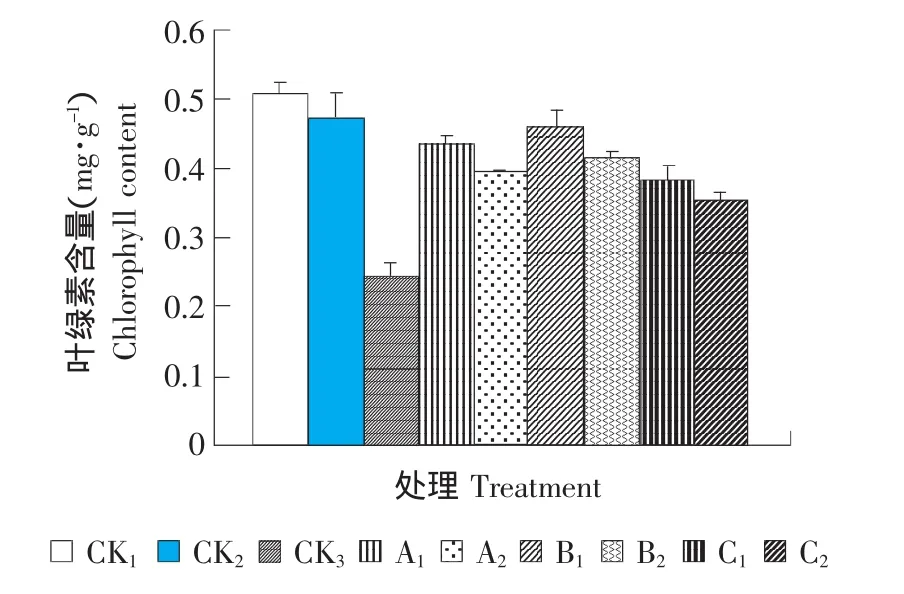
圖3 ABA、SA和CaCl2對番茄幼苗葉綠素含量的影響Fig.3 Effect of ABA,SA and CaCl2on chlorophyll content of tomato seedlings
如圖3所示,在室溫條件下,植株體內葉綠素含量表現為CK2略低于CK1,兩者之間差異不明顯,說明短期的培養箱內弱光對番茄植株體內葉綠素含量影響不大。低溫脅迫后各處理體內葉綠素含量不同程度降低,其中未經外源物質處理的受低溫脅迫的CK3體內葉綠素含量最低,明顯地低于其他各個處理。經過外源ABA、CaCl2、SA處理后的植株在低溫脅迫下其體內葉綠素含量與常溫光照培養箱條件下的CK2相比有不同程度的下降,但下降幅度不大,其中B1和A1處理下植株體內葉綠素水平基本與CK2一致,說明外源ABA、CaCl2、SA可以延緩葉綠素的降解,從而提高葉片的光合能力,減輕低溫對番茄的傷害,有效地提高其抗冷性。三種外源物質中,低濃度處理下植株體內葉綠素含量均高于高濃度處理。
2.4 ABA、SA和CaCl2對番茄幼苗體內脯氨酸含量的影響
結果見圖4。

圖4 ABA、SA和CaCl2對番茄幼苗脯氨酸含量的影響Fig.4 Effect of ABA,SA and CaCl2on Pro content of tomato seedlings
如圖4所示,低溫脅迫條件下,經外源ABA、CaCl2、SA處理后,植株體內脯氨酸含量迅速積累,與CK1、CK2和CK3相比,各處理均明顯升高。CaCl2處理下脯氨酸含量總體水平最高,其次為ABA處理,再次為SA處理。在本試驗選用的三種外源物質處理下,均表現為低濃度的處理更有利于脯氨酸的積累。
3 討論
本試驗處理植株的光照培養箱內光照、溫度、濕度、制冷時產生的風力等因素對植株生長都會產生一定的影響。在同樣的溫度下,弱光則是影響植株生長的一個主要的因素。由于本試驗所用的光照培養箱內的光比較弱,平均光強為4 000 lx,低于溫室內的光強(平均光強為20 000 lx)。為此,本試驗設置了一個在溫室正常條件下的對照CK1,探討光照培養箱的弱光對植株的影響,結果發現在同樣的常溫下,短時間內(3 d)除光照培養箱內植株(CK2)的相對電導率明顯高于溫室植株(CK1)外,MDA含量和脯氨酸含量表現為CK2略高于CK1,而葉綠素含量表現為CK2略低于CK1。說明植株在光照培養箱內處理3 d,已經表現出弱光脅迫的趨勢。
低溫對細胞膜系統的損傷是造成植物冷害的機制之一[12],植物在逆境脅迫過程中,會產生過剩的自由基,其毒害之一就是引發或加劇膜脂過氧化作用,丙二醛(MDA)是膜脂過氧化作用的最終產物[13]。MDA含量和相對電導率越高,說明細胞膜的損傷程度越重。本試驗噴施CaCl2、SA和ABA后在低溫脅迫的條件下,均大大降低了MDA含量和相對電導率,說明噴施這三種外源物質對低溫冷害都有緩解作用,提高了番茄幼苗的抗冷性。
低溫脅迫可促進葉綠素的降解并抑制葉綠素的合成,葉綠素降解是逆境脅迫下植物自身的一個重要特征。葉綠素含量下降越快,則呈現冷害癥狀越早[3],本試驗也表明了葉綠素含量越低,冷害指數越高,其中在光照培養箱內進行低溫脅迫的CK3中,表現為植株體內葉綠素含量最低,而冷害指數最高,在冷害指數上與其他處理相比達到了顯著或極顯著水平。通過施用一定濃度的外源ABA、CaCl2、SA,在低溫脅迫下均延緩了葉綠素的降解,進而促進了光合作用,提高了植株的抗冷性。脯氨酸對植物抗逆性有著重要作用,不僅作為滲透調節劑、而且能保護膜結構、防止膜脂過氧化[14],抗逆性(抗旱、抗鹽、抗寒)強的植物均含有較高的脯氨酸[15]。本試驗植株經低溫脅迫后,體內脯氨酸含量有所增加,而經過三種外源物質處理后的植株則在低溫脅迫后體內脯氨酸含量增加迅速,高于未進行外源物質處理的植株,脯氨酸含量增加對膜結構具有一定保護作用,因而使冷害指數降低。
4 結論
噴施一定濃度的外源ABA、CaCl2、SA,降低了番茄植株體內的相對電導率和丙二醛含量,延緩了葉綠素的降解,增加了脯氨酸的積累,進而有效地降低冷害指數,提高番茄幼苗的抗冷性,在所有處理中以 1 400 mg·L-1CaCl2處理(B1)的效果最好。
[1]潘瑞熾,郭確.脫落酸與植物抗冷性[J].植物生理學通訊,1995,31:265-270.
[2]李延軍,王麗麗,蔣欣梅,等.外源水楊酸誘導對番茄幼苗抗冷性的影響[J].東北農業大學學報,2006,37(4):463-467.
[3]趙敏,單文榮,趙國紅.抗冷劑“冷凍寶”對番茄苗期抗冷性的影響[J].安徽農業科學,2005,33(3):420-421.
[4]李國婧,周燮.水楊酸與植物非抗性脅迫[J].植物學通報,2001,18(3):295-302.
[5]康國章,王正詢,孫谷疇.幾種外源物質提高植物抗冷性的生理機制[J].植物生理學通訊,2002,38(2):193-197.
[6]林多,魏毓棠,王世剛.番茄耐低溫研究進展[J].沈陽農業大學學報,2000,31(6):585-589.
[7]王孝宣,李樹德,東慧茹,等.番茄品種耐寒性與ABA和可溶性糖含量的關系[J].園藝學報,1998,25(1):56-60.
[8]刁艷,于錫宏,蔣欣梅.低溫脅迫下外源物質對番茄幼苗膜脂過氧化作用的影響[J].東北農業大學學報,2008,39(5):44-47.
[9]張險峰,蔣欣梅,于錫宏.CeCl3噴施對黃瓜幼苗抗冷性的影響[J].東北農業大學學報,2008,39(7):25-28.
[10]姜述君,常纓,范文艷,等.溫度逆境鍛煉對低溫脅迫下番茄幼苗細胞膜脂質過氧化產物及抗氧化酶活性的影響[J].中國農業通報,2007,23(10):444-448.
[11]張憲政,譚桂茹,黃元極,等.植物生理學實驗技術[M].遼寧:遼寧科學技術出版社,1989:103-111,329-339,348-352.
[12]潘杰,簡令成.植物寒害和抗寒機制中膜與蛋白質研究的進展[J].植物學通報,1990,7(1):1-5.
[13]陳少裕.膜脂過氧化對植物細胞的傷害[J].植物生理學通訊,1991,27(2):84-90.
[14]Xin Z G,Li P H.Relationship between proline and ABA in the induction of chilling tolerance in maize suspension cultured cells[J].Plant Physiol,1993,103:607-613.
[15]David R,Duncan D R,Widholm J M.Proline accumulation and its implication in cold tolerance of regenerable maize callus[J].Plant Physiol,1987,83:703-708.

