“百會”透“曲鬢”對急性腦出血大鼠腦組織AQP-4表達影響的實驗研究
張國威,鄒偉,劉芳,郭新年,趙佳輝,孫曉偉,李丹,于學平,滕秀英,王瓏,滕偉
(1.內蒙古民族大學醫學院,內蒙古 通遼 028000;2.黑龍江中醫藥大學附屬第一醫院,黑龍江 哈爾濱 150040;3.黑龍江省哈爾濱市第一醫院,黑龍江 哈爾濱 150010;4.黑龍江省康復醫院,黑龍江 哈爾濱 150018;5.黑龍江省中醫研究院,黑龍江 哈爾濱 150036;6.哈爾濱醫科大學第一臨床醫學院,黑龍江 哈爾濱 150001)
腦出血(Intracerebral hemorrhage,ICH)指原發性非外傷性腦實質內出血,約80%發生于大腦半球(基底節70%、腦葉10%),其余20%發生于腦干和小腦,約占全部腦卒中的20%~30%。急性期病死率約30% ~40%,是腦血管病中發病急、病情重、死亡率高、致殘率高的疾病[1]。本實驗通過自體血注入法制備腦出血大鼠模型;針刺組大鼠針刺患側百會透曲鬢穴;運用免疫組化等檢測方法,動態觀察不同時間點針刺頭部腧穴對腦組織中AQP-4陽性細胞表達的影響,探討針刺頭部腧穴對腦出血大鼠腦水腫的拮抗作用,為腦出血的治療開辟新的領域。
1 材料與方法
1.1 材料
健康雄性Wistar大鼠160只,體重(350±20)g,由哈爾濱市獸醫研究所提供(符合國家二級動物標準,動物質量合格證書號:SCXK(黑)20060021)。大鼠的飼養環境濕度45%~65%,溫度22~25℃。
1.2 方法
1.2.1 動物分組 健康雄性Wistar大鼠160只,體重(350±20)g。實驗前正常飼養1w。造模前禁食12h,禁水6h。隨機分為三組:模型組、針刺組、西藥組,每組50 只大鼠;每組再隨機分為 6h、1d、2d、3d、7d 五個亞組,每個亞組10只大鼠;制備腦出血模型;另設10只正常大鼠作為空白組。
1.2.2 模型制備 根據大鼠腦立體定位圖譜[2]確定右側尾殼核(caudate-putamen nucleus,CPu)位置。參照Rosenberg[3]等報道的方法制作腦出血大鼠模型。將大鼠用10%水合氯醛(350mg·kg-1)腹腔注射麻醉,俯臥位固定于立體定位儀上,使上門齒鉤平面比耳間線平面低2.4mm,這樣大鼠前囟和后囟在同一水平面上。取頭皮正中,備皮消毒,正中切口,長度約1cm,骨膜剝離器剝離骨膜,暴露前囟及冠狀縫,取前囟點(Bregma點)右旁開3.5mm,后0.2mm定點,用牙科鉆鉆直徑為1.0mm的圓孔,深達硬腦膜表面,鼠尾酒精消毒,距尾端3cm處剪斷鼠尾,用微量注射器取血50ul,將微量注射器固定于立體定位儀上,沿鉆孔垂直進針約6mm,將未肝素化的血液50ul以25ul·min-1速度推進尾殼核,留針約2min,緩慢出針。留針期間酒精棉球包扎鼠尾斷端傷口。術后局部噴灑慶大霉素,用牙科水泥封閉顱骨創口,縫合頭皮,局部皮膚采用碘酚消毒,防止局部感染影響指標觀察。
1.2.3 篩選成功模型的方法 大鼠造模完成,待大鼠清醒,采用 Berderson[4]評分法。
篩選成功模型動物。根據Berderson神經體征評分法:輕抓尾巴,提起高于桌面10cm,正常大鼠前爪伸直。0分:無神經功能缺損;1分:腦部病變對側腕關節、肘關節屈曲,肩內收屈曲;2分:上述體征+向麻痹側推阻力下降;3分:活動時向麻痹側打圈(呈追尾狀)。
1.2.4 實驗動物的干預方法 針刺組針刺患側“百會”透“曲鬢”穴,30min·次-1,每天1次。針刺方法:大鼠捆綁固定,用28號1寸毫針針刺患側百會穴透曲鬢穴,取穴方法參照華興邦等[5]制定的《實驗動物穴位圖譜》,進針0.8寸,留針30min,期間捻轉3次,每次5 min,以200r·min-1速度捻針。西藥組給予憶立福稀釋液1ml灌胃(按人:大鼠體重為200∶1配置)治療,每天3次。模型組大鼠于腦出血造模及評分后,給予大鼠類針刺組相同捆綁30min·d-1;類西藥組生理鹽水1ml灌胃,每天3次。空白組不做任何干預。
1.2.5 統計學分析 采用SPSS 13.0軟件進行統計。計量數據以(±s)表示。各實驗組間以及時間點的比較采用均值比較,一維方差分析,因子和因變量列,進行方差齊性檢驗。以P<0.01或P<0.05為有統計學意義。
2 結果
2.1 實驗動物數量分析 為保證篩選成功模型及足量雄性Wistar大鼠能進入結果分析,本實驗進行了雙倍造模,剔除不成功模型及死亡的大鼠,保證了每個亞組隨機足量大鼠進入了最終的結果分析,無脫失值。
2.2 各組大鼠AQP-4陽性細胞表達的免疫組化檢測結果
光學顯微鏡下,DAB顯色陽性細胞呈棕黃色或褐色,采用Motic Med 6.0病理圖像分析系統,每張片隨機觀察并計數腦出血區血腫周邊5個不重復視野,在400倍視野下,攝入圖像分析系統,選擇免疫組化分析模塊,通過灰度調節,區分視野內陽性信號面積并結合目測進行分析,計算陽性細胞總數。AQP-4陽性細胞主要表達在毛細血管內皮細胞、室管膜上皮細胞、神經膠質細胞(足突)。陽性細胞為空泡狀且主要染色在細胞膜上,胞漿及胞核幾乎未見染色。
空白組大鼠可見到較豐富的AQP-4陽性細胞表達,在毛細血管內皮細胞和神經膠質細胞呈現均勢現象,在個別神經元細胞膜上有微量表達。各造模組大鼠術后均出現不同程度的AQP-4陽性表達上升現象,除7d針刺組,其余造模組與空白組比較差異顯著(P<0.01)。7d針刺組AQP-4陽性細胞雖然在數量與空白組差別不大,但在毛細血管內皮細胞上反應稍弱。模型組大鼠術后6h即出現AQP-4陽性細胞表達增多,并呈現毛細血管內皮細胞反應性增多趨勢;1d明顯增多;2d時大量表達;3d時主要為毛細血管內皮細胞陽性反應并達高峰,膠質細胞表達相對少;7d時在毛細血管內皮細胞和神經膠質細胞陽性表達又逐漸呈現均勢現象,陽性細胞仍高于空白組。在6h時間點,針刺組AQP-4陽性表達均較模型組及西藥組減少,與模型組比較有差異(P<0.05)。針刺組與模型組1d、2d、3d、7d時間點比較,針刺組 AQP-4陽性表達均較模型組明顯減少(P<0.01)。針刺組與西藥組1d、2d、3d時間點比較,均有顯著差異(P<0.01);6h、7d時間點比較,差異不明顯。西藥組與模型組比較,2d時稍有差異(P<0.05),其余時間點無統計學意義(P>0.05)。
表1 各組大鼠AQP-4陽性細胞數的比較(±s)
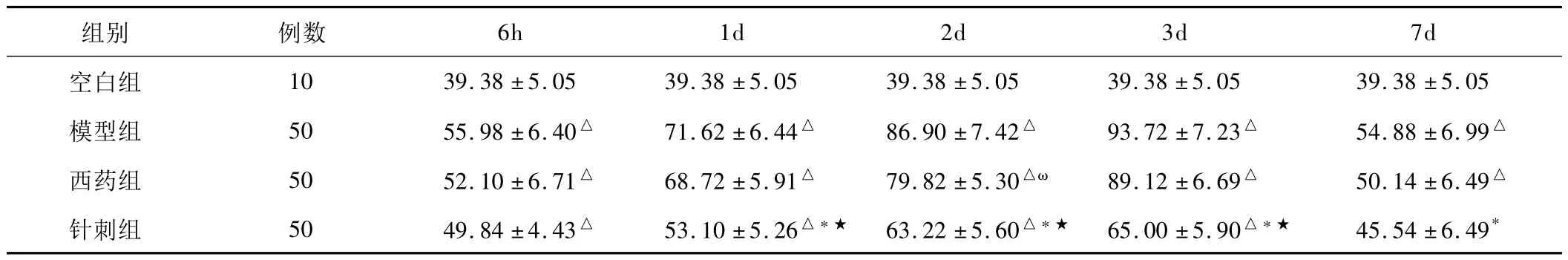
表1 各組大鼠AQP-4陽性細胞數的比較(±s)
注:各造模組與空白組比較,△P<0.01;針刺組與模型組比較,*P<0.01;針刺組與西藥組比較,*★P<0.01;西藥組與模型組比較,ωP<0.05。
6h 1d 2d 3d 7d空白組 10 39.38±5.05 39.38±5.05 39.38±5.05 39.38±5組別 例數.05 39.38±5.05模型組 50 55.98±6.40△ 71.62±6.44△ 86.90±7.42△ 93.72±7.23△ 54.88±6.99△西藥組 50 52.10±6.71△ 68.72±5.91△ 79.82±5.30△ω 89.12±6.69△ 50.14±6.49△針刺組 50 49.84±4.43△ 53.10±5.26△*★ 63.22±5.60△*★ 65.00±5.90△*★ 45.54±6.49*
3 討論
3.1 頭針療法在腦出血急性期應用的可行性探討
頭針療法是以針刺頭皮上的特定區、線,用來治療病證的一種療法,又稱“頭皮針療法”、“顱針療法”[6]。孫申田等[7]觀察到針刺百會透曲鬢穴,中風患者的腦血流圖有非常顯著的改善,同時發現其變化與手法捻轉頻率、刺激強度及作用時間等,關系十分密切。鄒氏等[8,9]通過復制急性高血壓腦出血大鼠模型,觀察針刺對血漿內皮素(ET)和降鈣素基因相關肽(CGRP)的影響,得出結論:針刺可以通過抑制血管ET和促進CGRP的釋放及其生物活性的作用達到治療急性高血壓腦出血的目的。頭針療法作為治療中風病的有效方法,在急性腦出血的治療方面更是一個有待深入探討、前景廣闊的研究領域。
3.2 頭穴透刺對腦出血大鼠腦組織AQP-4表達影響的探討
水孔蛋白(aquaporin,AQP)是上世紀九十年代初開始陸續發現的一類跨膜水轉運通道蛋白家族,是水分子跨膜轉運的主要分子基礎,參與調節細胞內外水的平衡,又稱水通道蛋白(water channel protein)。現已發現13種水孔蛋白(AQP0-AQP12)[9]。AQP-4主要分布于中樞神經系統血腦屏障和腦-腦脊液屏障的膠質細胞和室管膜上皮細胞,其中膠質細胞足突表達最密集,是膠質細胞與腦脊液以及血管之間的水調節和運輸的重要結構基礎[10,11]。在缺血、出血、外傷、腫瘤等各種原因引起的腦水腫中發揮重要作用[12]。
Taniguchi等[13]研究了大鼠大腦中動脈阻塞后AQP-4mRNA的表達情況。結果發現,第1d梗死灶周圍皮質AQP-4 mRNA的表達上調,第3d達高峰,第7d仍處于較高水平,這種變化與MRI顯示的腦水腫形成和消散相一致。Vizuete等[14]研究發現,立體定向注入喹啉(quinoline)可誘導病灶區及同側紋狀體AQP-4mRNA水平升高,其升高來源于活化的肥大膠質細胞,結合Evans藍標記發現,同側紋狀體區血腦屏障已破壞,但無神經元變性。提示AQP-4的升高與同側紋狀體血腦屏障的破壞相關,具有促進腦水腫的作用。周氏等[15]在腦出血大鼠血腫周圍組織水孔蛋白-4表達分析的研究中發現,腦出血(ICH)6h后血腫周圍組織鄰近毛細血管的AQP-4蛋白表達開始增高,于腦出血第1~3d達高峰期,之后逐漸下降,至第7d仍高于正常水平。在出血側皮質AQP-4蛋白表達亦相應增加,但不如血腫周圍組織明顯。得出結論:ICH時血腫成分可誘導AQP-4蛋白表達增加,腦毛細血管周圍星形膠質細胞終足表達增強的AQP-4蛋白可能促進水通過血-腦脊液屏障向腦實質流動,直接參與ICH后血管源性腦水腫的形成。以上這些研究提示AQP-4參與腦水腫的形成,抑制AQP-4可望為減輕各種腦病所致的腦水腫提供新的科研思路和治療途徑。
我們分析認為,腦出血后在血腫周圍存在明顯的毛細血管內皮細胞AQP-4陽性反應性增多,說明ICH時可誘導AQP-4蛋白表達增加,3d時主要為毛細血管內皮細胞陽性反應并達高峰,與腦水腫高峰一致,說明AQP-4可能主要參與腦水腫損傷機制。針刺能抑制AQP-4蛋白表達,表明針刺通過抑制AQP-4蛋白合成和分泌,減輕腦出血后AQP-4導致的腦水腫。我們推測其機制可能為:針刺通過抑制AQP-4蛋白合成和分泌,部分阻斷AQP-4參與的ICH后血管源性腦水腫的形成,降低水通過血-腦脊液屏障向腦實質流動而發揮拮抗腦水腫作用;針刺也可能通過降低或減弱AQP-4相關信號傳導途徑來發揮拮抗腦水腫作用;針刺也可能通過保護血-腦脊液屏障途徑反過來減弱AQP-4相關信號傳導,其相關機制還有待進一步研究。得出結論:頭針療法在腦出血急性期可能通過抑制內源性AQP-4表達發揮對腦水腫的拮抗作用;西藥組無效。
[1] 吳江,賈建平,崔麗英,等.神經病學[M].第一版.北京:人民衛生出版社,2006:170.
[2] 包新民,舒斯云.大鼠腦立體定位圖譜[M].北京:人民衛生出版社,1991:35-40.
[3] Rosenberg CA,Mun-bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats[J].Stroke,1990(21):801.
[4] Berderson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of neurologic examination[J].Stroke,1986(17):472 - 476.
[5] 華興邦.大鼠穴位圖譜的研究[J].實驗動物與動物實驗,1991(1):1.
[6] 王雪苔,黃羨明,邱茂良,等.中國針灸大全[J].鄭州:河南科學技術出版社,1988:573.
[7] 孫申田,李淑榮,朱永志,等.針刺百會曲鬢治療腦血管偏癱500例臨床研究[J].中國針灸,1984,4(5):4.
[8] 鄒偉,王茉蕾,于學平.針刺對急性高血壓腦出血大鼠血漿ET和CGRP 調整作用[J].針灸臨床雜志,2003,19(2):50 -51.
[9] 李丹,鄒偉,王瓏,等.針刺對實驗性腦出血急性期大鼠腦組織Nestin表達的影響[J].中醫藥學報,2010,38(2):60-62.
[10] Itoh T,Rai T,Kuwahara M,et al.Identification of a novel aquaporin,AQP 12,expressed in pancreatic acinar cells[J].Biothem Biophys Res Commun.,2005,330(3):832 -838.
[11] Venero JL,Vizuete ML,Ilundain AA,et al.Detailed localization of aquqporin-4 messenger RNA in the CNS preferential expression in periventicular organs[J].Neuroscience,1999(94):239 -250.
[12] BadautI,Verbavatz JM,Freund-MercierMI,et al.Presence of aquaporin-4 and muscarinic receptors in astrocytes and ependynal cells in rat Brain.a clue to a common function[J].Neurosci Lets,2001,297(3):163 -166.
[13] CRiesdale DE,Honey CR.Aquqporins and brain edema[J].Surg Neurol,2004(61):418 - 421.
[14] Taniguchi M,Yamashita T,Kumura E,et al.Induction of aquaporin-4 water channel mRNA after focal cerebral ischemia in rat[J].Brain Res Mol Brain Res,2000,78(122):131 -137.
[15] Vizuete ML.Differential upregulation of aquaporin-4 mRNA expression in reactive astrocytes after brain injury:potential role in brain edema[J].Neurobiol Dis,1999,6(4):245 -258.
[16] 周敬華,曹學兵,孫圣剛.腦出血大鼠血腫周圍組織水孔蛋白-4表達分析[J].中國神經免疫學和神經病學雜志,2006,13(4):230-233.

附圖:AQP-4陽性細胞表達的免疫組化檢測結果(400倍)


