新型分子靶向藥物聯合放療在肺癌中的應用
丁燕 李軍 翻譯 劉謙 南娟 校對
1天津醫科大學總醫院,天津市肺癌研究所,天津市肺癌轉移與腫瘤微環境重點實驗室;
2山東大學附屬山東省立醫院胸外科
前言
非小細胞肺癌(non-small cell lung cancer, NSCLC)約占肺癌總病例數的80%-85%,據估計2008年美國新診斷的肺癌病例超過215 000例。因診斷時大多數患者為晚期不可切除性腫瘤,預后較差。
不可切除III期NSCLC患者約占肺癌全部病例數的40%。不可切除III期NSCLC的標準治療為同步采用以鉑類為基礎的化療方案和胸部放療。目前,尚無一種放化療治療方案可作為標準方案。化療同步胸部放療治療可顯著改善不可切除IIA期和IIIB期腫瘤患者的生存期,為現有的治療選擇[1,2]。
現有研究熱點集中在新型制劑的研發以及治療聯合與新型制劑聯合的評估。在此背景下,鑒別有潛力的生物靶標尤為重要,阻斷這些靶標可影響多種下游信號級聯。在本綜述中,我們關注用于肺癌治療的這些新型制劑以及有前景的與放療聯合的新的方案(表1)[3,4]。

Tab 1 Major new agents in combination with radiation therapy表 1 與放療聯合的主要新型藥物
阻斷表皮生長因子通路與放療
最引人注目的通路之一為通過小分子(吉非替尼或厄洛替尼)或單克隆抗體(西妥昔單抗)聯合放療而抑制的表皮生長因子受體(epidermal growth factor receptor,EGFR)信號通路。
然而,在晚期患者中EGFR酪氨酸激酶抑制劑(tyrosine kinase inhibitor, TKI)與以鉑類為基礎的化療聯合并未產生任何生存獲益[5-8]。
源自直接臨床結果的有關TKIs與胸部放療間關系的數據尚較少,但的確有數據提示在體外TKIs可增強化療與放療的作用。
臨床前數據
西妥昔單抗是一種嵌合人-鼠單克隆抗體,可與EGFR結合,并可抑制無胸腺裸鼠體外及體內表達EGFR的癌細胞系的生長。放療可激活EGFR信號,通過誘導細胞增殖并增強DNA修復而導致放療抵抗。另外,其可引起G1期細胞的EGFR阻滯以及G2期細胞放療時的EGFR阻滯,在理論上這意味著EGFR表達與放射治愈率之間存在反向關系,尤其在小鼠腫瘤中[9]。幾項臨床前模型研究表明西妥昔單抗與放療聯合具有協同效應[10]。
Raben等在一篇質量頗高的文章中通過免疫組化及流式細胞術評估了人NSCLC癌細胞系中EGFR的狀態[11]。單獨使用西妥昔單抗或其與放療、化療或放化療聯合處理NSCLC細胞系,以確定西妥昔單抗在荷NSCLC的無胸腺裸鼠中體外及體內的協同效應。僅在對西妥昔單抗敏感的NSCLC細胞系中觀察到西妥昔單抗與放療體外聯合具有協同生長抑制效應。在對西妥昔單抗不敏感的NSCLC細胞系中并未觀察到該協同效應。在表達EGFR、對西妥昔單抗敏感且伴有NSCLC細胞系異種移植物的裸鼠中,與任一制劑單獨使用相比,西妥昔單抗與放療聯合可導致更為明顯的腫瘤生長抑制的改善。
吉非替尼具有放療增敏作用,這一點已在多種細胞系中得到證實[12]。研究表明,厄洛替尼可在多個水平(細胞周期阻滯、凋亡、誘導、加速的細胞再增殖以及DNA損傷修復)增強放療的療效[13]。
臨床數據
西妥昔單抗
在腫瘤生長控制方面,體內研究顯示西妥昔單抗與放化療的三藥聯合治療較兩藥聯合無顯著優勢。一些近期報道的臨床研究驗證了該臨床前觀察。癌癥和白血病B組(Cancer and Leukemia Group B, CALGB)30407(圖1)評估了使用培美曲塞、卡鉑以及胸部放療聯合或不聯合西妥昔單抗治療不可切除III期NSCLC患者的總生存期(overall survival, OS)。主要終點為生存超過18個月的患者所占的比例(兩組均>55%)。中位隨訪19.5個月后,對照組的總有效率及中位生存期分別為73%和22.3個月,西妥昔單抗組則分別為71%和18.7個月。總之,在放療和化療方案中加入西妥昔單抗似乎并未帶來進一步獲益[14]。
這些結果提示對于某些患者西妥昔單抗有益,但對于另外一些患者則有害,且西妥昔單抗的敏感性與EGFR表達水平并不明顯相關,盡管其敏感性似乎需要一定程度的EGFR表達。在76%的表皮型肺癌及47%的腺癌中存在EGFR的過表達,因此理論上NSCLC是該聯合方案的適應征。
然而,局限性晚期肺癌患者應用該治療方法的安全性仍需研究驗證。SCRATCH[15]研究旨在評估III期NSCLC患者同時使用西妥昔單抗與根治性放療的安全性。患者先接受以鉑類為基礎的誘導化療,然后每周靜脈注射西妥昔單抗(初始劑量,400 mg/m2;維持劑量,250 mg/m2)并同步進行放療(64 Gy/32次/45天)。12例患者中的9例按計劃完成了同步治療,且未減量。3例患者未完成整套方案;1例患者在治療中死于支氣管肺炎。這些結果提示西妥昔單抗與根治性放療同步使用的早期及晚期毒副作用均可接受。
NEAR試驗[16]旨在評估西妥昔單抗與適型調強放療(intensity-modulated radiation therapy, IMRT)局部照射聯合治療的毒性及可行性。
如上所述,該聯合方案給人以希望。直至現在,最令人印象深刻的結果為美國腫瘤放射治療組(Radiation Therapy Oncology Group)研究所獲(RTOG 0324;圖2)[17,18]。RTOG評估了西妥昔單抗(400 mg/m2,第1周的第1天)周劑量250 mg/m2直至治療完成方案在不可切除NSCLC患者中的療效。第2周,患者開始放化療(63 Gy)聯合每周卡鉑曲線下面積(area under the curve,AUC)2、紫杉醇(45 mg/m2,6次),隨后為2周期的卡鉑(AUC=6)和紫杉醇(200 mg/m2)。主要終點為西妥昔單抗同步放化療的安全性與依從性。治療相關毒性可以接受;在87例可評價的患者中,17例患者出現4級血液系統毒性,7例患者出現3級食管炎。2年隨訪顯示中位生存期為22.7個月,總生存率為49.3%,與之前在IIIA/IIIB期不可切除NSCLC患者中進行的RTOG研究相比,中位生存率及2年總生存率均較高。一項新近的小型研究報道了一類似的給藥方案,每周的第1天加入順鉑6 mg/m2,放療高達66 Gy。通過正電子發射斷層掃描,該研究顯示其代謝反應為50%,且毒性較低[19]。
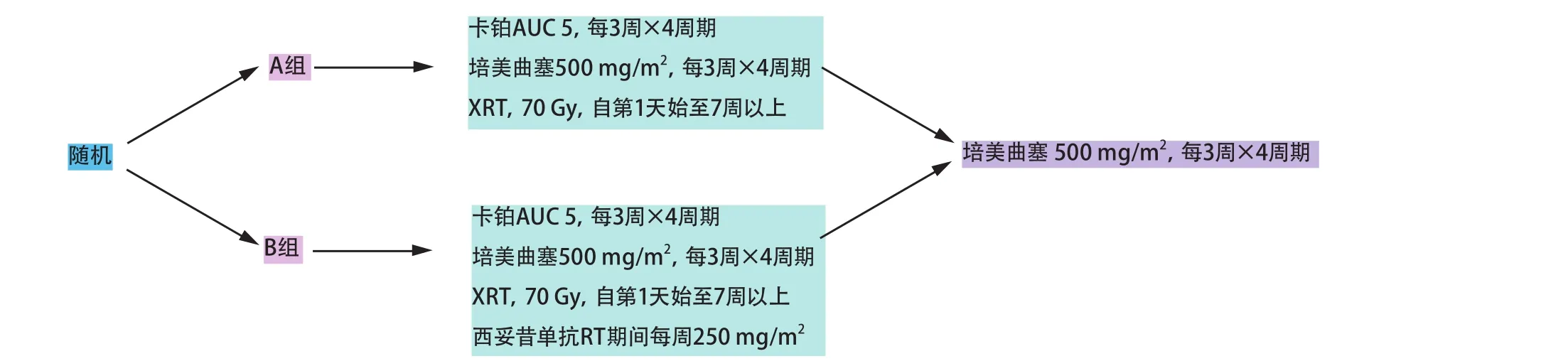
Fig 1 CALGB 30407: concurrent carboplatin, pemetrexed, and radiation therapy with or without cetuximab for unresectable stage III non-small cell lung cancer圖 1 CALGB 30407:卡鉑、培美曲塞以及放療同步聯合西妥昔單抗或不聯合西妥昔單抗用于治療不可切除III期非小細胞肺癌一項隨機II期試驗
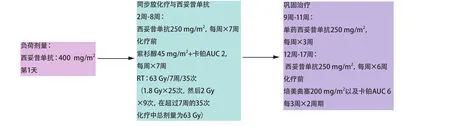
Fig 2 RTOG 032: A phase II study of cetuximab with chemoradiation therapy for stage III non-small cell lung cancer圖 2 RTOG 032:一項西妥昔單抗聯合放化療治療III期非小細胞肺癌的II期研究
在另一項研究中,患者接受誘導化療(多西紫杉醇/順鉑)隨后同步進行西妥昔單抗治療,研究顯示放療劑量為68 Gy是可行的。77%的患者接受了全程西妥昔單抗治療,生存良好。中位生存期為17個月,3年生存率為33%[20]。
與單用放療相比,放療聯合西妥昔單抗可顯著延長局部晚期頭頸部鱗狀細胞腫瘤患者的局部控制時間和中位OS[21]。目前,得到證實的是,在其它腫瘤中,突變型或野生型K-ras的存在可影響其對西妥昔單抗的反應,在本綜述發表之前這一點并不為人所知。很可能,對耐藥機制的深入理解以及準確選擇患者對改善腫瘤的預后有很大幫助。
吉非替尼
Stinchcomb及其同事研究了吉非替尼聯合放療在不可切除III期NSCLC中的安全性[22]。高劑量三維適形胸部同步放療的主要毒性作用為3級食管炎(19.5%)和心律失常(9.5%),但生存結果卻令人失望,OS僅為9個月。
然而,值得提及的是一些間接結果,其可明顯影響之后臨床試驗,如西南腫瘤組(Southwest Oncology Group, SWOG)III期研究(S0023)的結果[23]。該試驗旨在回顧性評估在非指定患者中吉非替尼在改善OS和無進展生存期方面的作用。采用順鉑、放化療聯合依托泊甙治療后,無進展疾病的患者隨后被隨機分組接受安慰劑或吉非替尼作為維持治療。一項包括573例患者的未計劃的中期分析顯示吉非替尼組較安慰劑組的OS短,吉非替尼組的中位生存期為23個月,安慰劑組為35個月(P=0.013)。如上所述,TKIs聯合化療的結果未見任何獲益,但至少對患者生存無害。此類結果迫使我們尋找可能的原因。吉非替尼組的毒性似乎并不大,在頭頸部腫瘤中其毒性與EGFR阻斷及放療亦無關。可能的是,之前的放療治療針對的是具有K-ras突變的細胞群,在該細胞群中TKI治療的療效較差[24,25]。在正常的臨床試驗設計中難以避免此種類型的分子異質性[26,27]。僅可能間接地推斷可能的原因。
在CALGB 30106試驗中,體能狀態良好的患者接受誘導化療隨后同步放化療,體能狀態較差的患者接受誘導化療隨后僅實施放療[28]。在放療或放化療期間或之后加用吉非替尼。兩組耐受性均較好。“低風險組”中位OS為19個月,“高風險”患者為12個月;這些結果提示預后不良組的活性增強。
厄洛替尼
厄洛替尼(另一種TKI)的作用機制與吉非替尼相似。厄洛替尼與胸部放療的治療證據較吉非替尼少。簡言之,盡管無額外毒性作用出現,結果并不鼓舞人心。Choong等實施的一項I期研究旨在確定厄洛替尼聯合2種標準放化療治療方案治療NSCLC的最大耐受劑量,但中位生存時間卻令人失望[29]。表皮生長因子受體免疫組化或熒光原位雜交(FISH)陽性患者在OS方面無顯著差異。
研究表明,某些治療手段可延長生存期,如同步化療后使用厄洛替尼作為維持治療,然而這些結果僅為非選用鱗癌組織學的早期研究[30]。
抗血管生成劑
人們感興趣的另一方法為抗血管生成劑聯合放療[31]。腫瘤細胞可產生生長因子,其可刺激內皮細胞的增殖和遷移,并最終導致腫瘤組織內新生血管的形成。放療可損傷細胞膜、DNA及腫瘤基質內的微血管內皮細胞,進而導致細胞死亡[32,33]。作為對內皮損傷和缺氧的反應,腫瘤細胞可增加促血管生成生長因子的表達,如血管內皮生長因子(vascular endothelial growth factor, VEGF)和成纖維細胞生長因子[34,35]。
因此,我們認為,抗血管生成治療聯合放療可能會改善腫瘤病情。然而,在將荷瘤模型的治療結論應用于患者時必須謹慎,因為根據荷瘤位置不同,基因表達可以有變化[36]。
應用ZD6474(一種強效的VEGFR2及EGFR賴氨酸激酶活性的口服抑制劑)可增強人NSCLC原位移植模型中放療的療效。在H441肺腺癌細胞的體外克隆形成細胞存活實驗中,ZD6474治療可消弱亞致死輻射損傷修復的能力,即使在肺癌細胞短期暴露于ZD6474之后。這些數據為針對人肺癌的生物靶向及傳統治療的臨床試驗提供了支持[37]。
有關貝伐單抗聯合胸部放療的研究尚較少。已報道的研究數據建議應慎用,且應采用臨床對照試驗。
一項II期試驗研究了小細胞肺癌患者使用卡鉑、依立替康及貝伐珠單抗每兩周10 mg/m2聯合胸部放療61 Gy的療效[38]。在該項多中心、非隨機、單組II期臨床試驗研究中,29例患者中2例確診患有嚴重的不良反應:氣管支氣管瘺。第3例死亡病例已報道,上呼吸消化道出血,死亡原因不明,疑為(但不確定)氣管支氣管瘺。所有的不良反應均發生在胸部放療后使用貝伐珠單抗作為維持治療的過程中,所有這些患者均患有3度食管炎。試驗在早期即終止。在單獨使用貝伐珠單抗和化療或同步使用放療治療的肺癌和食管癌患者中氣管支氣管瘺的其他病例也有報道。根據這些作者的經驗,氣管支氣管瘺的發生率為4.5%。局部組織損傷的增強和粘膜修復功能的受損與患者發生氣管支氣管瘺的機制相關。
與厄洛替尼、貝伐珠單抗及胸部放療相關的另一項II期研究已報道[39]。無死亡病例,3度食管炎的發生率為19.2%,2度食管炎的發生率為53.8%。尚缺乏明確的生存數據,但今年報道的數據較往年樂觀[40]。因此,在這些藥物與放療聯合時似乎應十分謹慎。患者的選擇對于避免可能的致死性毒性非常重要。
沙立多胺聯合化療的抗血管生成活性亦已被研究。新近,一項有關不可手術的IIIA期和IIIB期NSCLC患者的研究結果被報道。研究比較了卡鉑、紫杉醇及放療與相同方案聯合沙立多胺200 mg/d作為同步治療24個月或直至疾病進展的療效。277例患者被隨機分組治療,在發現無任何生存獲益后該試驗被終止。無沙立多胺組的中位生存期為15.3(12.4-20.2)個月,沙立多胺組則為16(14.4-18.3)個月[41]。
另外,不僅需要旨在尋找更佳療效的研究,亦需要明確治療的最佳次序及哪些藥物應該與抗血管生成劑聯合的研究。Huber等觀察了血管生成抑制劑SU11657、培美曲塞及電離輻射等全部三種治療方法同時服用的三藥聯合方案對人內皮細胞、A431人表皮樣癌細胞的體外作用及對BALB/c小鼠中A431人腫瘤移植物的體內作用[42]。他們發現,無論體外還是體內,三藥聯合的抗內皮及抗腫瘤效應均優于單一藥物及兩藥聯合。研究還發現,SU11657治療開始后給予放療方案較放療先于SU11657治療更為有效。
盡管這些制劑在臨床前研究中通常極為有效,但抗血管生成治療與放療在臨床中的應用需要在適當的患者群體中實施合理的治療方案以獲得任何潛在獲益[43]。
矛盾的是,抗血管生成劑可降低血管密度,但可改善腫瘤的含氧量。抗VEGFR治療后腫瘤中pO2的濃度開始降低,但隨后pO2穩步升高直至達到高于初始水平的水平。含氧量改善的一種可能的解釋為血管的正常化,毛細血管彎曲度減弱。在這方面,在含氧量水平較高的組織中放療更為有效[44]。
哺乳類雷帕霉素靶蛋白通路
磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKT通路可被Ras或通路中組分的突變以及生長因子受體的Ras信號去調節作用所活化。對于暴露于可引起DNA損傷環境中的腫瘤細胞來說,Ras信號的激活可延長其生存。阻斷EGFR/PI3K的活性可增強伴有K-ras突變的人腫瘤細胞的放療敏感性[45,46]。當被致癌性突變激活時,Ras的三種同分異構體H-ras、K-ras和N-ras均有助于放療生存,這說明,致癌性Ras表達抑制可降低兩種細胞系中的放療生存[47]。
PI3K/Akt通路中的一個重要的下游效應器為哺乳類雷帕霉素靶蛋白(mammalian targen of rapamycin,mTOR)。mTOR通路在蛋白質合成及細胞生長的調節中發揮重要作用。mTOR最具特征性的功能為對蛋白質合成的調節[48],其亦參與其它重要的細胞功能:如蛋白質的降解、蛋白質的穩定性、肌動蛋白細胞骨架的重構以及血管生成[49]。
mTOR的抑制可阻斷放療誘導的腫瘤細胞的應激反應,而應激反應可保護腫瘤微血管免受放療損傷。在腫瘤細胞中,mTOR的抑制可預防放療誘導的促血管生成生長因子的表達。內皮細胞似乎對mTOR抑制聯合放療最為敏感。因此,在體使用mTOR抑制劑RAD001和放療導致的附加的腫瘤生長延遲或許取決于抗血管生成及抗血管的聯合作用[50]。
一項I期試驗評估了標準三維適形胸部放療(60 Gy)、每周順鉑(25 mg/m2I.V.)與口服劑量逐漸增加的西羅莫司(sirolimus)聯合的療效。7例III期肺癌患者被納入該臨床研究。接受2 mg/d西羅莫司治療的4例患者中無一發生劑量限制性毒性。3例患者接受5 mg/d西羅莫司治療,在該劑量水平1例患者發生3度吞咽困難的劑量限制性毒性。
該通路中的遺傳變異可能調控臨床預后且可被用于建立個體化治療的模型[51]。
熱休克蛋白90抑制
熱休克蛋白(heat shock protein 90, Hsp90)作為分子伴侶在變性蛋白質,如AKT、HER2、Bsr-Abl、c-KIT、EGFR以及血小板源性生長因子受體(plateletderived growth factor receptor, PDGFR)-α的復性中發揮重要作用[52]。Hsp90抑制可導致化療敏感及化療抵抗小細胞肺癌細胞系中的大量細胞死亡。在臨床上,格爾德霉素復合物最為成熟,毒性作用可控[53]。
組蛋白去乙酰化抑制劑
組蛋白去乙酰化抑制劑(histone deacetylase inhibitors,HDACs)在細胞運動中發揮作用且參與多種轉錄因子的調節。伏立諾他及其它HDACs在包括NSCLC的多種癌癥中均取得了良好的療效[54]。
ErbB3的表達或許可預測HSP90介導的腫瘤細胞對放療的敏感性[55]。一項新近的研究為放療增強的HSP90分子伴侶功能在升高肺癌細胞中缺氧誘導因子(hypoxia-inducible factor, HIF)-1α及VEGF的蛋白水平中發揮主要作用提供了第一手資料,HIF-1α及VEGF的蛋白水平的升高使肺癌細胞具有生存及血管生長的潛能[56]。放療可通過兩種機制的協同作用增加放療抵抗肺癌細胞亞組中的HIF-1α蛋白水平:可刺激HIF-1α去重新合成的PI3K/Akt/mTOR的激活以及可導致HIF-1α蛋白穩定的Hsp90功能的激活。因此,阻斷PI3K/Akt/mTOR和Hsp90功能的制劑可通過抑制HIF-1α和VEGF的表達從而抑制肺癌細胞的生存及血管生成,因而可能用于減少放療抵抗。
Aurora激酶
人絲氨酸/蘇氨酸Aurora家族包括三個成員[57],這三個成員與其它許多蛋白相互作用以調控有絲分裂過程中染色體的組裝及分離。Aurora激酶在許多癌癥類型中高度表達[58,59]。Aurora A對有絲分裂紡錘體形成后中心體的正確分離以及早中期染色體的正確組織和分配非常重要。Aurora激酶A缺失時,有絲分裂紡錘體不能分離或折疊[60]。Aurora B是參與染色體分離和胞質分裂的一種染色體信使蛋白。Aurora激酶B通常在各種腫瘤中高水平表達,通常與Aurora A的表達一致,且表達水平與遺傳不穩定性的增加以及臨床預后不良相關[61]。目前大多數Aurora選擇性小分子抑制劑正在臨床前評估中[62-66]。
Aurora A的抑制聯合放療的療效尚不明確。一項研究評估了通過PHA680632抑制Aurora A激酶對暴露于電離輻射(ionizing radiation, IR)后的細胞周期進展及腫瘤細胞存活的影響[67]。細胞周期分析顯示暴露于PHA680632 24 h后DNA含量>4 N。當細胞同時接受輻射及PHA680632時,>4 N的DNA含量急劇下降。荷瘤小鼠的體內(p53-/-HCT116)研究顯示,較單獨IR相比,PHA680632-IR聯合治療可使腫瘤生長延遲增加。這些結果提示在癌細胞中PHA680632聯合放療可導致附加效應,尤其在p53缺失的細胞中,但無論體外還是體內PHA680632均非放療增敏劑。
另一Aurora B激酶抑制劑AZD1152。AZD1152是一種喹唑啉前體藥物,在血漿中轉化為其活性代謝物AZD1152-HQPA,AZD1152-HQPA對Aurora B和C具有很高的親和力。研究顯示,IR前使用AZD1152預處理細胞[68]可觀察到附加效應。有趣的是,在p53缺失的細胞中可觀察到更為明顯的腫瘤細胞殺傷作用。荷瘤小鼠的體內研究證實IR聯合AZD1152-IR較單獨IR更可延遲腫瘤的生長。同時,這種效應在p53-/-HCT116及p53突變的異種移植物中更為明顯。
這與進一步的臨床治療方案改善相關:在p53缺失的癌細胞中,Aurora B激酶抑制劑AZD1152在腫瘤對電離輻射的反應中的作用變弱。
Aurora B和survivin在間皮瘤中過表達。一項研究探討了放療是否可影響細胞中survivin及Aurora B的表達以及這些分子的抑制是如何影響放療敏感性的。ZM447439及survivin反義寡核苷酸分別用以抑制survivin及Aurora B激酶。放射劑量為3 Gy時,可觀察到survivin及Aurora B水平、Aurora B激酶活性以及G2/M期細胞的增加。放療誘導的這些分子的上調可被survivin反義寡核苷酸及Aurora B小分子抑制劑ZM44739有效減弱。survivin和Aurora B的雙重抑制可協同使間皮瘤細胞對放療敏感,其劑量增強比為2.55。該治療可導致放療后多核細胞的形成增加,但并不增加裂解的capase 3的水平。survivin及Aurora B的抑制可導致放療后間皮瘤細胞中的有絲分裂細胞停滯。這兩種蛋白可能是惡性胸膜間皮瘤放射治療的潛在治療靶點[69]。
結語
靶向治療聯合同步放化療治療目前正在研究中。最有前景的治療策略之一為EGFR通路的抑制。放射可激活EGFR信號,通過誘導細胞增殖并增強DNA修復而導致放療抵抗。數項臨床前模型研究表明西妥昔單抗聯合放療具有協同作用。一些II期試驗評估了西妥昔單抗與放療同時使用的安全性與療效,結果喜人。吉非替尼對細胞系具有放療敏化作用,且其聯合放療用于不可切除III期NSCLC的療效正在研究中。
在臨床前模型中血管生成治療可增強放療的療效。抗血管生成制劑可降低血管密度,但可改善腫瘤的含氧量;因此,我們認為抗血管生成治療聯合放療可改善腫瘤病情。新型藥物聯合同步放化療已成為局限期晚期NSCLC的一種令人感興趣的治療選擇。可以預測,進一步通過聯合新型生物制劑有望改善生存。
Disclosures
Mariano Provencio is in receipt of an intensification grant from the NHI-ISC III and FIS-PI080682 (government grant).

