大鼠肝移植術后腹腔細菌感染模型的建立與評價
丁隆,楊宇,董家鴻
(1.佳木斯大學附屬第一醫院普外二科,佳木斯 154003;2.佳木斯大學基礎醫學院局部解剖教研室,佳木斯 154007; 3.中國人民解放軍總醫院肝膽外科,北京 100853)
研究報告
大鼠肝移植術后腹腔細菌感染模型的建立與評價
丁隆1,楊宇2,董家鴻3
(1.佳木斯大學附屬第一醫院普外二科,佳木斯 154003;2.佳木斯大學基礎醫學院局部解剖教研室,佳木斯 154007; 3.中國人民解放軍總醫院肝膽外科,北京 100853)
目的 建立大鼠肝移植術后腹腔感染的模型。方法構建DA大鼠到LEW大鼠的肝移植模型,采用腹腔內細菌注射的方法建立感染模型,通過對大鼠肝功、血氣、血細胞計數等各項指標的檢測對模型進行綜合評價。結果肝移植術后5 d注射細菌,大鼠死亡率高,不利后續研究;術后3 d注射細菌,并選定5×105cfu/mL為最終注射濃度,感染后大鼠的7d存活率累計可達到37.5%左右,隨之感染的加重,大鼠狀態逐漸變差,直腸溫度不斷升高,WBC計數也隨之增加,pH下降,大鼠出現代謝性酸中毒,肝功能損害進行性加重,肝實質的損害重于膽道的損傷,大約在感染5 d左右相繼死亡,多器官病理分析表明,大鼠死亡原因為肝損害,不并發肺臟、腎臟損害。結論采用的腹腔內大腸埃希菌注射建立肝移植術后腹腔細菌感染的模型是比較成功的,可用于相關領域的研究。
肝移植;細菌感染,腹腔;免疫抑制;大鼠

大鼠原位肝臟移植(orthotop ic liver transp lantation in rat,ROLT)是研究肝移植免疫的理想模型。細菌感染是肝移植術后常見的并發癥,發病率較高,受到臨床廣泛關注。但目前針對這方面的基礎研究有限,考慮與技術原因有較大關系,肝移植模型的建立要求有較為成熟的技術,另外在器官移植排斥的基礎上建立細菌感染模型有一定的困難,動物死亡率高,模型的重復性差。本研究中我們以DA大鼠為供體,LEW大鼠為受體,在改良的Kam ada“二袖套”基礎上[2],以腹腔內注菌的方法建立大鼠肝移植術后腹腔細菌感染的模型。
1 材料與方法
1.1 動物模型的建立
成年雄性近交系DA和LEW大鼠,各174只,體質量200~220 g,分別購于哈爾濱醫科大學動物中心【SCXK(黑)2002-0002】和北京維通利華實驗動物有限公司【SCXK(京)2006-0009】,并按實驗動物使用的3R原則給予人道的關懷。供、受體體重差≤10 g。手術以DA大鼠為供體,LEW大鼠為受體,采用改良的Kam ada雙袖套法建立大鼠肝移植動物模型,共174只。細菌購于第三軍醫大學軍流教研室,為國標大腸埃希菌(Escherichia co li)8099。
行原位肝移植術,術后隨機分為2個注射時間點:術后3d和5d給予腹腔注射細菌,每個時間點依據注射濃度不同,隨機分成5個感染組,1個對照組(生理鹽水注射組):G1組:注射濃度為105cfu/mL,注射量為5 m L;G2組:注射濃度為105cfu/mL,注射量為2 mL;G3組:術后3 d或5 d,腹腔內生理鹽水注射2 mL;G4組:注射濃度為108cfu/mL,注射量為2 mL;G5組:注射濃度為107cfu/mL,注射量為2 mL;G6組:注射濃度為106cfu/mL,注射量為2 mL。
設菌液注射前1 d,注射后1 d、3 d、5 d、7 d共5個時相點,每個時相點6只動物,進行感染嚴重程度的判定;另外設8只大鼠觀察感染后一般情況和受體的存活時間。
1.2 主要檢測指標
1.2.1 一般情況:實驗對每個自然存活組的8只受體大鼠進行一般狀態觀察,主要是精神狀態、活動情況、飲食狀況、體重增減、尿液顏色及鞏膜有無黃染等現象的觀察,同時記錄每只大鼠的生存時間。
1.2.2 感染嚴重程度的判定:①直腸溫度測定:大鼠處死前使其處于自然狀態下測體溫。將室內溫度應控制在18~20℃,用膠皮管套在溫度計上方約2.0 cm處,在同一時間點將體溫計插入大鼠直腸內,深度為1.5~2.0 cm,3 m in后讀數,連續測量3次,取平均值。②生化指標的檢測:按上述采動脈血2 mL,用生化自動分析儀、血常規計數儀、血氣分析儀分別檢測白細胞計數(WBC);TCO2、HCO、 pH;ALT、TB等指標。③組織器官的病理學檢測:各組織塊以中性福爾馬林溶液中固定24 h,常規石蠟包埋切片,HE染色,觀察實質細胞的變化,炎性細胞的浸潤。光鏡下閱片。
1.2.3 感染的鑒定:動物處死后分別取腹腔沾液做細菌培養。
1.3 數據處理及統計學分析
所有數據分析均通過SAS 6.0軟件進行。各組間均數的比較采用雙因素方差分析進行檢驗,P< 0.05為相差顯著,P<0.01為相差十分顯著。生存時間采用軟件繪制成Kap lan-M eier曲線,比較采用對數秩和檢驗(Log-rank)。
2 結果
2.1 一般情況觀察
肝移植術后5 m in左右大鼠即清醒、站立,30 m in后能飲水;第2天各組大鼠的精神較差,有少量飲食,活動較少;第3天精神狀態、活動等有所好轉。
2.1.1 術后3 d注菌組:各組大鼠注菌后,精神狀態明顯變差,體重有不同程度下降,體溫升高,被毛雜亂,無光澤,食欲差;G1組5 d左右部分鼠可出現口鼻少量出血,呈嗜睡狀態,并有死亡鼠;感染后7 d大鼠生存率為37.5%(3/8),最長生存時間為感染后8 d,平均生存時間(9.25±1.24)d;G2組大鼠鞏膜黃染、尿黃呈進行性加重,多于術后12 d(感染后9 d)死亡,平均生存時間(12.88±1.61)d,與G1組比差異存在顯著性;G4組、G5組和G6組大鼠在細菌注射后12~48 h之內相繼死亡,死亡組解剖見:腹腔內無明顯腹水,肝脾腫大顯著,與周圍組織粘連較重,部分肝葉壞死,雙肺出血。
2.1.2 術后5 d注射細菌組:G1組大鼠在術后鞏膜漸進性黃染,口鼻眼角不同程度的出血,體重明顯下降,體溫升高,呼吸急促,活動減少,聚集成團,飲水量增加,48 h后相繼死亡,平均生存時間(8.00 ±1.33)d;G2組注菌后精神差,皮毛雜亂、無光澤,眼睛周圍明顯充血,尿色逐漸加深,注菌72 h后,大鼠相繼進入嗜睡狀態,最長生存時間為術后10 d,感染后5 d,平均生存時間(8.63±1.48)d,與G1組比較有統計學意義,P<0.01。G4組、G5組和G6組大鼠在細菌注射后12~24 h之內相繼死亡,存活時限較短。見圖1。
G3組于術后精神狀態尚可,6 d左右出現鞏膜黃染,體重逐漸下降,食欲、活動均下降,多于術后13 d左右死亡,平均生存時間為(12.75±1.5)d。
從上面結果觀察到:術后5 d腹腔注射組感染后大鼠存活時間較短,不利于進一步研究,因此在后續的研究中舍去。
Log-Rank卡方值=11.566;P=0.005,G1與G3組的生存時間有顯著統計學差異。
2.2 體溫觀察
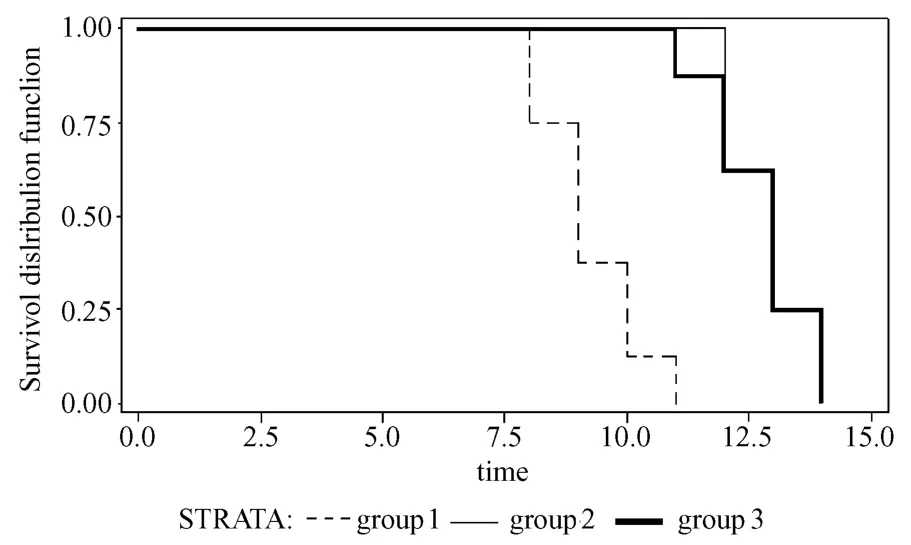
圖1 術后3 d注菌組大鼠術后(感染后)生存曲線F ig.1 Survival curves of the groups w ith in jection of bacteria on day 3 after transp lantation
G1、G2組大鼠感染后體溫逐漸升高,直至死亡,兩組相比在術后第4天、第8天和第10天相比差異顯著;G3組術后第2天,體溫略有升高(與G1組相比無統計學差異),隨后逐漸下降,至術后第6天左右再次升高,與G1、G2組比較有統計學差異。在組內3個實驗組的各時間點與前一時間點相比均有統計學意義。見表1。
表1 術后3d腹腔細菌注射大鼠直腸溫度變化比較(±s,n=8,℃)Tab.1 Comparison of the changes of rectal temperature in the ratswith injection of bacteria on day 3 after transplantation(±s,n=8,℃)

表1 術后3d腹腔細菌注射大鼠直腸溫度變化比較(±s,n=8,℃)Tab.1 Comparison of the changes of rectal temperature in the ratswith injection of bacteria on day 3 after transplantation(±s,n=8,℃)
注:a:P<0.05;c:P<0.01,組內與感染前相比;b:P<0.01;d:P>0.05,組間相比(與G1比較)。Note:a:P<0.05;c:P<0.01,Compared w ith that before infection in the same group;b:P<0.01,d:P>0.05,Compared between groups(w ith group G1).
組別Group術后(感染后)時間Postoperative(post-infection)time 10(7)d Day 10(7) 2 d Day 2 4(1)d Day 4(1) 6(3)d Day 6(3) 8(5)d Day 8(5)d G1 G2 G3 37.21±0.14 37.21±0.35 37.23±0.18 37.73±0.15a37.11±0.14b36.65±0.18b38.63±0.13c38.93±0.25cd37.43±0.57bc39.26±0.18c38.64±0.22cb38.12±0.33bc40.16±0.67c39.03±0.25cb38.92±0.22bc
2.3 血常規檢查
G1組大鼠術后WBC持續升高,感染后各時間點與G3組相比均有統計學差異,與G2組相比在感染3 d后各時間點相比有差異;G2組WBC在感染后先升高,感染后5 d下降,但與前一時間點及G3組相比無統計學意義;G3組則表現出先下降后升高的變化,與前一時間點相比雖無意義,但術后6、8、10 d與術后4 d相比,均有統計學差異(表2)。
表2 大鼠外周血白細胞計數比較(±s,n=8,×109/L)Tab.2 Comparison of peripheralw hite b lood cell counts in the rats(±s,n=8,×109/L)

表2 大鼠外周血白細胞計數比較(±s,n=8,×109/L)Tab.2 Comparison of peripheralw hite b lood cell counts in the rats(±s,n=8,×109/L)
注:a:P<0.05,組間相比(與G1比較);b:P<0.05;c:P>0.05組內相比(前一時間點)。No te:a:P<0.05,Compared betw een groups(w ith group G1);b:P<0.05,c:P>0.05 Compared w ith that of p revious tim e pointw ithin the sam e group.
組別Group術后(感染后)時間Postoperative(post infection)time 2 d Day 2 4(1)d Day 4(1) 6(3)d Day 6(3) 8(5)d Day 8(5)d 10(7)d Day 10(7) G1 G2 G3 9.33±3.31 8.46±3.29 8.55±2.33 16.95±8.64b13.93±3.20b6.57±2.73a28.23±7.99b19.44±6.92ac15.32±5.88ab33.16±9.94c15.93±5.93ac20.69±7.68a40.58±11.90c15.16±7.23ac22.75±8.13a
2.4 血氣結果
G1組大鼠在感染后的前3 d pH值有顯著升高,隨后下降,組內各時間點相比均有統計學意義; TCO2及HCO始終呈下降趨勢,提示感染后因過度通氣而導致呼吸性堿中毒,隨著感染加重,出現代謝性酸中毒。HCO在組內每一時間點與前一時間點相比無差異,但與感染前相比均有意義(P< 0.01);TCO2與前一時間點相比均有意義。
G3組三種指標在組內任一時間點與前一時間點相比均無意義(P>0.05),但術后8、10 d各指標與術后2 d比較有差異,與G1相比在術后第6天各指標均有明顯的統計學差異(見表3)。
2.5 肝功結果
G1組ALT、TB在術后和感染后持續上升,組內各時間點與前一時間點相比均有顯著的統計學意義;G2組變化趨勢類似于G1組,與G1組相比,ALT的變化無統計學意義,TB高于G1組,術后8、10 d有差異;G3組ALT、TB在術后先下降后上升,ALT的變化值低于G1組,與之相比有統計學意義,TB值則表現出高于G1組,并有明顯的統計學差異(P <0.05),(見表4)。
表3 大鼠主動脈血血氣的變化(±s,n=8)Tab.3 The changes of arterial b lood gas concen tration(±s,n=8)
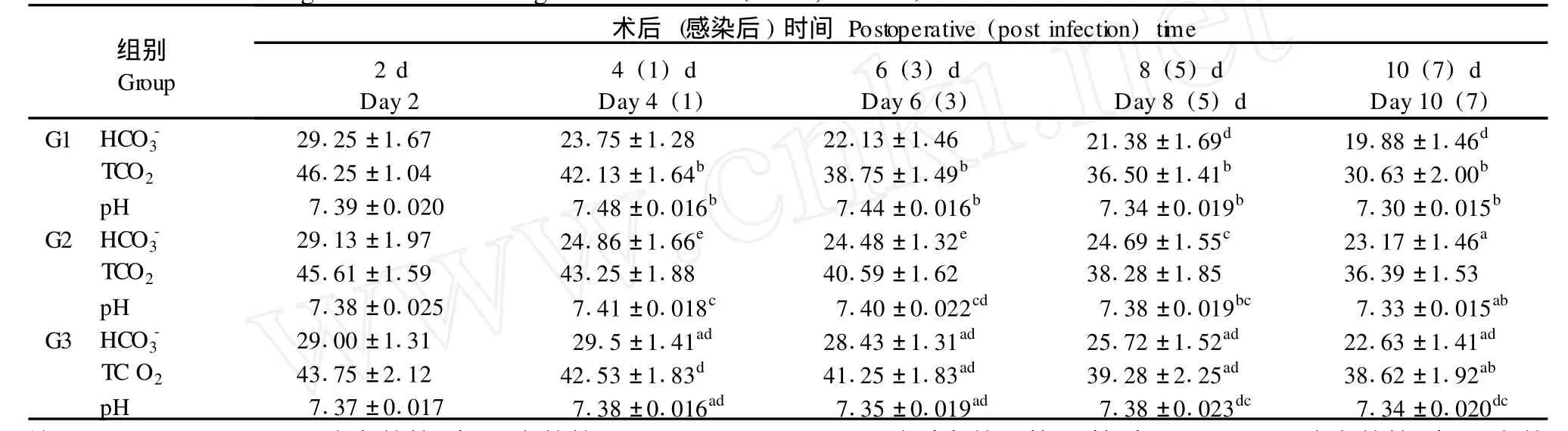
表3 大鼠主動脈血血氣的變化(±s,n=8)Tab.3 The changes of arterial b lood gas concen tration(±s,n=8)
注:a:P<0.01;c:P<0.05,組間比較(與G1組比較);b:P<0.05;d:P>0.05組內相比,(前一時間點);e:P<0.05,組間比較(與G3組比較)。Note:P<0.01,c:P<0.05,Compared between two groups,(compared w ith group G1);b:P<0.05,d:P>0.05,Compared w ith that of p revious time point in the same group;e:P<0.05,Compared between two group s(compared w ith group G3).
表4 各組肝功能變化比較(±s,n=8,U/L,m g/mL)Tab.4 Comparison of the changes of liver function(±s,n=8,U/L,m g/mL)

表4 各組肝功能變化比較(±s,n=8,U/L,m g/mL)Tab.4 Comparison of the changes of liver function(±s,n=8,U/L,m g/mL)
注:a:P<0.05,b:P>0.05組間比較(與G1相比);c:P<0.05,組內比較(前一時間點)。Note:a:P<0.05,b:P>0.05,Compared between two groups(comparedw ith group G1);c:P<0.05,Comparedw ith thatofp revious time pointw ithin the same group.
組別Group術后(感染后)時間Postoperative(post-infection)time 2 d Day 2 4(1)d Day 4(1) 6(3)d Day 6(3) 8(5)d Day 8(5) 10(7)d Day 10(7) G1 ALT 203.75±58.59 279.75±93.33c413.62±137.16c864.00±173.17c1077.25±296.46cTB 37.55±6.13 65.58±12.26b96.63±10.15 147.26±16.51 203.18±22.97 G2 ALT 197.00±24.73 239.38±39.58bc390.5±53.18bc776.62±121.22bc967.62±89.94cTB 37.13±17.03 48.43±14.26a103.08±33.75 189.36±26.83a274.98±50.47aG3 ALT 247.8±33.92 105.67±42.18a352.43±98.36b693.55±137.29a826.15±105.74bTB 30.29±11.38 27.46±5.77a98.25±26.81 213.94±47.53a368.35±21.32a
2.6 多器官病理學改變
G1肺臟和腎臟未見明顯的組織病理學改變。G1組隨著感染逐漸加重,大鼠肝臟匯管區部分受累、擴大,炎性細胞浸潤逐漸增多,膽管細胞水腫,排列紊亂,極性消失;無明顯的中央靜脈炎,肝實質細胞水腫壞死,間質水腫(見圖2,彩插7);G2組在感染后第5天除匯管區有炎細胞浸潤,中央靜脈周圍有明顯的淋巴細胞浸潤;G3組隨著術后3d匯管區僅有少量的淋巴細胞浸潤,隨著術后時間的延長,匯管區和中央靜脈周圍的淋巴細胞浸潤顯著增多(見圖3,彩插7)。
2.7 感染的鑒定
G1組各時間點腹水沾洗液培養24 h后均可見培養皿上散布的單克隆菌落生長,與我們復蘇培養的菌落形態一致;G2組在感染后第3天培養單克隆菌落數明顯減少,5 d后培養不再有菌落生長;G3組各時間點培養均未見有明顯的菌落生長。
3 討論
目前國際上通用的大鼠肝移植急性排斥研究的動物是近交系DA→LEW大鼠,平均術后5 d左右出現黃疸,表現出免疫排斥的病理改變。本研究以DA大鼠為供體,LEW大鼠為受體,采用改良的Kam ada“雙袖套”法建立肝移植模型[2]。
據現有的文獻報道[3-5],腹腔感染的方法有多種,所致的感染嚴重程度也不一樣。目前常用的方法主要有盲腸結扎(CL)、盲腸結扎加穿孔(CLP)、腹腔內自身糞便注射或活菌注射等。采用前二種方法建立的動物模型感染較重,往往需要在感染后行腸道手術和營養支持,而且72 h死亡率較高,感染嚴重程度不易控制,很難行二次干預。肝移植術后在臨床感染發生中,感染部位主要是腹腔、膽道、外科傷口、肺和血流等[1]。因我們研究的感染模型是建立在免疫排斥反應的基礎上,為盡可能的接近臨床感染,并使感染的嚴重程度便于控制,提高模型制作的可重復性,減少創傷,降低死亡率,我們最終選擇用活細菌注射的方法,建立肝移植術后腹腔感染模型,并選取臨床上相對比較常見的大腸埃希菌作為誘導感染菌[6]。
細菌濃度注射及術后何時注射細菌是本模型制作的又一難點。臨床上細菌感染的發生時間大多在術后2周內,從2 d到90 d不等,而移植排斥反應則發生在術后5~30 d[6]。為盡量模擬臨床感染特點,實驗中采用術后5 d注射細菌,但由于免疫排斥反應和急性感染的雙重作用,此時間點注射細菌大鼠的存活率低,僅為25%,故無法達到我們預期的實驗目標。根據大鼠術后的恢復情況及上述相關的因素,我們選擇了術后3 d腹腔內細菌注射,經觀察,感染后大鼠的7 d存活率累計可達到37.5%左右,因此我們最終選擇在術后3 d給予腹腔細菌注射。
在實驗過程中我們摸索了4個細菌濃度,5個注射量,結果顯示:過高的細菌濃度動物早期死亡率(12~48 h)較高,無法完成后續的實驗;在G2組(即2×105cfu/mL),感染后1~3d大鼠的精神較差,體溫和WBC計數逐漸升高,呈現出感染的狀態,同時腹腔沾液細菌培養陽性,也證實了感染的存在,但隨著病情的發展,大鼠的各項指標接近于G3組,尤其是在肝功方面,表現為TB的升高加快, ALT的變化與G1組比較雖然沒有統計學意義,但各個時間點的值均低于G1組,并且腹腔細菌培養呈現陰性。這些提示我們:低濃度雖然可提高大鼠的生存時間,但機體可依賴于自身的免疫反應而抗感染,因而為了達到實驗要求,在免疫排斥模型上,最終選定了5×105cfu/m L這個濃度,該濃度在不給予其他人為干預的情況下,感染可逐漸加重,并能達到較為理想的存活時間。
G1組大鼠在感染制模后第1天,表現出呼吸急促,易驚、行動遲緩;直腸溫度、動脈血WBC和pH值輕度的升高,TCO2和HCO3-下降,提示我們感染模型已成功建立,并因過度通氣出現呼吸性堿中毒;隨著感染天數的延長,大鼠狀態逐漸變差,直腸溫度不斷升高,WBC計數也隨之增加,pH下降,大鼠出現代謝性酸中毒;G1組大鼠的肝功能損害進行性加重,且肝實質的損害重于膽道的損傷(與G2、G3組比較)。大約在感染5 d左右部分大鼠出現口鼻或眼角出血,毛無光澤,蓬亂,并相繼死亡。解剖大鼠可見:無明顯腹水,肝脾明顯腫大,質地較硬;胃腸充血水腫,顯著脹氣;雙腎及肺臟未見明顯改變。人為處死大鼠的腹腔沾液培養可見有散在的單克隆菌落生長。從組織病理切片中我們觀察到,感染后第1天,肝臟匯管區有少量炎性細胞浸潤,匯管區擴大不明顯,但隨著感染的加重,上述改變逐漸加重,并有肝實質的壞死,淋巴細胞浸潤,膽管細胞水腫,但始終未見明顯的中心靜脈炎。肺臟及腎臟未見有病理損害。這些結果提示我們:該模型未造成其他臟器的損害,大鼠的死亡原因系由于肝功能異常及重癥感染所致,在進行相關研究時可排除非實驗因素的干擾。
本模型具有以下幾個特點:①可重復性強,無需二次手術,減少了動物創傷,提高了存活率;②無多器官臟器的損害,便于排除其他器官因素的作用,受損因素單一,有利于目的研究;③模型的建立尚有不足之處,因模型建立在免疫排斥反應的基礎上,動物死亡率較高,存活時間相對較短,不利于長期觀察。
(本文圖2,3見彩插7。)
[1] Toniutto P,Fumo,Caldato M,et al.Favourab le ou tcom e of adefovir-d ip ivoxil treatm ent in acute de novo hepatitisB after liver transp lantation[J].Transp lantation,2004,77:472-473.
[2] Kam adaN,Calne RY.O rthotop ic liver transp lantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage[J].Transp lantation,1979,28(1):47-50
[3] W ittman DH.Intra-abdom inal infection-introduction[J].W orld J Surg,1990,14:145-147.
[4] Ryan NT,B lackburn Gl,C lowes HA,et al.D ifferential tissue sensitivity to elevated endogenous insu lin levels during experimental peritonitis in rats[J].M etabolism,1974,23(11): 1081.
[5] Nakatani T,Sato T,M arzella L,et al.Hepatic and system ic metabo lic responses to aerobic and anaerobic intra-abdom inal abscesses in a highly rep roducib le chronic rat model[J]. Circu lator Shock,1984,13(3):271.
[6] 張棟,張忠濤,劉建,等.肝移植術后的細菌感染[J].中華肝膽外科雜志,2004,10(5):297-300.
Estab lishm en t and Eva lua tion of a Ra tM odel of Per itonea l Bacter ia l In fection a fter L iver Tran sp lan ta tion
D INGLong1,YANG Yu2,DONG Jia-hong3
(1.Depar tm ent of General Surgery,The FirstA ffiliated Hosp ital of Jiam usiUniversity,Jiam usi 154000,China; 2.Departm ent of RegionalAnatom y,Co llege ofBasicM edicine of Jiam usiUniversity,Jiam usi 154002; 3.Departm ent of Hepato-B iliary Surgery,A ffiliated Hosp ital of General Hosp ital of the Chinese Peop le’s L iberation A rm y,Beijing 100853)
O b jective To establish a rat model of peritoneal bacterial infection after liver transp lantation. M ethod s To construct a dark Agou ti rat-to-Lew is(DA-to-LEW)rat model of liver transp lan tation.Peritoneal bacterial infection in the ratswas induced by intraperitoneal in jection of bacterial suspension.The liver function,b lood gas,b lood cell count and other indicators of the rat models were detected.ResultsThere was a high mortality rate in rats w ith bacterial injection at day 5 after liver transp lantation,therefore unfavorable for the fo llow ing study.It was better to inject the bacteria in an amountof 5×105cfu/m L at day 3 after liver transp lantation.The cum ulative 7-day survival rate of those rats after infection reached up to 37.5%.The infection becam e increasingly severe,the general conditionswereworsening, the rectal temperaturewas rising,theWBC countwas increased,the pH was decreased,liver dysfunctionwasp rogressively increased,and m etabo lic acidosis occurred in the rats.L iver parenchym al dam age was mo re p ronounced than that of bile ductal in juries,and the rats died one after another at about 5 days after infection.Patho logical exam ination of m u ltip le o rgans showed that the m ain cause of death of the ratswas liver dam age,w ithout accompanying lung and kidney dam ages. Conc lusion The resu lts of this study suggest that it is a successful m ethod to estab lish a rat model of peritoneal bacterial infection after liver transp lantation,and thismodel can be used in related experim ental researches.
L iver transp lantation; Imm uno logical sensitization;Bacterial infection,peritoneal;Rat
R-33
A
1005-4847(2010)01-0069-05
2009-07-21
丁隆(1978--),女,博士,主治醫師。E-m ail:d inglongjm s@126.com
董家鴻

