血清高糖基化hCG檢測在21-三體綜合征產前篩查中的意義探討
徐曉姹 朱宇寧 呂時銘
(浙江大學醫學院附屬婦產科醫院,浙江省產前診斷中心,浙江 杭州 310006)
21-三體綜合征,又稱唐氏綜合征(Downs Syndrome,DS)或先天愚型,是最常見的染色體病之一。患者的智力低下并可能伴多發畸形,一旦出生即給家庭與社會帶來沉重的負擔。世界各國一直致力于通過產前篩查來減少21-三體兒的出生,采用的主要篩查方法為孕期母外周血血清標志物檢測。目前所用的血清標志物有AFP、F-β-hCG、uE3等,在5%假陽性率下,一般檢出率在65%~75%,這意味著即使進行了篩查,仍有30%左右的孕婦漏診。尋求新指標或方法提高21-三體兒產前篩查的檢出率,一直是產前篩查診斷領域的研究熱點。
高糖基化 hCG(hyperglycosylated hCG,HhCG)是hCG的一個變體,已有研究發現,妊娠期HhCG的改變可以預示母體或胎兒的一些病理狀態[1],有望作為篩查21-三體綜合征的一個候選標志物。本文收集孕中期母外周血標本115例,檢測血清HhCG水平,探討產前篩查中加入HhCG指標分析是否有助于提高產前21-三體的發現率。
1 材料和方法
1.1 標本組成 回顧性收集-70℃低溫保存2年內的孕15~20周的母血清產前篩查標本115例:17例確診為21-三體妊娠(其中2例產前篩查為假陰性,風險率分別為1/860、1/1 000),作為21-三體妊娠組;48例來自隨機抽取的21-三體高風險但產前診斷確診正常的同批產前篩查孕婦血清,作為高風險正常妊娠組;50例來自隨機抽取的21-三體低風險但隨訪確診正常的同批產前篩查孕婦血清,作為低風險正常妊娠組。所用母血清產前篩查指標是AFP和Free-β-hCG的二聯檢測,通過專用軟件并結合孕婦年齡、孕周、體重等計算21-三體征的風險率,以1/270為21-三體高風險的切割值,>1/270為21-三體高風險妊娠。高風險妊娠通過羊水細胞核型檢查確診,低風險妊娠隨訪追蹤至產后。
1.2 HhCG的檢測 使用美國Nichols Diagnostics公司生產的Nichols全自動化學免疫發光分析儀檢測。原理為雙位點夾心法:B152抗體為檢測抗體,特異結合HhCG;B207抗體為標記抗體,對hCGβ亞基特異,結合在HhCG的另一個相應位點,然后通過光譜儀檢測標記物的信號,根據定標濃度轉化為HhCG的濃度。AFP、F-β-hCG的測定使用Wallac時間分辨熒光免疫系統,試劑盒均為美國PE產品。
1.3 分析方法 采用國外文獻[2]中的計算公式:median Hh CG=26.8483*e[-0.112138*(days-98)]+8.97,計算不同孕周正常妊娠的HhCG中位數,以確定本實驗人群的Hh CG Mo M值。該計算公式用于亞洲人群需要校正種族差異,校正值為1.32。由于本實驗例數有限,HhCG篩查21-三體高風險的切割值以Pandian R等[3]在2004年對21-三體孕婦血清Hh CG水平的研究結果作為參考,即在5%假陽性率前提下,設定HhCG Mo M值大于2.9(正常妊娠的95百分位點)為21-三體高風險,據此作為單獨HhCG產前篩查指標的風險判斷標準。
2 結果
2.1 hCG的Mo M值 115例實驗對象的HhCG Mo M值分布見圖1。其中21-三體孕婦的HhCG水平明顯升高,82%(14/17)21-三體孕婦的 HhCG Mo M值大于7.14Mo M(本實驗98例正常妊娠的95百分位點);100%(17/17)大于2.9Mo M。
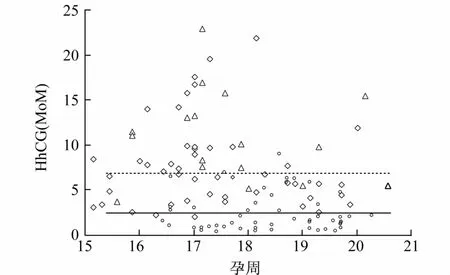
圖1 115例實驗對象HhCG(Mo M)的分布
21-三體妊娠、高風險正常妊娠和低風險正常妊娠3組數據對數轉化呈正態分布(表1),通過成組設計幾何均數的t-檢驗比較,發現21-三體妊娠孕婦的HhCG水平高于高風險正常妊娠(P<0.02)和低風險正常妊娠(P<0.001)。
2.2 21-三體兒檢出率比較 比較HhCG單項檢查與AFP、F-β-hCG篩查21-三體的可靠性(表2),兩項篩查效果有顯著差異(P<0.01)。其中,AFP+F-β-hCG二聯篩查21-三體漏診的2例標本的HhCG Mo M值分別是7.5和10.11,均為高風險。

表1 21-三體妊娠與高風險正常妊娠、低風險正常妊娠的HhCG Mo M值水平

表2 HhCG單篩查指標與AFP+F-β-hCG二聯篩查指標的篩查效果比較
3 討論
HhCG是h CG在血、尿中存在的其中一種形式,主要由細胞滋養層細胞分泌產生。HhCG最初是在滋養細胞疾病的診斷和監測中得到關注[4],隨著對胎盤發育的認識發展,研究發現HhCG在21-三體篩查、早期流產風險預測等方面也有一定價值[5,6]。Cole LA 等[7,8]兩次比較了21-三體妊娠孕婦與正常妊娠早、中期尿HhCG的水平,提出21-三體妊娠者尿HhCG水平明顯升高,Mo M值中位數達7.8和9.5,是正常妊娠的7~9倍,在5%的假陽性率下,檢出率可達78%~80%。之后,許多學者[9-12]相繼對21-三體妊娠者的孕早、中期的血、尿HhCG水平做進一步的研究,盡管Mo M值、中位數各有不同,在5%假陽性率下的檢出率也各有差異,但都證實了21-三體妊娠者孕早、中期的血、尿HhCG水平高于同期正常妊娠。2007年,Palomaki1、GE等在一項大樣本(21 641例)早、中孕期產前篩查研究中加入了血清HhCG指標,認為HhCG可以以一定的方式,如目前在用的游離βHCG替代用于產前篩查[13]。鑒于目前國內尚無HhCG在產前篩查中的研究報道,本研究選擇了115例已知妊娠結局的孕婦血清作HhCG測定,初步探討HhCG在中國人群21-三體產前篩查中的價值。
本研究中的17例21-三體妊娠者的血清HhCG Mo M值的中位數為10.11,均高于Pandian R等報道的正常妊娠95百分位點2.9Mo M,提示均為血清HhCG單指標高風險。該組標本的血清HhCG Mo M顯著高于根據AFP+F-β-hCG二聯篩查劃分的高風險正常妊娠組和低風險正常妊娠組,提示血清HhCG指標可能具有一定的獨立性。在21-三體妊娠組中有2例是AFP+F-β-h CG二聯產前篩查假陰性者(21-三體的風險率分別是1/860與1/1 000),而他們的 HhCG Mo M 值分別為7.5和10.11,表現為血清HhCG單指標高風險,說明增加HhCG測定可能是減少21-三體產前篩查假陰性的方法之一。
本組病例實驗所得的21-三體高風險者的HhCG Mo M切割值為7.14,顯著高于Pandian R等研究所得的2.9Mo M,為后者的3倍,提示血清HhCG值水平可能具有人群差異。但由于本組病例數有限,尚不能代表國內21-三體妊娠者的HhCG Mo M值水平,因此仍以國外文獻報道的2.9Mo M值作為風險評價界限。根據該風險評價標準,雖然21-三體的檢出率達到了100%(AFP+F-βhCG檢出率為88%),但假陰性率也高至50%(AFP+F-β-hCG為40%),該結果與風險閾值設定以及單一使用HhCG篩查均可能有關,這需進一步研究討論。
本研究只初步顯示血清HhCG有用于產前篩查的潛在價值,能否作為一個新的篩查指標或篩查方法還需要進行大樣本多中心的前瞻性研究。HhCG和目前二聯篩查中在用的F-β-hCG屬于hCG的不同分子形式,前者主要由未成熟的細胞滋養層細胞分泌,而后者主要由成熟的合體滋養層細胞分泌產生,它們之間的相關性也需要在大樣本基礎上進一步探究。因此,期待樣本量的擴大,建立更適合中國人群風險判斷的Hh CG Mo M值,同時探討將Hh CG指標以合適的形式納入到21-三體風險計算體系,以提高21-三體產前篩查的準確率。
[1]Birken S,Kovalevskaya G,O'Connor J.Immunochemical measurement of early pregnancy isoforms of HCG:potential applications to fertility research,prenatal diagnosis,and cancer[J].Arch Med Res,2001,32:635-643.
[2]Palomaki GE,Knight GJ,Roberson MM,et al.Invasive trophoblast antigen(hyperglycosylated human chorionic gonadotropin)in second-trimester maternal urine as a marker for Down Syndrome:preliminary results of an observational study on fresh samples[J].Clin Chem,2004,50:182-189.
[3]Pandian R,Cole LA, Palomaki GE.Second-Trimester Maternal Serum Invasive Trophoblast Antigen:A Marker for Down Syndrome Screening[J].Clin Chem,2004,50:1433-1435.
[4]Cole LA,Sutton JM.HCG tests in the management of gestational trophoblastic diseases[J].Clin Obstet Gynecol,2003,46:523-540.
[5]Sasaki Y,Ladner DG,Cole LA.Hyperglycosylated human chorionic gonadotropin and the source of pregnancy failures[J].Fertil Steril,2008,89:1781-1786.
[6]Cole LA.New discoveries on the biology and detection of human chorionic gonadotropin[J].Reprod Biol Endocrinol,2009,7:8.
[7]Cole LA,Shahabi S,Oz UA,et al.Urinary Screening Tests for Fetal Down Syndrome:II.Hyperglycosylated hCG[J].Prenat Diagn,1999,19:351-359.
[8]Cole LA,Shahabi S,Oz UA,et al.Hyperglycosylated human chorionic gonadotropin(invasive trophoblast antigen)immunoassay:a new basis for gestational Down Syndrome screening[J].Clin Chem,1999,45:2109-2119.
[9]Shahabi S,Oz UA,Bahado-Singh RO,et al.Serum Hyperglycosylated hCG:a Potential Screening Test for Fetal Down Syndrome[J].Prenat Diagn,1999,19:488-490.
[10]Abushoufa RA, Talbot JA,Brownbill K,et al.The development of a sialic acid specific lectin-immunoassay for the measurement of human chorionic gonadotropin glycoforms in serum and its application in normal and Down Syndrome pregnancies[J].Clin Endocrinal,2000,52:499-508.
[11]Spencer K,Talbot JA,Abushoufa RA.Maternal serum hyperglycosylated human chorionic gonadotropin(HhCG)in the first trimester of pregnancies affected by Down Syndrome,using a sialic acid-specific lectin immunoassay[J].Prenat Diagn,2002,22:656-662.
[12]Palomaki GE,Neveux LM,Knight GJ,et al.Maternal serum invasive trophoblast antigen(hyperglycosylated hCG)as a screening marker for Down Syndrome during the second trimester[J].Clin Chem,2004,50:1804-1808.
[13]Glenn E,Palomakil,Louis M,et al.Hyperglycosylated-hCG(h-hCG)and Down syndrome screening in the first and second trimesters of pregnancy[J].Prenat Diagn,2007,27:808-813.

