藍莓多糖的優化提取及抗氧化性研究
孟憲軍, 孫希云, 朱金艷, 李斌, 高嘵旭
(沈陽農業大學食品學院,遼寧沈陽 110161)
藍莓多糖的優化提取及抗氧化性研究
孟憲軍, 孫希云, 朱金艷, 李斌, 高嘵旭
(沈陽農業大學食品學院,遼寧沈陽 110161)
研究了將纖維素酶法和超聲波輔助法用于從提取花色苷后的藍莓殘渣中提取多糖的工藝,以達到優化工藝的目的;同時將粗多糖脫色脫蛋白后經二乙氨基乙基纖維素DE52柱層析純化得到的精多糖SPⅠ進行抗氧化試驗,檢測其抗氧化性。通過正交試驗設計,確定了最佳酶解提取工藝。結果為:酶法:酶解時間為100 min,酶解溫度為40℃,酶添加量為0.6%,料水比為1 g∶60 mL,條件最佳,藍莓多糖的得率為2.319%。超聲波輔助法:提取時間為40 min,提取溫度為50℃,超聲波功率為80 W,料水比為1 g∶60 mL,條件最佳藍莓多糖的得率為2.335%。工藝比傳統水提法簡單,得率高;抗氧化試驗顯示SPⅠ具有較強的抗氧化性質。
藍莓;多糖;提取;纖維素酶;超聲波;抗氧化性
藍莓(blueberry),又稱越橘、藍漿果,屬杜鵑花科越橘屬多年生落葉或常綠灌木。藍莓是一種耐寒性極強的野生植物,可抵御零下-50℃的嚴寒,原產于北美、蘇格蘭和俄羅斯,是一種森林中天然生長的野生資源[1]。藍莓因具有獨特風味及營養保健功能,如抗氧化防衰老、改善記憶和視力、消炎抗菌、治療心血管疾病等,被聯合國糧農組織列為人類五大健康食品之一[2]。在我國古代醫學書籍中,有很多關于越橘入藥的記載,而現在歐美國家對藍莓的營養保健功能也進行了大量研究,其含有花色苷,SOD等都得到廣泛的研究[3],目前國際市場上開發利用的藍莓保健品主要就是花色苷的提取物,在進行大量提取后會產生部分副產物,如不能對這部分加以充分合理利用,勢必造成藍莓果的大量浪費,因此對于這部分副產物的綜合利用以及其中活性成分的研究是很有意義的。目前,藍莓中多糖研究國內外尚未見報道,鑒于此,作者探索纖維素酶法和超聲波輔助法用于從脫去花色苷的藍莓殘渣中提取多糖的工藝,提高多糖得率,同時驗證藍莓多糖是否有功能性質,為藍莓多糖的生產和應用提供一定的理論依據。
1 材料與方法
1.1 主要材料與試劑
藍莓殘渣:沈陽農業大學食品學院藍莓脫花色苷后所得;纖維素酶(酶活性≥15 000 u/g,生化級):國藥集團化學試劑有限公司產品;二乙氨基乙基纖維素DE52:中國醫藥上海化學試劑公司產品;乙酸鉀:國藥集團化學試劑有限公司產品;聚酰胺:國藥集團化學試劑有限公司產品;鄰苯三酚:國藥集團化學試劑有限公司產品;三羥甲基氨基甲烷:國藥集團化學試劑有限公司產品;鄰氮二菲:國藥集團化學試劑有限公司產品;抗壞血酸:國藥集團化學試劑有限公司產品;葡萄糖,濃硫酸,鹽酸,磷酸,苯酚,乙醇,EDTA,丙酮,均為分析純試劑。
1.2 主要儀器與設備
7200型可見分光光度計,尤尼柯(上海)有限公司產品;電熱恒溫水浴鍋,常州國華電器有限公司產品;RE-52型旋轉蒸發儀:上海博通經貿有限公司產品;SHZ-IIIB型循環水真空泵:上海華琦科學儀器有限公司產品;TDL-5000B型離心機:上海安亭科學儀器廠產品;DZF6050真空干燥箱:上海一恒科技有限公司產品;粉碎機:上海世邦有限公司產品;數顯PH計:上海精密科學儀器有限公司產品;SBS-100數控計滴自動部分收集器:上海青浦滬西儀器廠產品;HL-2恒流泵:上海青浦滬西儀器廠產品;超聲波反應器(KQ-250A型):昆山市超聲儀器有限公司產品。
1.3 多糖提取
1.3.1 多糖含量測定 采用硫酸—苯酚法。準確稱取105℃烘干至恒重的標準葡萄糖25.0 mg于250 mL容量瓶中,加水至刻度并搖勻,分別取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL葡萄糖標準溶液,分別加水補至1.0 mL,然后加入質量分數5%苯酚1.6 mL及濃硫酸7.0 mL,充分搖勻,室溫放置25 min以后于490 nm測吸光度,以蒸餾水按同樣顯色操作為空白,以多糖質量濃度(x)為橫坐標,吸光度(y)為縱坐標,繪制標準曲線,計算出回歸方程。
精確吸取多糖樣品溶液1.0 mL,加入質量分數5%苯酚1.6 mL及濃硫酸7.0 mL,同標準曲線之操作,測定吸光度值。將其代入回歸方程,即可得多糖的含量。
樣品多糖得率(%)=多糖質量∕樣品質量× 100%
1.3.2 從藍莓果與藍莓殘渣中提取多糖的得率比較 分別取10 g藍莓果和藍莓殘渣粉,加入600 mL蒸餾水,90℃水浴4 h,醇沉(醇體積分數達80%),離心去沉淀,經丙酮,乙醇洗滌抽濾,真空干燥得粗多糖,溶解于水中的多糖含量。
1.3.3 酶法優化藍莓多糖的提取
1)提取工藝 藍莓殘渣→粉粹→加水60倍攪拌均勻→將p H值調至7.0→加入纖維素酶→100℃滅酶15 min→水浸1 h→3 000 r/min離心10 min→醇沉(醇體積分數達80%)→3 000 r/min離心10 min→丙酮,乙醇洗滌抽濾→真空干燥得粗多糖。
2)正交試驗 選擇纖維素酶對多糖提取有顯著影響的三項因素,做L9(33)正交試驗,得出酶法優化多糖提取的最佳工藝條件。
1.3.4 超聲波輔助提取藍莓多糖
1)提取工藝 稱取干燥至恒重的一定條件下粉碎的藍莓10 g,溶于60 mL蒸餾水中,不同超聲功率、超聲時間,超聲溫度處理,并不斷攪拌,取出后再以3 000 r/min離心10 min,棄去下層不溶物,取上清液,加入無水乙醇至乙醇體積分數為80%,冰箱中靜置過夜,取出,以3 000 r/min離心10 min,取沉淀,先后用丙酮、乙醚、乙醇沖洗抽濾,真空干燥得粗多糖。
2)正交試驗 選取超聲波對多糖提取有顯著影響的三項因素,做L9(33)正交試驗,因素水平范圍如下:時間(A)分別為40、60、80 min;溫度(B)分別為:40、50、60℃;時間(C)分別為:40、60、80 w。得出超聲波輔助提取多糖的最佳工藝條件。
1.4 多糖分離純化
采用聚酰胺脫色法,將一定量質量濃度為1 000 mg/L、p H值為7的多糖溶液加入到已處理好聚酰胺中,震蕩10 min,靜置過夜,取上清液;向上清液中加入乙酸鉀至乙酸鉀濃度為2 mol/L,4℃下靜置過夜,3 000 r/min離心10 min,取沉淀,真空干燥后溶于一定量的水中,蒸餾水透析過夜,真空干燥;將所得多糖配成5 mg/mL的溶液,過二乙氨基乙基纖維素DE52柱,采用0.3 mol/L的NaCL洗脫,測定得到兩組多糖SPⅠ,SPⅡ,前者較多,后者較少。
1.5 多糖抗氧化測定
1.5.1 消除羥自由基能力的測定 利用Fenton反應原理。取1 mL 0.75 mol/L鄰二氮菲溶液于試管中依次加入2 mL 0.2 mol/L磷酸鹽緩沖液p H 7.4和1 mL蒸餾水,充分混合均勻加入1 mL 0.75 mol/L FeSO4混合后,加入1 mL 0.01 mol/L雙氧水,置于37℃水浴中60 min后,536 nm測A損。未損傷管以1 mL蒸餾水代替1 mL 0.01 mol/L,測A未損,樣品管以1 mL樣品代替損傷管中1 mL蒸餾水,測A樣。1.5.2 消除超氧自由基能力測定 利用鄰苯三酚自氧化原理。4.5 mL 0.1 moL/lTris-HCl緩沖液(p H 8.2),依次加入1.00 mL 0.5mol/L EDTA溶液,1 mL樣品溶液,2.4 mL蒸餾水混勻于25℃水浴中反應10 min,再加入100μL 9 mmol/L鄰苯三酚,加入時計時,混勻,準確反應60 min,加入50μL 12 mol/L HCl溶液終止反應,325 nm處測定吸光度AS,空白以1 mL蒸餾水代替1 mL樣品,測AC。
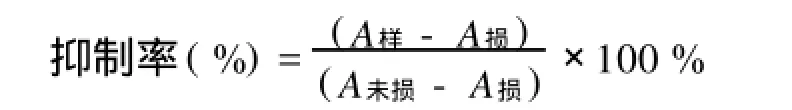
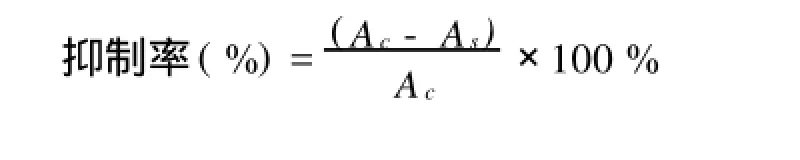
2 結果與分析
2.1 苯酚—的硫酸法測定多糖含量標準曲線
按照本實驗方法,所得標準曲線見圖1。回歸方程為:y=6.836 9x+0.089 7,r=0.999 0。
2.2 藍莓果與藍莓殘渣中提取多糖的得率比較
實驗測得藍莓多糖得率得率為2.332%,藍莓殘渣多糖得率為2.108%。除去花色苷的藍莓殘渣多糖含量與藍莓果中的多糖含量相差不大,藍莓中90%的多糖都殘留在殘渣中。重要是因為提取花色苷的工藝對多糖的溶解并不算高,使多糖遺留在殘渣中。所以從藍莓殘渣中提取多糖可以達到資源再利用的效果,減少資源浪費。
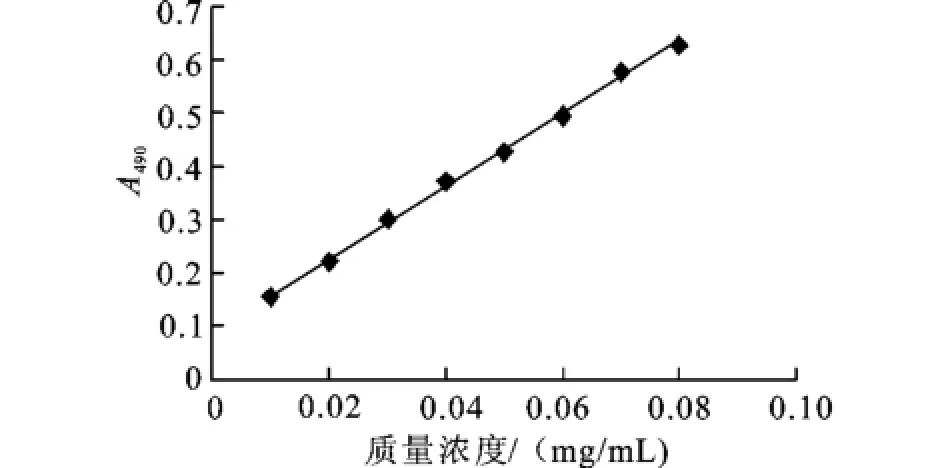
圖1 葡萄糖標準曲線Fig.1 The standard curve of glucose
2.3 酶解條件對藍莓多糖得率的影響
根據以上單因素試驗結果,確定因素水平范圍如表1,正交試驗的結果如表2,方差分析如表3。

表1 藍莓多糖提取試驗因素水平Tab.1 Level and factor on extraction test of blueberry polysaccharides
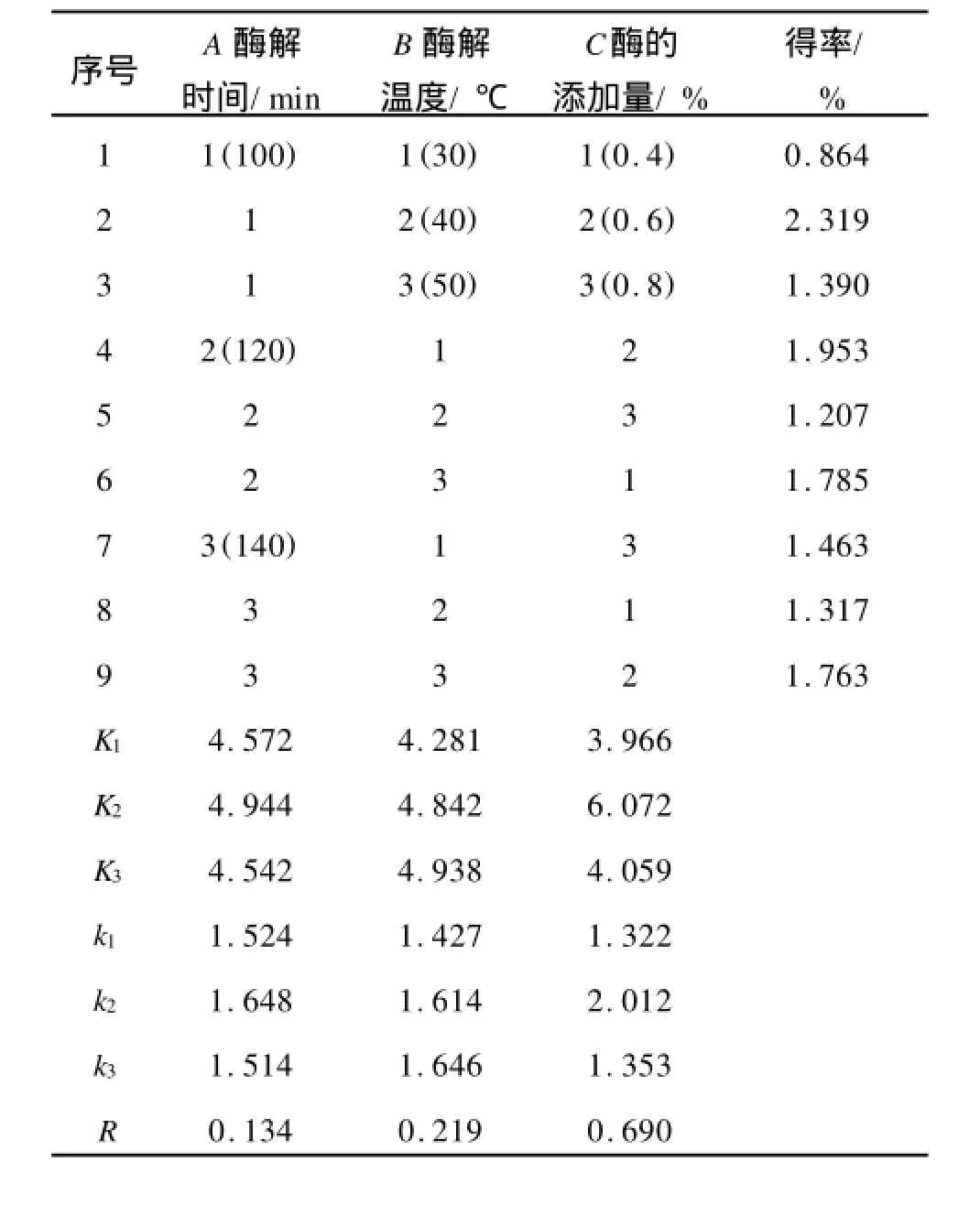
表2 正交試驗方案及結果分析Tab.2 The schemes and results analysis of orthogonal design

表3 藍莓多糖得率方差分析Tab.3 V arianceanalysis for yield of blueberry polysaccharides
從正交試驗和方差分析可以看出:R酶的添加量> R酶解溫度>R酶解時間,說明酶的添加量(C)對多糖得率的影響最為顯著,其次是酶解溫度(B)和酶解時間(A)。根據正交試驗得到的最佳工藝條件為A1B2C2:即酶解時間為100 min,酶解溫度為40℃,酶添加量為0.6%,藍莓多糖的得率為2.319%。
2.4 超聲波輔助提取藍莓多糖
根據以上單因素試驗結果,確定因素水平范圍,正交試驗的結果如表4,方差分析如表5。
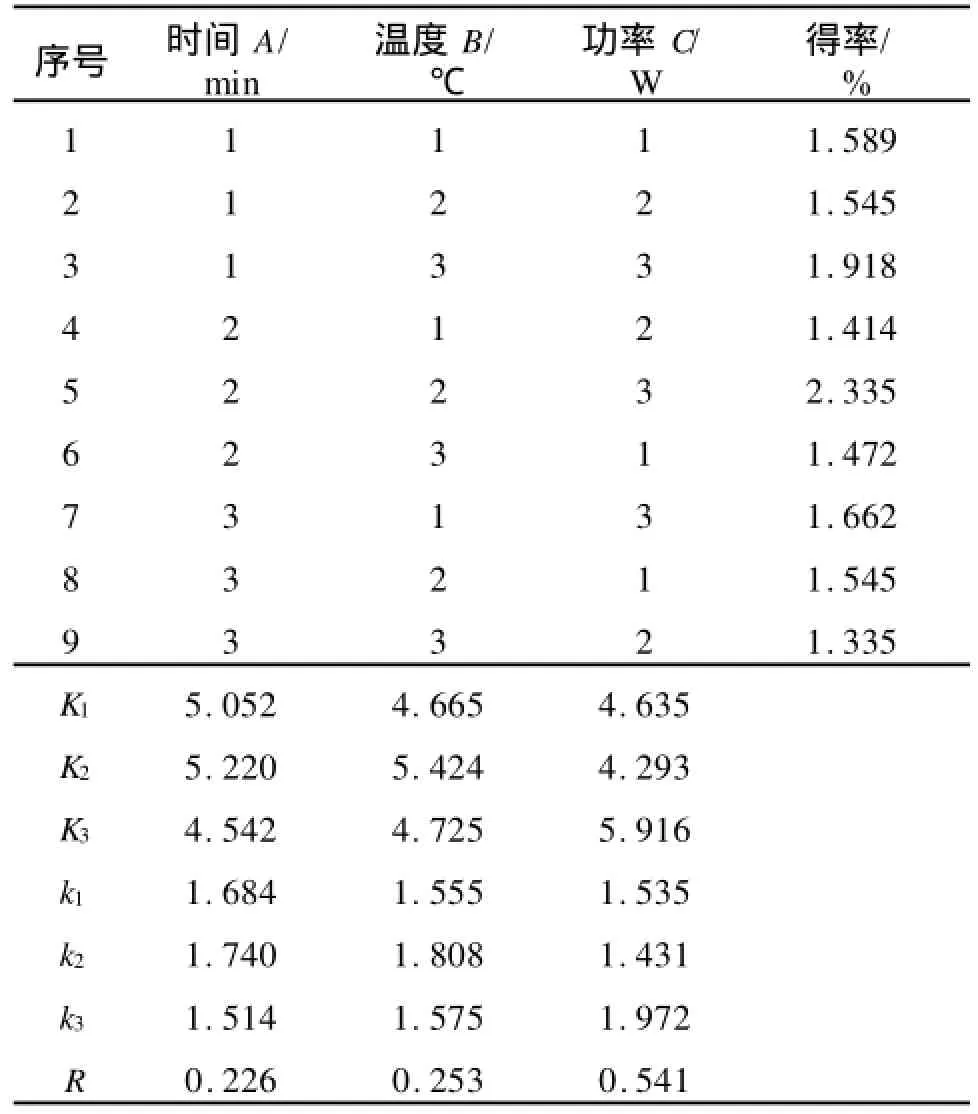
表4 正交試驗方案及結果分析Tab.4 The schemes and results analysis of orthogonal design
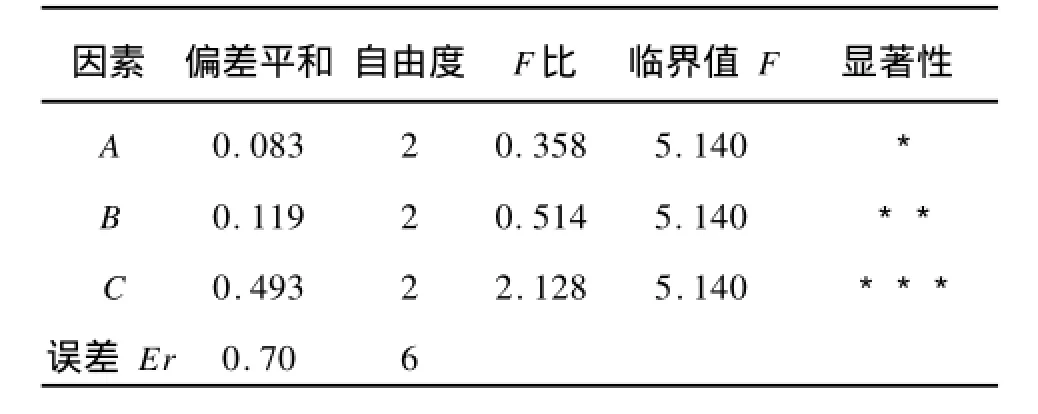
表5 藍莓多糖得率方差分析Tab.5 V arianceanalysis for yield of blueberry polysaccharides
從正交試驗和方差分析可以看出:功率>溫度>時間,說明超聲波功率(C)對多糖得率的影響最為顯著,其次是提取溫度(B)和提取時間(A)。根據正交試驗得到的最佳工藝條件為A2B2C3:即提取時間為40 min,提取溫度為50℃,超聲波功率為80 W,藍莓多糖的得率為2.335%。
2.5 抗氧化性的測定
2.5.1 消除羥自由基能力的測定 由圖2可以看出,SPⅠ的抑制率在0.2~1.0 mg/L質量濃度范圍內,
隨質量濃度的上升而不斷增強,在低質量濃度范圍內它與VC的抗氧化能力接近,質量濃度大于0.8 mg/ mL以后抑制率將明顯低于VC,這說明SPⅠ在低質量濃度范圍內就具有較強的消除羥基自由基的能力。
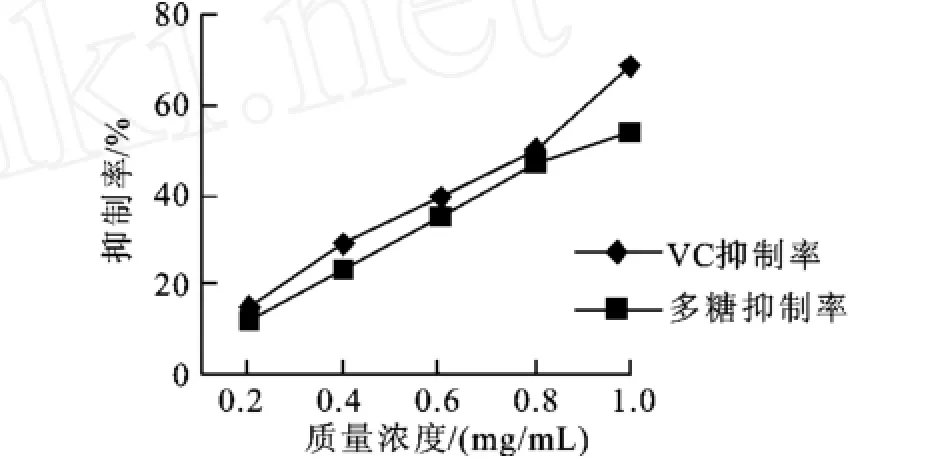
圖2 SPⅠ和VC清除羥自由基的能力的比較Fig.2 The comparison of scavenging hydroxyl radicals between SPⅠand VC
2.5.2 消除超氧自由基能力的測定 由圖4可知,在鄰苯三酚自氧化反應體系中,SPⅠ具有消除超氧自由基的能力,并隨質量濃度的上升,消除能力增強;與VC的抑制率略低,質量濃度越高,兩者的抑制率越接近。說明SPⅠ同樣具有較強的消除超氧自由基的能力。
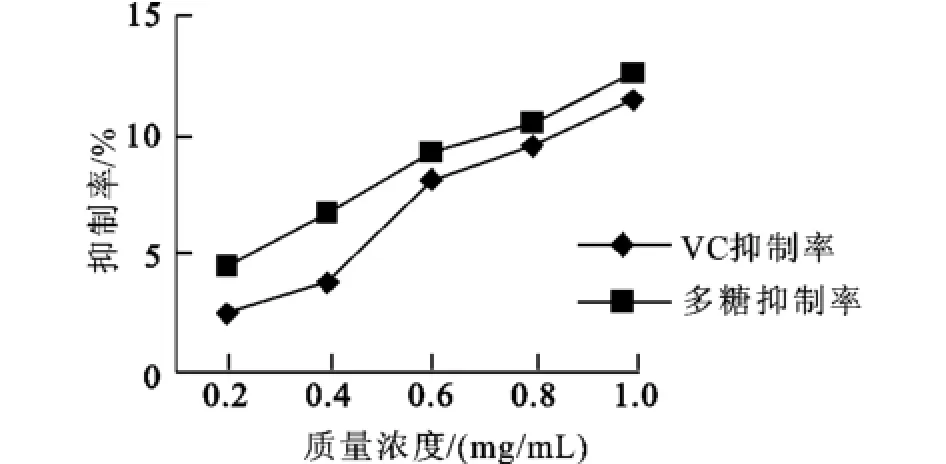
圖3 SPⅠ和VC清除超氧自由基的能力的比較Fig.3 The comparison of scavenging superoxide anion between SPⅠand VC
3 討 論
1)在提取藍莓粗多糖時,發現酶法和超聲波法輔助提取多糖比傳統的水浸法提取多糖得率都要高,并且工藝簡單,能耗比較低,是可以考慮的優化工藝。需要探索的地方在于,酶法和超聲波法相結合,是否可以更好地提高藍莓多糖的提取率,設定相關聯的條件,是兩者有機結合,有待進一步研究。
2)作者就藍莓多糖SPⅠ清除自由基能力進行測定,結果表明其具有一定得清除能力,需要進一步研究的是對經Sephacryl S-300柱層析所得的精多糖,測定其抗氧化能力是否有提高,抗腫瘤,抗病毒能力如何,也可對其進行化學修飾,引入其他官能團,測定是否提高其活性,以充分利用藍莓多糖資源。
4 結 語
1)除去花色苷的藍莓殘渣多糖含量與藍莓果中的多糖含量相差不大,所以從藍莓殘渣中提取多糖可以達到資源再利用的效果,減少資源浪費。
2)酶法提取多糖單向試驗和正交試驗的分析結果可以看出,酶的添加量對多糖得率的影響最為顯著,其次是酶解溫度和酶解時間,最佳酶解時間為100 min,酶解溫度為40℃,酶添加量為0.6%,藍莓多糖的得率為2.319%,此水浸提取法相比,溫度,時間都減少了很多,使得提取工藝簡潔,能量消耗減少,并且多糖得率有所提高,是一種良好的提取工藝。
3)超聲波提取多糖單向試驗和正交試驗的分析結果可以看出,超聲波功率(C)對多糖得率的影響最為顯著,其次是提取溫度(B)和提取時間(A)。根據正交試驗得到的最佳工藝條件為A2B2C3:即提取時間為40 min,提取溫度為50℃,超聲波功率為80 W,藍莓多糖的得率為2.335%,可以看出超聲波對藍莓多糖提取的影響比酶法更顯著,并且在資源和能耗方面也很簡單,適合用藍莓多糖的提取。
4)通過清除自由基試驗可以看出,SPⅠ具有一定的抗氧化活性,這為藍莓多糖生物活性的研究進一步研究提供了借鑒意義。
[1]李穎暢,孟憲軍.藍莓中花色苷的提取工藝[J].食品科技,2008,(20):74-76.
LI Ying-chang,MENG Xian-jun.Study on the processing of the extraction of anthocyanin from the fruit of blueberry[J]. Food Science and Technology,2008,(20):74-76.(in Chinese)
[2]聶飛,韋吉美,文光琴.藍莓的經濟價值以及其在我國產業化發展中的前景探討[J].貴州農業科學.2007,35(1):117-119.
Nie Fei,WEI Ji-mei,WEN Guang-qin.Discussion on economical values of vaccinium ssp.and its industrial development prospect in China[J].Guizhou Agricultural Sciences,2007,35(1):117-119.
[3]李穎暢,孟憲軍,張琦,等.藍莓中主要物質含量及處理方式對花色苷的影響[J].食品工業科技.2008,29(05):163-164.
LI Ying-chang,MENG Xian-jun,Zhang Qi,et al.Essential substance content of different blueberry and the effect of treatment on the blueberry anthocyanins[J].Science and Technology of Food Industry,2008,29(05):163-164.
[4]牛廣財.馬齒莧多糖及黃酮類化合物的研究[D].沈陽市:沈陽農業大學,2005.
[5]丁利君,吳倩萍.黃芪多糖的提取及其對自由基的清除作用[J].食品與機械.2003(4):7-9.
DINGLi-jun,WU Qian-ping.Extraction of polysaccharide from astragalus membranaceus and effects of scavenging free radicals[J].Food&Machinery,2003(4):7-9.
[6]周國華.黑木耳多糖酶法提取條件的研究[J].食品研究與開發,2005,26(3):89-91.
ZHOU Guo-hua.Studies on the extractive conditions of Auricularia Auricular polysaccharide in enzymatic methods[J]. Food Research and Development,2005,26(3):89-91.
[7]劉利萍,鐘引飛.海帶多糖的超聲波提取及對自由基清除作用研究[J].紹興文理學院學報.2005.29(7):49-51.
LIU Li-ping,ZHONG Yin-fei.Supersonic Extraction of laminaria and scavenging action to free radical[J].Journal of Shaoxinc University,2005.29(7):49-51.
[8]Yuan Z,He P,Takeuchi H,et al.Ameliorating effects of water-soluble polysaccharides from woody ear(Auricularia auricula—judae Que1)in genetically diabetic KK—Ay mice[J].J Nutr Sci Vitaminol(Tokyo),1998,44(6):829-840.
[9]Guihao Yin,Yuli Dang.Optimization of extraction technology of the Lycium barbarum polysaccharides by Box–Behnken statistical design[J].Carbohydrate Polymers,2008,74(3):603-610.
[10]Wentao Xu,Fangfang Zhang,YunBo Luo.Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J].Carbohydrate Research,2009,344(2):217-222.
[11]Cui J,Chisti Y.Polysaccharopeptides of Coriolus versicolor:physiological activity,uses,and production[J].Biotechnol Adv, 2003,21(2):109.
[12]Yongxu Sun,Jicheng Liu.Purification,structure and immunobiological activity of a water-soluble polysaccharide from the fruiting body of Pleurotus ostreatus[J].Bioresource Technology,2009,100(2):983-986.
[13]Filomena Freitas,Vitor D.Alves Characterization of an extracellular polysaccharide produced by a Pseudomonas strain grown on glycerol[J].Bioresource Technology,2009,100(2):859-865.
[14]You Lv,Xingbin Yang,Yan Zhao.Separation and quantification of component monosaccharides of the tea polysaccharides from Gynostemma pentaphyllum by HPLC with indirect UV detection[J].Food Chemistry,2009,11(3):742-746.
(責任編輯:朱明)
Extraction and Antioxidant Capability of Blueberry Polysaccharides
MEN G Xian-jun, SUN Xi-yun, ZHU Jin-yan, LI Bin, GAO Xiao-xun
(Shenyang Agriculture University,College of Food,Shenyang 110161,China)
Theextractiontechnologyofpolysaccharidesfromblueberryafterextracting anthocyanin by cellulase and ultrasonic was studied in this manuscript.Also,decolorizate rough polysccharides and remove protein,then through column chromatography,finally test the antioxidant capability of the refined polysccharides SP.the optimum conditions for process was determined by Orthogonal test experiment and listed as follows:time 100 min,temperature 40℃and enzyme additive 0.6%,the extraction percent 2.319%.In the extraction process by ultrasonic,the optimum conditions were:the extraction time 40min,temperature 50℃,power 80 W,the extraction percent 2.335%.Compared with that of the traditional extraction process by water,the process suggested in this manuscript has been proven easier manipulation and get higher extraction yield.Furthermore,the results also strong demonstrated that SPⅠhas stronger antioxidant activity.
blueberry,ploysaccharides,exraction,cellulase,ultrasonic,antioxidant capability
Q 949.91
:A
1673-1689(2010)01-0056-05
2009-03-10
遼寧省科技廳項目(1102-01082609001)。
孟憲軍(1960-),男,內蒙古赤峰人,教授,博士生導師,主要從事果蔬加工的教學與科研。Email: mengxjsy@126.com

