定量PCR研究細粒棘球蚴抗氧化相關基因的差異表達*
侯秋蓮,張富春,張文寶,吾拉木?馬木提,張壯志
2.新疆大學生命科學與技術學院新疆生物資源基因工程重點實驗室,烏魯木齊 830046;
3.新疆畜牧科學院獸醫研究所,烏魯木齊 830000
定量PCR研究細粒棘球蚴抗氧化相關基因的差異表達*
侯秋蓮1,張富春2,張文寶3,吾拉木?馬木提1,張壯志3
目的在已構建的氧化脅迫下細粒棘球蚴(Echinococcus granulosus)與正常組織差異表達的消減cDNA文庫中,篩選細粒棘球蚴在抗氧化過程中差異表達的重要基因。方法將前期研究中應用抑制性消減雜交技術(suppression subtractive hybridization,SSH)構建氧化脅迫下細粒棘球蚴差異表達基因的消減cDNA文庫進行藍白斑篩選和菌落PCR分析后測序分析。測序結果利用BLAST在線軟件與GenBank數據庫進行同源序列比對分析和BlastX分析。從文庫中隨機挑選4個未知新序列和抗氧化密切相關的TPx基因片段,利用定量PCR法研究氧化脅迫下,差異表達基因片段在mRNA水平上的變化情況。結果整個文庫克隆測序結果獲得重要基因的cDNA序列,如氧化還原酶、蛋白激酶、生長因子等。另有部分克隆在GenBank中無法查到對應的同源基因,可能代表了新基因。定量PCR結果顯示:S88、H32-1兩個基因在0.8 mmol/L H2O2氧化脅迫的原頭蚴中表達量分別上調為未經氧化脅迫原頭蚴中的2.0和2.3倍,TPx基因片段當H2O2濃度大于0.8 mmol/L時,其表達量增高。結論上述基因的上調表達很可能與細粒棘球蚴在抗氧化過程中的相關功能有密切的聯系,可以作為研究細粒棘球蚴抗氧化的候選基因。
細粒棘球蚴;氧化脅迫;抑制性消減雜交;熒光定量PCR;基因差異表達
2.新疆大學生命科學與技術學院新疆生物資源基因工程重點實驗室,烏魯木齊 830046;
3.新疆畜牧科學院獸醫研究所,烏魯木齊 830000
細粒棘球蚴(Echinococcus granulosus)是囊性包蟲病的病原體,棘球蚴以包囊形式在人和其它中間宿主的內臟器官中生長,在其早期發育階段,包囊自身和宿主的新陳代謝及對感染產生的免疫應答都會產生大量的不穩定的活性氧類物質(reactive oxygen species,ROS),ROS具有很高的反應性,能夠對蛋白、膜脂和DNA造成直接的損傷,產生嚴重的生物學效應,當在機體內大量堆積時可導致細胞、組織的死亡〔1-2〕。1998 年,Salinas等〔3〕發現:在體外培養條件下,細粒棘球蚴的幼蟲原頭蚴(PSC)階段可以代謝H2O2,而在其體內檢測不到過氧化氫酶和谷胱甘肽過氧化物酶的活性,因此推測細粒棘球蚴體內存在其它的抗氧化基因,保護機體免受氧化損傷過程中起著關鍵的作用,其對于棘球蚴在人和其它中間宿主內臟器官中存活是十分必要的。
在前期研究中〔4〕,構建了氧化脅迫下細粒棘球蚴與正常組織差異表達的消減cDNA文庫,本研究應用real-time PCR技術,進一步對細粒棘球蚴在氧化脅迫下基因的mRNA水平差異表達進行研究,探究細粒棘球蚴在氧化誘導過程中相關靶基因的表達變化及其功能。
1 材料與方法
1.1 材 料
1.1.1 標本來源 從新疆烏魯木齊市屠宰場新鮮采集自然感染細粒棘球蚴的綿羊肝臟,立即帶回實驗室,清潔臟器表面。在無菌條件下,用吸管吸取原頭蚴,將其置于含有青鏈霉素的無菌PBS液中(pH 7.3),洗3次,離心后將沉淀加入1%pepsin(pH 3.0)中,于37℃消化30 min后,用吸管反復抽吸以破壞囊膜,使原頭蚴從育囊中散出,同時用無菌PBS液漂洗3次除去育囊碎片,倒置顯微鏡下檢查其活性,用含有10%牛血清的DMEM培養基無菌培養于37℃、5%CO2的細胞培養箱。培養24 h的原頭蚴用于實驗。
1.1.2 主要試劑 DMEM培養基(High Glucose)購自美國Gibco公司;T rizol試劑購自美國Invitrogen公司;標準胎牛血清FBS 、T4DNA 連接酶 、pMD18-T 載體 、DNA Marker、X-Gal、ExTaqDNA聚合酶均購自大連寶生物工程有限公司;PCR產物純化試劑盒購自北京百泰克生物公司;DH5α大腸桿菌為本室保存;DNaseⅠ、逆轉錄試劑盒PrimeScriptTMRT reagentKit(TaKaRaCode:DRR037S)、熒光定量 PCR 試劑盒 SYBR○RPremix Ex TaqTM(Perfect Real Time)(TaKaRa Code:DRR041S)購自 TaKaRa公司;熒光定量PCR采用德國 Roche公司的 Lightcycler 1.5型熒光定量PCR儀,以及該公司生產的Real time PCR專用加樣毛細管;其他試劑為國產分析純產品。
1.2 方法
1.2.1 消減cDNA文庫構建 見文獻4。
1.2.2 消減cDNA文庫的鑒定、測序與序列分析各取SSH文庫中1μ L菌液作為PCR擴增模板,以pMD18-T載體多克隆位點兩端通用引物進行菌落PCR擴增,證明含有插入片段后(200-1 000 bp),將整個文庫送天根生化科技(北京)有限公司進行測序。將測序結果去除載體和引物序列以后,利用BLAST在線軟件與GenBank數據庫進行同源序列比對分析和BlastX分析。
1.2.3 差異表達基因的實時熒光定量PCR 根據測序分析結果,從文庫中隨機挑選4個未知新序列和抗氧化密切相關的TPx基因片段,設計定量PCR引物(表1),以ActinⅠ基因為參照標準進行定量分析。原頭蚴進行不同H2O2濃度(0,0.8,1.6,2.4 mmol/L)的氧化脅迫處理24 h,總RNA的抽提采用 Trlzol試劑,用 RNase Free DNaseⅠ處理總RNA,以除去總RNA的DNA。
1.2.4 逆轉錄反應 采用TaKaRa公司的Prime-ScriptTMRT reagent Kit。反應體系為:模板2 μ L,5×PrimeScript緩沖液4 μ L,PrimeScript酶混合物1 μ L,Oligo dT 和 Random 6 mers 引物各 1 μ L,加RNase Free dH2O至總體系為20μ L。
1.2.5 Real time PCR反應 取相同量的逆轉錄產物進行PCR反應,real-time PCR反應采用TaKaRa公司的SYBR?Premix Ex TaqTM(Perfect Real Time),按照說明書在冰上配制PCR反應液,每個樣品重復3次。反應結束后確認 real-time PCR反應的擴增曲線和融解曲線。

表1 定量RT-PCR所用的基因特異性引物Table 1 Gene specific primers for quantitative RT-PCR
1.3 定量PCR數據處理 利用實時定量PCR分析基因在不同組織中的表達差異,目前常用的是相對定量法 ,多采用 2–ΔΔCt法〔5〕,確定特定熒光域值對應循環數的Ct值,對目標基因定量。
2 結 果
2.1 cDNA測序與序列分析初步結果 將消減cDNA文庫送至北京天根公司,進行全文庫單向測序掃描。根據GenBank數據庫,將測序結果進行同源序列比對和BlastX分析,部分結果列于表2中。發現文庫中有7個EST s序列在數據庫中找不到同源片段,這7個EST可能代表了新基因。另有部分基因功能與氧化還原關系密切,如SSH-18、SSH-90等。
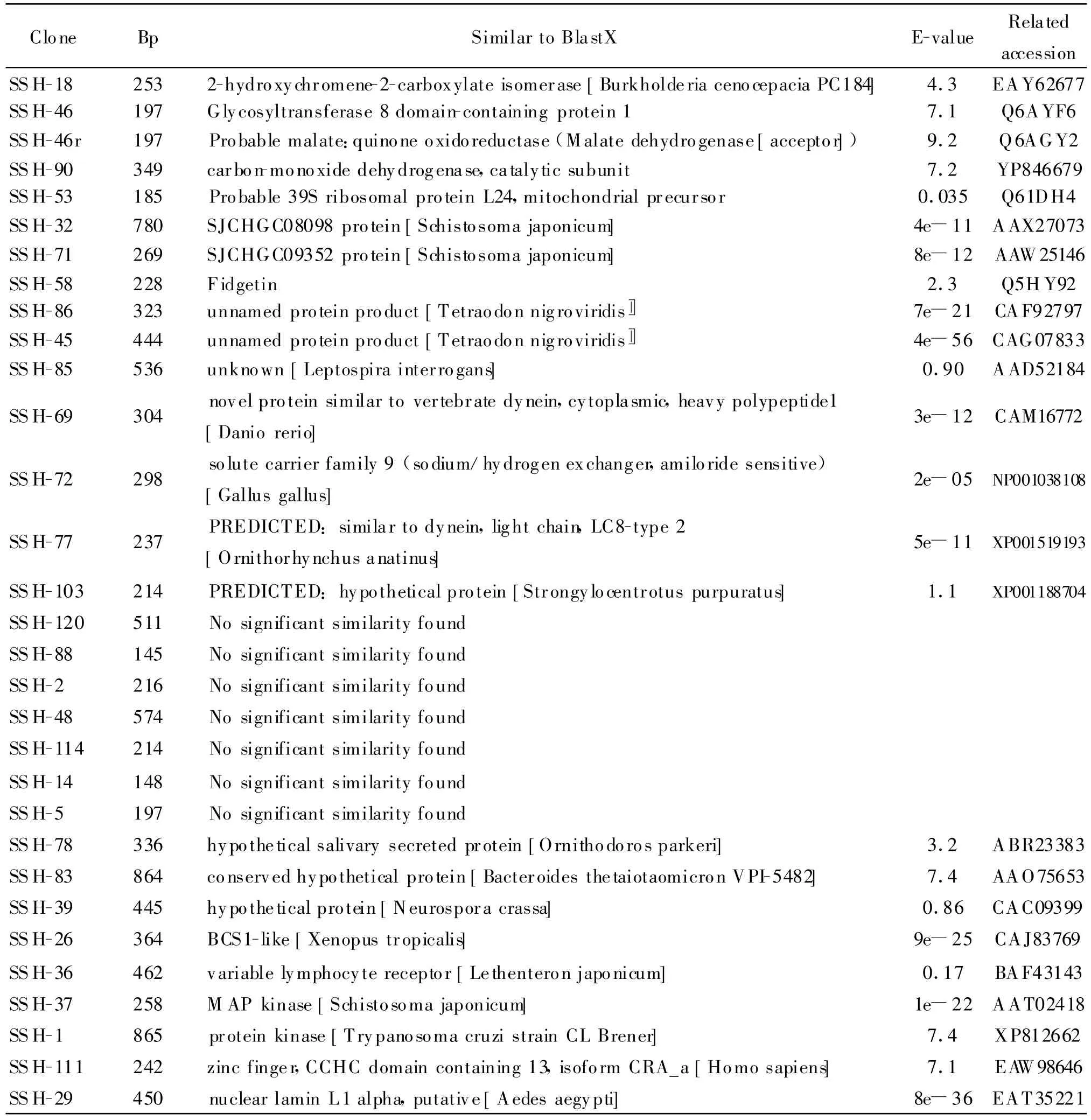
表2 部分陽性克隆BlastX分析結果Table 2 BlastXanalysis of the partialy clones
2.2 差異表達基因的實時熒光定量PCR分析 為了更準確地鑒定SSH文庫中差異表達基因的可靠性,采用實時熒光定量PCR分析了5個EST在原頭蚴經H2O2氧化脅迫處理和未處理對照中的差異表達情況,其中TPx為抗氧化基因家族中的一員,其余為功能未知基因。圖1是對這些差異表達基因3個重復樣品的解鏈曲線分析。從圖中可以看出,隨著溫度的升高,與雙鏈DNA結合的熒光染料SYBR GreenⅠ逐漸被釋放,曲線均無雜峰出現,說明實驗過程中無樣品污染和引物二聚體,擴增產物單一,確定為特定的片段。
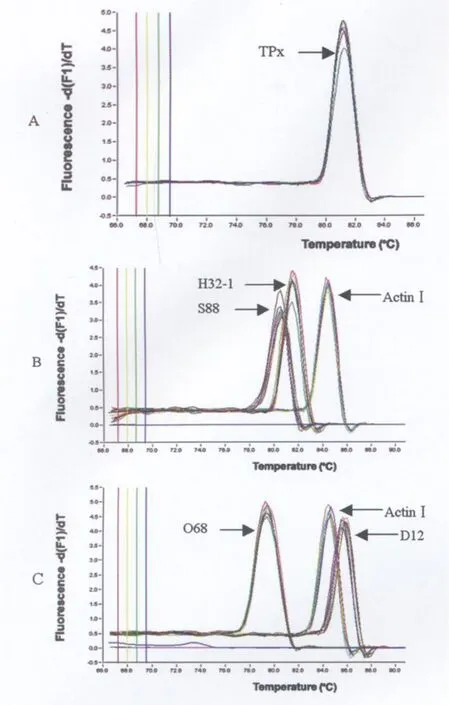
圖1 部分差異表達EST的融解曲線分析Fig.1 Melting curve analysis of differential expressed ESTs A:Differential expressed EST of TPx;B:Differential expressed EST of S88 and H32-1;C:Differential expressed EST of O68 and D12.
2.3 差異表達基因的數據整理 目標基因與內對照基因(ActinⅠ)Ct值的差值(△Ct)列于表3、表4中。S88、H32-1兩個基因在0.8 mmol/L H2O2氧化脅迫的原頭蚴中表達量分別達到了未經氧化脅迫原頭蚴中的2.0和 2.3倍,在2.4 mmol/L H2O2氧化脅迫的原頭蚴中,這兩個基因的表達量分別達到了未經氧化脅迫原頭蚴中的8.0和6.1倍。

表3 S88基因相對表達分析Table 3 The fold change in expression of the S88 gene relativeto the internal control gene(ActinⅠ)
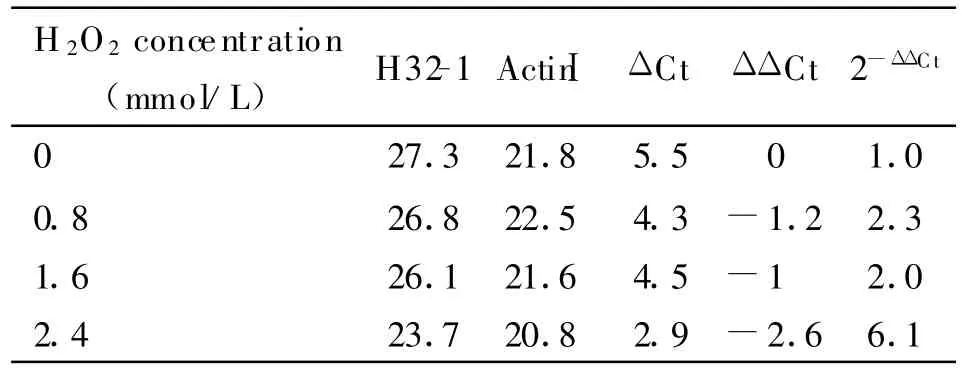
表4 H32-1基因相對表達分析Table 4 The fold change in expression of the H32-1 gene relative to the internal control gene(ActinⅠ)
3 討 論
逆境壓力會刺激細胞產生氧化自由基,過量的氧化自由基卻會導致細胞走向凋亡〔6〕。當機體處于應激條件時,體內ROS產生增加,體內的抗氧化系統作用增強〔7〕。
基因的表達量基因定量過氧化氫作為細胞內信號分子,它可以與信號通路中蛋白質的巰基反應,使之活化或失活,參與信號轉導。在哺乳類動物,胞間氧化還原狀態與細胞分化、免疫應答、生長控制、腫瘤發生和細胞凋亡都有著密切聯系〔8-9〕。囊型包蟲病呈世界性分布,其流行已成為全球性的公共衛生問題〔10-11〕。寄生蟲通過合成抗氧化酶并大多在宿主—寄生蟲的接觸面表達以適應及抵抗氧化脅迫的壓力〔12-13〕。抗氧化酶在保護寄生蟲抵御來自宿主新陳代謝和白細胞激活的ROS的氧化損傷起關鍵作用〔14〕,提示細粒棘球蚴具有抵抗氧化的機制。
在前期研究中〔4〕,對SSH技術在寄生蟲研究領域的應用進行了嘗試,構建了H2O2脅迫PSC與正常組織差異表達的消減cDNA文庫。本研究進一步對實驗分離克隆到一些重要基因的cDNA序列進行分析,這些基因編碼的產物功能可以大致分為兩類:第一類是功能蛋白類,在細胞內可直接發揮保護功能,如氧化還原酶。第二類是調控蛋白類,在各種脅迫反應的信號轉導或基因表達中起調節作用,間接起保護作用,如蛋白激酶、生長因子等。蛋白激酶在脅迫信號感應和轉導中有重要作用〔15〕。另有部分克隆在GenBank中無法查到對應的同源基因,這些可能代表了新基因。
Real-time PCR檢測結果發現,本研究所構建的 SSH 文庫中 ,S88、H32-1 、TPx 、D12、O68 、I36、P72、I39、F21、H32-2 基因都是受 H2O2誘導的,而且隨著H2O2濃度不同,其表達量也有變化。當H2 O2濃度為2.4 mmol/L時,表達量為最高,說明隨著H2O2濃度的升高,該部分基因的表達可以持續增強。其中,S88、H32-1基因的表達變化量分別為未經H2O2處理對照的8.0倍和6.1倍。由此說明所構建的SSH文庫有效地富集了原頭蚴經氧化脅迫特異表達的基因,可以進一步通過反向雜交手段篩選影響原頭蚴抗氧化功能的主效基因。推測,S88和H32-1等幾個新EST表達量的提高與原頭蚴的抗氧化功能密切相關,可以進一步把它們作為原頭蚴抗氧化的候選基因來進行更深層次功能的研究。而對于TPx基因表達變化差異,在經過H2O2濃度為0.8 mmol/L處理時,其表達量表現有下降,當H2O2濃度增高大于0.8 mmol/L時,其表達量又增高。Real-time PCR檢測TPx表達量在經過H2O2濃度為0.8 mmol/L處理后和對照組表達差異不大,其原因如何,還需要進一步探討。
〔1〕Halliwell B,Gutterridge JMC.Production against radical damage:wystems with problems.free radicals in biology and medicine〔M〕.2nd ed.Ox ford:Clarendon Press,1989.
〔2〕Li J,Zhang W.B,Loukas A,et al.Functional expression and characterization ofEchinococcus granulosusthioredoxin peroxidase suggests a role in protection against oxidative damage〔J〕.Gene,2004,326:157-165.
〔3〕Salinas G,Fernandez V,Fernandez C,et al.Echinococcus granulosus:cloning of a thioredoxin peroxidase〔J〕.Exp Parasitol,1998,90(3):298-301.
〔4〕侯秋蓮,王慧,張壯志,等.應用SSH 技術研究H2O2脅迫下細粒棘球蚴基因的表達〔J〕.中國人獸共患病學報,2008,24(1):17-21.
〔5〕Kenneth J,Livak,Thomas DS.Analysis of Relative Gene expression data using real time quantitative PCR and the 2–ΔΔCtMethod 〔J〕.Methods,2001,25:402-408.
〔6〕Kim H,Lee TH,Park ES,et al.Role of peroxiredoxins in regulating intracellular hydrogen peroxide and hydrogen peroxide-induced apoptosis in thy roid cells〔J〕.Biol Chem,2000,275(24):18266-18270.
〔7〕Patenaude A,Ven Murthy MR,Mirault ME.Mitochondrial thioredoxin system:effects of T rxR2 overexpression on redox balance,cell growth,and apoptosis〔J〕.J Biol Chem,2004,279(26):27302-27314.
〔8〕Rabilloud T,Berthier R,Vincon M.Early events in erythroid differentiation:accumulation of the acidic peroxidoxin(PRP/TSA/NKEF-B)〔J〕.Biochem J,1995,312(Pt 3):699-705.
〔9〕Butterfield LH,Merino A,Golub SH,et al.From cytoprotection to tumor suppression:the multifactorial role of peroxiredoxins〔J〕.Antioxid Redox Signal,1999,1(4):385-402.
〔10〕Thompson RCA.The biology ofEchinococcusand hydatid disease〔M〕.London:George Allen and U nwin Press,1995:232-305.
〔11〕Ammann RW,Echert J.Cestodes:Echinococcus〔J〕.Gastroenterol Clin Nor Am,1996,25(3):655-689.
〔12〕Cookson E,Blax ter M L,Selkirk ME.Identification of the major soluble cuticularg lycoprotein of lymphatic filarial nematode parasites(gp29)as a secretory homologue of glutathione peroxidase〔J〕.PNAS,1992,89(13):5837-5841.
〔13〕James E.Superoxide dismutase〔J〕.Parasitology Today,1994,10(12):481-484.
〔14〕Callahan HL,Crouch RK,James ER.Helminth antioxidant enzymes:A protective mechanism against host oxidants?〔J〕.Parasitology Today,1988,4(8):218-225.
〔15〕Stone JM,Walker JC.Plant protein kinase families and signal transduction〔J〕.Plant Phy siol,1995,108:451-457.
The differential expression of the anti-oxidation related genes inEchinococcus granulosusby real-time PCR
HOU Qiu-lian,ZHANG Fu-chun,ZHANG Wen-bao,MAMUTI Wulamu,ZHNAG Zhuang-zhi
(Basic Medicine College of Xinjiang Medical University,Urumqi830054,China)
To isolate the specific genes in protoscoleses(PSC)ofEchinococcusgranulosusunder oxidative stresses from the SSH library constructed in the previous study,the gene expression in PSC under oxidative stresses was studied by using real-time PCR.The previously amplified library was sequenced and analyzed in GenBank with Blast research.Sequence analysis indicated that all clones in the SSH library contained the coding sequences,of which some clones showed homology in the Gen-Bank and others were unknown.Differential expression of 4 genes randomly selected and the TPx gene in this library were studied with real-time PCR.It was demonstrated that the gene expression of S88 and H32-1 in oxidative tissues was 2.0 and 2.3 times higher than the un-oxidative stresses respectively.The TPx gene was up-regulated when PSC was induced with H2H2of more than 0.8 mmol/L.These results implies that the up-regulated expression of the above-mentioned genes may be related with the related functions of anti-oxidative process in PSC and they may be used as the candidate genes for the study of anti-oxidation ofE.granulosus.
Echinococcusgranulosus;oxidative stress;suppression subtractive hybridization;real-time PCR;dfferentially expressed gene
R383.33
A
1002-2694(2010)01-0001-05
*美國國立衛生研究院 R03基金資助項目(No.R03AI063367-01),國家自然科學基金項目(30760229),新疆教育廳創新群體資助項目(No.XJEDU2004G02)
吾拉木?馬木提,Email:mwulamu@hotmail.com
1.新疆醫科大學基礎醫學院病原學教研室,烏魯木齊830054;
2009-04-30;
2009-11-22

