骨橋蛋白反義寡核苷酸對微缺氧下人結腸癌細胞HT-29增殖活性及侵襲力的影響
楊慶強,唐春燕
(瀘州醫學院:1.附屬醫院普外科;2.護理學院衛校,四川 646000)
在適度缺氧的應激下,腫瘤細胞的起始因子-2α被磷酸化,大多數蛋白質的翻譯被抑制,另一方面,特定的缺氧誘導蛋白合成增加,由此基因表達和表型出現轉變,腫瘤細胞的生物學行為發生改變,該反應受缺氧程度及時間的影響[1]。作者在前期的研究中將培養液PO220 mm Hg作為微缺氧環境,檢測到在微缺氧下H T-29細胞骨橋蛋白(OPN)特異性的表達上調,且HT-29細胞異質性黏附能力、侵襲游走能力顯著增強,MMP-2/9活性上調而向惡性表型轉化。反義寡核苷酸(antisense oligonucleotide,ASODN)是能與目標mRNA互補的DNA片段。應用ASODN阻斷特定基因的表達,研究基因的功能已經成為可能。本實驗將靶向OPN ASODN轉染至微缺氧下高表達OPN的HT-29細胞,試圖特異性地封閉OPN m RNA,以進一步探討OPN在微缺氧誘導的惡性轉化中的作用。
1 材料與方法
1.1 材料 Lipofectamine 2000(invitrogen公司,Santa Cruz Biotechnology),RT-PCR試劑盒(杭州博日公司),明膠(Sigma),matrigel基底膜基質(BD Bioscience),含 4.8%O2、90.2%N2和5%CO2三元混合氣體,自行設計的缺氧培養裝置等。
1.2 細胞培養 HT-29細胞在含10%胎牛血清的RPMI-1640培養液中貼壁生長,以0.1%胰酶傳代。在前期的實驗中,作者用溶解氧測定儀實時監測,已摸索出持續低流量灌注4.8%O2,培養液氧分壓恒定于20 mm Hg。缺氧條件參照文獻[2],并稍作改進。
1.3 ASODN的設計 在Genbank查詢OPN基因序列NM_000582,參照文獻[3]設計并合成了由20個堿基組成的正義、反義、錯義寡核苷酸(missense oligonucleotide,MODN)。各自序列如下:ASODN 序列為 5′-CTA ACT TAA AAA ACA AAA GA-3′。正義寡核苷酸(sense oligonucleotide,SODN)序列為 5′-TCT T TT GT T TTT TAA GT T AG-3′。 MODN 序列為 5′-AGT TGC GGA AAT GAG TG-3′。
1.4 ASODN的轉染 將處于對數生長期的HT-29細胞制成濃度為1×105個/m L的細胞懸液,每孔2 m L接種于 6孔培養板,待細胞增殖至60%~70%融合時,吸棄培養液,每孔加入lm L含10μL/m L ODN及終濃度為10μL/m L脂質體的轉染液,于37℃、5%CO2及飽和濕度的培養箱中培養6 h。去除轉染液,加入2 m L 10%FBS/RPMI-1640培養液,繼續培養18 h。根據實驗所需,將細胞進行微缺氧培養用于后續實驗。
1.5 RT-PCR分析 實驗分組:微缺氧空白組、脂質體對照組、SODN組、MODN組、ASODN組。各 ODN組均以 10 μmol/L轉染H T-29細胞,轉染24 h后再微缺氧培養24 h。各組細胞均用0.1%胰酶消化,制成細胞懸液并行細胞計數,每個樣本收集等量細胞2×106,用T RNzol試劑抽提總 RNA,步驟按說明書進行。在genbank查詢OPN基因序列NM_000582,用primer5.0軟件自行設計引物序列,上游引物為5′-ACC CTT CCA AGT AAG TCC AAC-3′;下游引物為 5′-GGT GAT GTC C TC GTC TGT AGC-3′,預計擴增片斷為354 bp。內參 β-actin的上 游引物為 5′-TTG TAA CAA ACT GGG ACG ATA TGG-3′;下 游引 物為 5′-GAT CT T GAT CT T CAT GGT GCT AG-3′,預計擴增片斷為764 bp。用逆轉錄酶和oligo-d T等按 42℃60 min,70℃10 min條件進行cDNA的合成。取逆轉錄產物5μL、10×RT-PCR Buffer 5μL,MgCl23μL,d NTP Mixture 1μL,上、下游引物各 1μL 及 Taq mix DNA polymerase 0.5μL加入無菌雙蒸水至反應總體積為50μL。反應條件為:94℃變性3 min;94℃變性45 s,53℃退火復性45 s,72℃延伸 45 s,共 32個循環后再72℃延伸 5 min。反應體系以β-actin作為內參照。PC R產物用含溴化乙啶的1.5%瓊脂糖凝膠電泳,凝膠在Bio-Rad的UⅥ圖像處理系統上分析、計算,得出OPN、β-actin的光密度,以β-actin的光密度為參照物,求出OPN光密度與之相比的相對值,得到OPN m RNA表達的半定量結果。
1.6 Western blot分析 將細胞質蛋白進行10%SDS-聚丙烯酰胺凝膠電泳分離,電轉移至PVDF膜,用5%脫脂奶粉室溫封閉1 h,加入1∶400稀釋的羊抗人骨橋蛋白多克隆抗體,4℃過夜,β-actin作內參照。TBS T洗膜3次,10 min/次,加入1∶1000稀釋的辣根酶標記兔抗山羊Ig G,37℃1 h,同樣洗膜3次,膜上均勻滴加ECL發光試劑,在Bio-Rad圖像處理系統Hisensitivity模式下連續曝光顯影,對蛋白條帶進行灰度相對強度測定,得出積分灰度值,以積分值代表蛋白的表達量。
1.7 M TT檢測HT-29細胞的增殖活性 收集對數生長期HT-29細胞,胰酶消化制成5×104/m L細胞懸液,以 200μL/孔接種于96孔板,常氧下、37℃、5%CO2培養24 h待細胞貼壁。各組細胞微缺氧培養 6、12、24、48 h。同時設不加細胞的背景對照,每組設8個復孔,實驗重復3次。到達預設時限點時,每孔加入(5 mg/m L)M TT溶液20μL,37℃孵育4 h。棄舊液,每孔加入150μL DMSO,37℃,水平振蕩5 min,用酶聯免疫檢測儀于波長570 nm處測定各孔吸光度(A 570)。扣除背景對照的A 570值即代表存活細胞數量。制作細胞生長曲線,計算細胞抑制率(IR)。IR=(微缺氧空白組 A570-實驗組A570)/微缺氧空白組A 570×100%。
1.8 細胞黏附力檢測 用無血清RPMI-16401∶3稀釋matrigel,以20μL/孔加入96孔培養板,成膠后紫外光消毒滅菌后備用,接種細胞前水化基底膜。取對數生長期 HT-29細胞配成濃度為1×105/m L的細胞懸液,各組均取4 m L接種于培養瓶。微缺氧下培養48 h后,取出各組細胞,用0.1%胰酶消化,調整細胞密度為 5×105/m L,每孔200μL接種于 96孔培養板常規培養。每組細胞均設對照,并分為30、60、90、120 min時段組,每時段組設8個平行孔。于各時段點吸棄培養液及懸浮細胞,PBS沖洗除去未黏附的腫瘤細胞,棄PBS加入 200μL無血清RPMI-1640、20μL MT T培養4 h,吸棄培養上清液,加入二甲亞砜(DMSO)200μL,用酶聯免疫檢測儀于波長570 nm處測定各孔吸光度(A 570)。細胞黏附率=實驗組A570值/對照組 A570值×100%。
1.9 明膠酶譜分析 待測細胞常規消化后,以106個細胞/孔、10%FBS/RPMI-1640接種到6孔板內過夜培養。次日用0.01 mmol/LPBS(p H7.4)洗滌后,各組細胞用無血清RPMI-1640分別在微缺氧下培養24 h,收集其上清液,實驗方法參照文獻[4]:上清液與 4×上樣緩沖液(62.5 m M Tris-Hcl、p H6.8,10%甘油,2%SDS,0.1%溴酚藍)按照1∶3混合,上樣后在1.5%明膠/8%聚丙烯酰胺凝膠、80 V 20 min、100 V 2 h衡壓電泳。凝膠分別用洗脫液(2.5%T ritonX-100)、孵育液37℃、24 h(50 m M Tris-HCl、p H7.5 ,0.2 M NaCl,5 m M CaCl2,0.02%Triton X-100),染色緩沖液(0.4%考馬斯亮藍 R-250,10%冰醋酸,20%甲醇)和脫色緩沖液(10%冰醋酸,20%甲醇)至顯現出明顯的蛋白負染條帶。用Bio-Rad的圖像處理系統對負染條帶進行掃描并定量分析,負染條帶的大小、亮度反映MMP-2/9的活性。
1.10 統計學處理 用SAS9.0統計軟件分析。計量資料以表示,采用方差分析或 t檢驗。
2 結 果
2.1 OPN m RNA表達 RT-PCR結果顯示,各組均分別在354、764 bp處出現特異性的 OPN基因條帶和內參照β-actin條帶。OPN ASODN轉染HT-29細胞24 h后,再微缺氧培養24 h,其OPN m RNA的表達較微缺氧空白組、脂質體對照組、SODN組、MODN組下調68.5%(P<0.01),而各對照組間差異無統計學意義(P>0.05),見圖1。
2.2 OPN蛋白表達 ASODN組OPN蛋白表達較各對照組均明顯下調(P<0.01),表達量是對照組的35.4%,而各對照組間差異無統計學意義(P>0.05),見圖2。
2.3 OPN ASODN對微缺氧下HT-29細胞增殖的影響MTT結果顯示,微缺氧下不同時限點的吸光度值(A 570)及生長抑制率(IR)在各對照組間差異無統計學意義(P>0.05);而ASODN組的A 570值及IR與各對照組比較,差異有統計學意義(P<0.01),IR為(41.6±1.2)%,各組的生長曲線見圖3。
2.4 OPN ASODN對微缺氧后HT-29細胞黏附力的影響與微缺氧空白組、脂質體對照組、SODN組、MODN組比較,ASODN組HT-29細胞在各時限點的黏附率均明顯下降(P<0.01),而各對照組間的差異無統計學意義(P>0.05),各組細胞在不同時限點的黏附曲線見圖4。
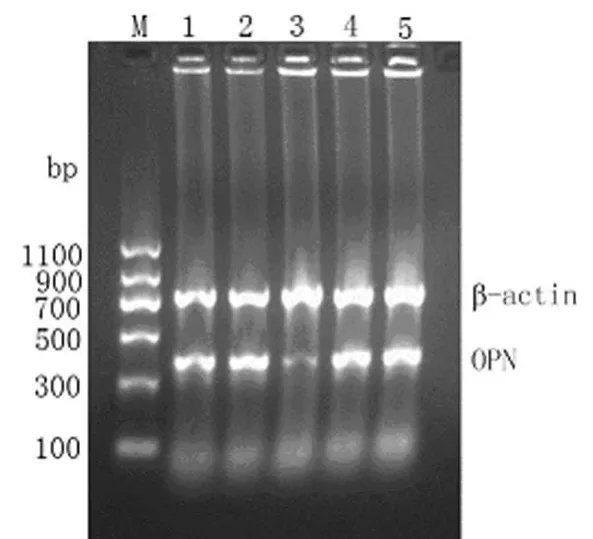
圖1 RT-PCR檢測OPN ASODN對微缺氧下HT-29細胞OPN m RNA表達的影響
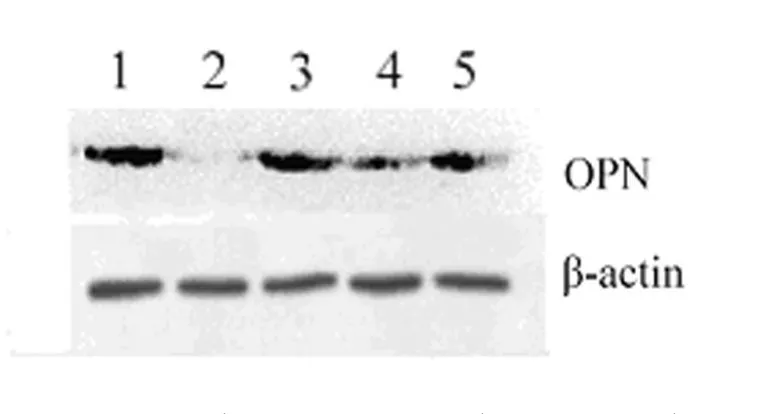
圖2 Western blot檢測OPN ASODN對微缺氧下HT-29細胞OPN蛋白表達的影響
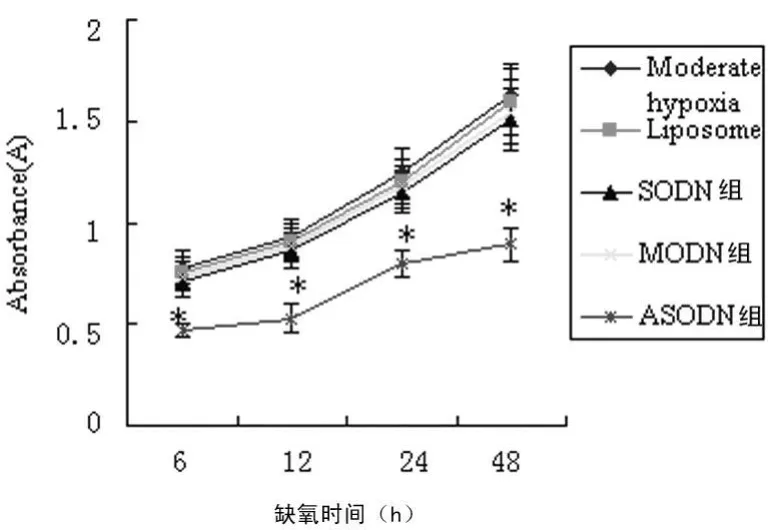
圖3 微缺氧下ASODN組與各對照組HT-29細胞的生長曲線
2.5 MMP-2/9活性 明膠酶譜分析呈現相對分子質量為66/72 k D的MM P-2及其前體、92 k D的MMP-9溶解明膠后的負染條帶,尤以前者為著。與各對照組比較,ASODN組HT-29細胞分泌的MMP-2/9活性下調71%(P<0.01),而各對照組間差異無統計學意義(P>0.05),見圖 5。

圖4 微缺氧后ASODN組與對照組HT-29細胞的黏附曲線

圖5 微缺氧下ASODN組與各對照組的明膠酶譜
3 討 論
腫瘤組織的氧分壓為0~20 mm Hg,而正常組織則為 40 mm Hg以上,缺氧乃實體腫瘤物理微環境的基本特征[5]。適度缺氧可能是腫瘤細胞發生遺傳不穩定、惡性轉化甚至轉移的始動因素,缺氧介導腫瘤細胞惡性篩選,對凋亡不敏感的、在缺氧環境下生存下來的細胞更富有侵襲性和對放、化療的抗拒性[6]。作者在前期的研究中將培養液PO220 mm Hg作為微缺氧環境,檢測到H T-29細胞在微缺氧下OPN特異性的表達上調,且HT-29細胞異質性黏附能力、侵襲游走能力顯著增強,MM P-2/9活性上調而向惡性表型轉化[7]。
在設計ASODN的軟件中,Mfold軟件可以識別基因序列中呈環狀或發夾狀的區域,選擇單直鏈的區域作為靶點,由其設計的ASODN更容易與目的基因結合,基因的抑制效率更高。Adw an等[3]使用該軟件,設計合成了10條靶向OPN的ASODN,并篩選出最有效率的 1條,該條 ASODN可以使OPN蛋白表達下調84%。作者參照Adwan設計的此條序列,合成ASODN,并參照其濃度用Lipofectamine將其轉染入微缺氧下高表達OPN的HT-29細胞,用RT-PCR和Western Blot分析,結果顯示 ASODN組OPN m RNA、蛋白表達較各對照組分別下調68.5%和64.6%。表明靶向OPN的ASODN能特異、有效地抑制微缺氧下H T-29細胞OPN m RNA和蛋白的表達。OPN在多種腫瘤組織中高表達,它可增強腫瘤細胞與基質的異質性黏附,促進其移行,并通過與整合素受體、CD44受體結合而參與信號轉導,使腫瘤細胞無限制增殖,被認為是惡性轉化的分泌性蛋白[8]。
Liu等[9]報道骨肉瘤(OS)中過度表達的OPN可上調細胞周期調節蛋白A(Cyclin A)的表達,進而加速細胞分裂周期,促進OS細胞的增殖。Muramatsu等[10]將OPN的反義寡核苷酸(AS)轉染至高表達OPN的口腔腫瘤細胞株BSF-OF,AS組的腫瘤細胞生長速度較對照組明顯減慢,腫瘤細胞的侵襲能力也顯著降低。本實驗表明,ASODN組HT-29細胞轉染OPN ASODN后,隨著OPN的下調,其A 570值明顯低于各對照組,微缺氧下的高增殖活性受到明顯抑制,IR達(41.6±1.2)%。表明靶向OPN的ASODN對微缺氧下HT-29細胞的增殖有明顯的抑制作用,同時也提示微缺氧誘導的HT-29細胞高增殖活性與OPN的上調密切相關。
腫瘤細胞的遠處轉移是一個主動的過程,在進入和離開轉移通道時都需要腫瘤細胞具備選擇性黏附和主動移行的能力。當OPN的RGD序列與整合素受體αvβ3或CD44突變體識別結合后,可增強腫瘤細胞的黏附和遷移能力[11]。Moye等[12]將乳腺良性細胞株Rma通過轉染使其表達OPN,發現細胞的黏附力和遷移能力顯著增加,而且該細胞株可在大鼠體內形成轉移灶。丁凌和鄭樹[13]分別構建OPN反義和正義真核表達質粒,將其轉染入大腸癌細胞株Colo205和SW480。在高表達OPN的大腸癌細胞CD44的表達也上調,E-cadherin的表達則減弱。由此表明,細胞間同質黏附減弱,與ECV304細胞之間的異質黏附增強。本實驗用反義寡核苷酸技術,特異性地封閉微缺氧誘導的OPN,結果顯示,隨著OPN的下調,微缺氧誘導的高異質性黏附力也明顯降低。表明OPN參與了腫瘤細胞與基質膜基質之間的異質性黏附,靶向OPN的ASODN能顯著下調OPN的表達,從而減弱微缺氧誘導的HT-29細胞的異質性黏附力。
MMP-2/9活性的高低是評估腫瘤侵襲性的重要指標[14]。ASODN組HT-29細胞轉染OPN ASODN后,隨著OPN的下調,其分泌的M MP-2/9活性下調了71%,表明靶向OPN的ASODN能顯著下調微缺氧下HT-29細胞分泌的MMP-2/9活性。實驗結果還提示,在微缺氧下MMP-2/9是OPN的下游效應因子。但MM P-2/9沒有OPN的調控點,并不直接受OPN的調控,兩者之間可能還存在某種因子介導。
作者參照Adw an合成靶向OPN的ASODN,用陽性脂質體為載體,將其轉染至高表達OPN的微缺氧HT-29細胞,發現靶向OPN的ASODN可明顯抑制微缺氧誘導的OPN m RNA和蛋白表達,并顯著拮抗微缺氧誘導的細胞增殖、異質性黏附,阻抑OPN的表達,MMP-2/9的活性也隨之下調,表明OPN在微缺氧促進腫瘤向惡性表型轉化中起著重要作用。
[1]Koumenis C ,Wouters BG.“ T ranslating” tumor hypoxia:unfolded protein response(UPR)-dependent and UPR-independent pathways[J].Mol Caner Res,2006 ,4(7):423.
[2]Fukuda R,Hirota K,Fan F,et al.Insulin-like grow th factor linduces hypoxia-inducible factor 1-mediated vascular endothelial grow th factor expression,which is dependent on MAP kinase and phosphatidylinositol 3-kinase signaling in colon cancer cells[J].J Biol Chem,2002,277:38205.
[3]Adwan H ,Bauerle TJ,Berger M R.Downregulation of osteopontin and bone sialoproteinⅡis related to reduced colony formation and metastasis formation of MDA-MB-231 human breast cancer cells[J].Cancer Gene Ther,2004,11:109.
[4]Paul F,Ziprin P ,Alkhamesi N ,et al.Hypoxia Augments Gelatinase Activity in a Variety of Adenocarcinomas in Vitro[J].J Surg Res,2005,124(2):180.
[5]Semensa GL.Targeting HIF-1 for cancer therapy[J].Nat Rev Cancer,2003 ,3(10):721.
[6]Le QT ,Denko NC,Giacca AJ.Hypoxic gene expression and metastasis[J].Cancer Metastasis Rev ,2004 ,23:293.
[7]楊慶強,張才全.微缺氧對人結腸癌細胞HT-29骨橋蛋白及核轉錄因子表達及其侵襲能力的影響[J].中華實驗外科雜志,2007,24(11):1353.
[8]Rodrigues LR,Teixeira JA ,Schmitt FL ,et al.The role of osteopontin in tumor progression and metastasis in breast cancer[J].Cancer Epidemiol Biomarkers Prev,2007,16(6):1087.
[9]Liu SJ,Hu GF,Liu YJ,et al.Effectof human osteopontin on proliferation,transmigration and expression of MMP-2 and MMP-9 in osteosarcoma cells[J].Chin Med J(Engl),2004 ,117(2):235.
[10]Muramatsu T ,Shima K ,Oh ta K ,et al.Inhibition of osteopontin expression and function in oral cancer celllines by antisense oligonucleotide[J].Cancer Lett,2005,217(1):87.
[11]Nemoto H,Rittling SR,Yoshitake H ,et al.Osteopontin deficiency reduce experimental tumor cell metastasis to bone and soft tissues[J].J Bone Miner Res,2001 ,16(4):652.
[12]M oye VE,Barraeloush R,West C,et al.Osteopontin expression correlates with adhesive and metastatic potential in metastasis inducing DNA-transfected rat mammary cell lines[J].Br J Cancer,2004,90(9):1796.
[13]丁凌,鄭樹.骨橋蛋白在不同大腸癌細胞株中的轉移相關功能研究[J].中國病理生理雜志,2007,23(3):460.
[14]秦千子,黃順榮.結直腸癌MMP 7和MMP13的表達和意義[J].廣西醫學,2005,27(10):1539.

