組織工程支架和細胞的相互作用
向鴻照綜述,王遠亮,楊維虎審校
(重慶大學生物力學與組織工程教育部重點實驗室 400044)
組織工程是把支架、細胞和生長因子三者相結合,用于病變、損傷部位組織和器官的修復、重建和再生。其中支架作為細胞外基質(ECM)的替代物,為細胞和生長因子負載提供一個3D環境。理想的支架除了應該具有足夠的孔隙率以利于氧氣和營養物質的運輸,還要有足夠的力學性能負載和刺激細胞,傳遞細胞信號,保證細胞的正常表型[1-3]。因此,了解組織工程中細胞和支架的相互作用對組織和器官的制備具有重要的意義。
1 支架對細胞的作用
理解3D支架對細胞組織的作用是組織工程研究的重點。支架對細胞的刺激主要是通過支架的構型、機械性能和外力作用3種途徑實現的,其中對3D支架的機械性能的評估是組織工程研究的關鍵。下面分別進行論述。
1.1 支架模量對細胞生理功能的影響 支架的機械性能對細胞的表型、生長、遷移和繁殖等生理活動起到調節和控制的作用[4-5],其中支架剛性(主要指楊氏模量)對細胞行為的影響最為重要。很難準確定義3D支架中細胞的形態和支架剛性之間的關系,因為支架中細胞的表型是一個物理和生化性質共同作用的復雜過程,除了考慮支架的模量外,還要考慮蛋白水解敏感性,細胞生長因子等因素。Daniel等[6]在研究支架模量和蛋白水解敏感度對細胞表型的影響中,發現在柔順支架中(0~100 Pa)生長的細胞更多表現出星形,而剛性較大(>500 Pa)的支架中生長的細胞則主要表現為圓球形,見圖1。并且對于不同的細胞和支架其相關系數是變化的。支架模量除了影響細胞的形態之外,還控制細胞的分化和遷移功能[7]。Engler和Jean[8]研究發現,當間充質干細胞(MSCs)被種植在聚酰胺(PA)凝膠支架上時,通過控制支架基底的模量可以影響細胞的分化。此外,當支架的彈性模量分別相似于肌肉、腦和骨組織的彈性模量時,可以誘導細胞分化成肌細胞、神經元、成骨細胞。并且,基體模量直接誘導細胞骨架的肌動蛋白的重構。在細胞植入初期,支架基底的模量會影響相鄰內皮細胞融合。在Engler和Jean[8]的實驗中PLLA/PLGA混合物的機械性能影響支架肌肉細胞的構造、分化和成活力,剛性的PLLA/PLGA支架支持細胞聚集形成線性管狀。Reinhart等[9]發現采用柔軟的基底有利于細胞在支架中的黏附和保持細胞之間的接觸,剛性的基底則鼓勵細胞遷移活動,基底的彈性強度與細胞遷移的速度和距離相關。為了研究支架的模量對細胞繁殖的影響,Hadjipanayi等[10]和 Levy-Mishali等[11]對比成纖維細胞在剛性和柔順2種膠原支架上的生長情況,剛性支架中的成纖維細胞2 d時表現出較高的繁殖能力(其細胞密度為柔順支架上細胞密度的2倍),2 d時柔順支架細胞繁殖數目與剛性支架相比顯示出4 d的滯后期,6 d時柔順支架細胞繁殖數目表現出6 d的滯后期。
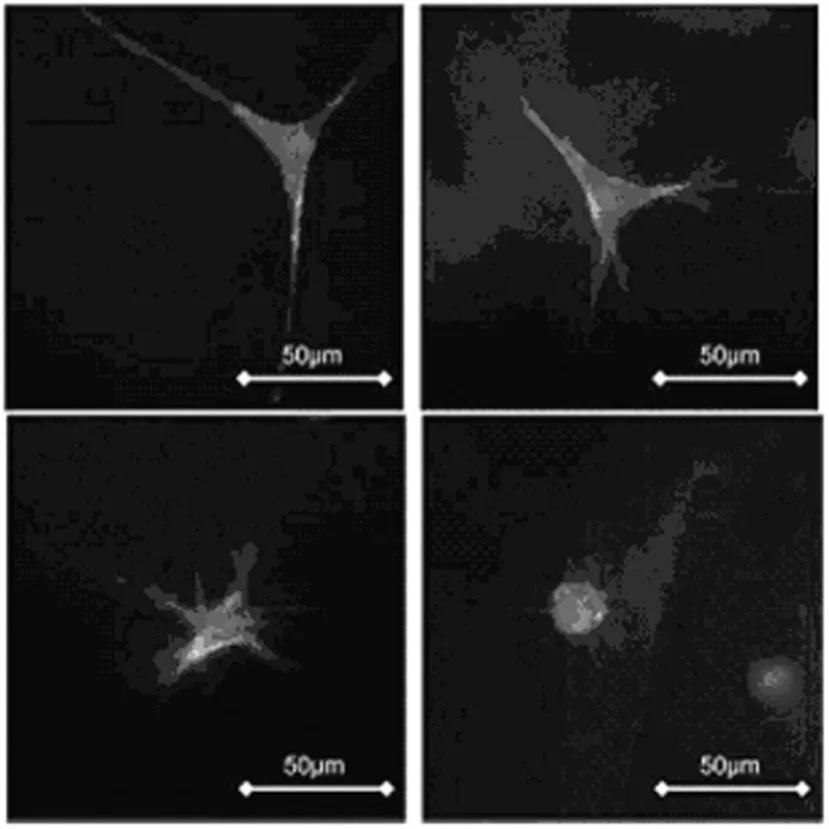
圖1 細胞在不同硬度支架中的形態
1.2 支架模量對細胞收縮力的影響 細胞收縮力是細胞在3D支架黏附和生長過程中,受到支架模量和構型等因素的刺激產生的調控細胞應答和響應的力。細胞的收縮力對很多生理功能如感染、傷口愈合、血管再狹窄非常重要。支架模量對細胞收縮力的影響現在還沒有一個統一的定論,研究這方面的文獻也較少,有的結論甚至相互矛盾。Karamichos等[12]發現種植成纖維細胞在硬的膠原凝膠支架中,細胞產生的收縮力下降。而Yi等[13]的實驗結果顯示支架的硬度和細胞產生收縮力的強度成正比。與此矛盾的是,有學者通過力學測量發現細胞的收縮力大小與支架的硬度無關。作者認為不同的結論可能源于支架不同的應變水平或細胞不同時期的影響,以及不同的研究模型和理論。研究支架的模量和細胞力之間的關系是一個復雜的問題。首先需要提高實驗儀器精度以及規范操作,使用來源一致的支架并且統一的細胞處理技術。
1.3 支架構型對細胞的影響 支架作為細胞生長的外部環境,支架的構型為細胞提供了黏附的基底和生長的空間,同時還影響細胞在支架中的密度分布,以及制備的組織器官的形狀和功能[14]。實驗顯示,內皮細胞種植在不同尺寸的球形支架中,當球的直徑減小時細胞病死率增加。在微島結構中培養內皮細胞,顯示繁殖細胞的增加主要出現在微島的邊緣,其中細胞密度最大的部位分布在微島的角上。此外,MSCs種植在膠原3D支架微島結構中,結果顯示分化的脂肪細胞主要聚集在微島結構的中心部位,成骨細胞則主要分布在微島結構的邊緣部位。說明支架構造對細胞分化可產生特殊影響。Victor等[15]研究了支架材料、長度、結構對制備工程肌腱組織的影響,發現當支架為海綿結構時得到肌腱力學性能優于凝膠結構的支架;延長軸方向,長度較大的支架其制得的肌腱徑向力學性能優于短支架;支架對細胞作用力傳遞有梯度緩沖作用。
通過認識支架幾何形狀對細胞行為的作用,促進三維支架制造技術的發展,這些技術能有效地控制支架的幾何形狀,滿足組織和器官制備的需要。例如光成型技術、靜電紡絲編制技術、3D打印制備支架等。
1.4 外力作用對細胞的影響 支架在外力作用下影響細胞的表型、分化和繁殖。不同的細胞和組織采用不同的支架、反應器、刺激方式。機械刺激在組織生長過程提供剪切力,通過拉伸(單軸和雙軸)、靜態和動態的負載影響細胞的行為。例如collagen-glycosaminoglycan支架種植成纖維細胞,在模擬環境下拉伸方向、拉伸幅度、彈性形變次數和頻率對組織工程細胞的彈性模量都會產生影響[16]。在體外對種植在膠原表面的MSCs細胞應用機械刺激,制備得到機械性能增加的肌腱組織,隨后植入體內。此外,對人骨髓干細胞進行的機械刺激,結果顯示這種刺激有利于骨細胞和骨組織的產生。最近發現,在聚乙二醇(PEG)支架上種植關節軟骨細胞,經過動態的壓力和拉伸刺激28 d,與靜止狀態培養相比,細胞表現出很高的彈性模量。這些發現都表明外部的刺激能誘發細胞的生理變化,細胞的生理變化反過來又影響支架的性質[17]。角膜成纖維細胞分別種植在單軸拉伸和無拉伸的膠原支架中,證明細胞排列和形態與支架的重排一致,細胞種植在未拉伸的支架中,自由取向,成星形狀態,而細胞在拉伸環境中平行于長軸方向排列。增加支架對細胞影響的理解能更好地指導組織工程支架的制備。
2 細胞對支架的作用
支架在調控細胞行為的同時其性質也受到細胞活動的影響,主要表現為支架變形、支架降解和模量下降。支架性質的改變是細胞物理和生化兩方面作用的結果[18]。
一方面由于細胞活動時產生的收縮力引起支架重新塑形。支架中細胞活動包括伸展、收縮、遷移3個階段。首先細胞在工程支架中鋪展和黏附,在蛋白水解的幫助下伸展層形足板進入支架內部,細胞和細胞之間是隔開的,周圍支架不發生形變;12 h后細胞產生收縮力引發支架向細胞靠攏,然后誘使支架局部微小變形;3 d后支架中的細胞相向遷移,開始發生相互聯系;7 d時支架中的細胞相互連接并且產生聚集,引起整個支架的收縮(即支架被壓縮變形)。細胞之間的連接作用破壞了支架的彈性恢復。細胞的星形形狀有利于它們與支架基底黏附以及通過支架孔相互連接。
另一方面是由于蛋白酶的作用。蛋白酶的作用分為3類:(1)蛋白水解酶作用[19],它們破壞支架纖維蛋白骨架,為細胞層形足板進入3D支架內部提供渠道。這種水解作用降低支架的模量,加速支架的降解。(2)產生新的結構蛋白如膠原,引起支架的局部結構和力學性能發生變化。(3)調控肌動蛋白,肌動蛋白是控制細胞收縮作用的關鍵。其中α-SMA(alpha smooth muscle actin)對細胞肌動蛋白絲合成有調節作用。有學者研究了單個肌纖維細胞中α-SM A蛋白的表達與細胞收縮力的關系,發現α-SMA對收縮力的產生沒有影響,但是它的存在能提高細胞的收縮力大小,兩者表現為一種近似的線性關系,至于原理現在還不清楚。有學者發現α-SMA含量高不僅能提高肌動蛋白絲表達和細胞的黏附性能,還可以有效地通過調節優化細胞亞單元的空間分布實現細胞的變形,影響細胞功能。轉換生長因子TGF-β蛋白調節能增加α-SMA的表達,促進肌纖維細胞分化。有研究發現 TGF-β1與 TGF-β3相比更能誘導α-SMA 表達。b FGF、PGE2能抑制 TGF-β1的表達,阻礙細胞收縮力的產生。這些作用都是通過整合素傳遞給細胞外支架。
除此之外,組織工程中細胞的培養條件[20]也會影響支架的模量。培養液除了提供足夠的養分和緩沖作用外,還含有激素和生長因子以促進細胞的增殖。考慮這些因素有利于更好地理解細胞與支架或ECM相互作用的機制。
3 測量細胞收縮力儀器
測量細胞收縮力和研究收縮力的調節功能是理解組織和器官的生理和病理功能的關鍵。定量細胞收縮力的大小為組織工程選擇理想的細胞和支架提供幫助。以下介紹檢測細胞收縮力的最新儀器和原理。
CFM力學檢測儀通過傳感器記錄支架的微小形變(靈敏度為10-6m)換算成力的大小。獲得細胞對支架作用力隨時間變化的曲線圖。缺點是存在背景噪聲(它反映所有細胞對支架的作用,沒有生長在支架上的細胞產生的力也被記錄下來)。一個典型的CFM曲線能顯示106個生長在膠原支架中的成纖維細胞產生的力,推斷出某個時間細胞產生的力。如培養8 h,一個成纖維細胞可以產生大約0.1 n N的力。有學者對此系統加以改進,從測量結果中扣去背景噪音,得到更加準確的結果。有學者測量細胞收縮力對collagen-glycosaminoglycan支架的影響,結果顯示支架中成纖維細胞密度和所產生的力之間呈線性關系。此外將關節軟骨細胞種植在相同的支架上,力/時間曲線顯示單個細胞力峰值為0.3 nN(3 h)。
Eastwood設計了更加精密的CFM(t-CFM)系統。t-CFM系統可以檢測細胞對支架的機械力反應,當成纖維細胞種植在3D collagen-glycosaminoglycan支架中時,t-CFM裝置檢測發現種植8 h以后細胞收縮力減少,達到一個新的平衡。顯示出細胞具有一種自我調節功能,能減少由于外界刺激對細胞的破壞和干擾。人們使用t-CFM檢查了骨髓干細胞在膠原支架中的收縮情況,結果顯示力學峰值隨供體的不同而不同。
在t-CFM基礎上研制出(SIM-CFM)[21]。這種裝置可以同時獲得細胞作用力、外部載荷和支架微觀的圖像。SIMCFM能提供4個關鍵數據,通過這4種數據可以確定支架形變過程。這4種數據是細胞的尺寸、細胞內應力、動態的細胞擾動和支架在濕態時位移。這些數據的測定有助于衡量支架的變形和細胞力之間的關系。
對細胞圖像的觀測可以借助原子力顯微鏡觀測細胞和支架的微觀作用。標定細胞的空間構型采用類似細胞間骨架聚合物F-actin的細胞角蛋白中間絲的免疫熒光染色,或者通過分子探針(Eugene OR)對細胞內進行熒光探針標計[22-23]。
前面介紹這些技術對于研究工程細胞和組織的生長極為重要。合適相匹配的細胞和支架將會有助于提高組織工程技術,獲得所需健康的組織器官。
4 結 論
本文主要是介紹組織工程中細胞和支架間的相互作用,介紹了支架的機械性能對細胞功能的影響,細胞的收縮力對支架的作用,還有最新的測量裝置和作用原理。將來的研究應當著重發展新的實驗裝置,有效地定量細胞產生的收縮力。這些技術應該提供一個可供操作的統一規范,從而使實驗結果具有可比性,更加精確。探討細胞與支架,細胞和細胞之間的作用將為進一步的組織工程模型提供理論依據,有助于尋找更好的組織工程支架和細胞。
[1]Alvaro M ,Eun JK ,Cynthia A,et al.A three-dimensional scaffold with precise micro-architecture and surface micro-textures[J].Biomaterial,2009 ,30(5):4610.
[2]Wang L,Shashi KM ,Wlilliam H,etal.Influence of microw ellbiomimetic topography on intestinalepithelial Caco-2 cellphenotype[J].Biomaterials,2009,30(8):1.
[3]Vincenzo G ,Filippo C ,Paola T ,et al.Polyactic acid fibroreinforced polycaprolactone scaffolds for bone tissue engineering[J].Biomaterials,2008 ,29(5):3662.
[4]Biman B,Subhas C.Cellpreliferationand migration in silk fibroin 3D scaffolds[J].Biomaterials,2009 ,30(2):2956.
[5]Anthony CJ,Christoph HA ,Dietmar WH ,et al.The correlation of pore morphology,interconnectivity and physicalproperties of 3D ceramic scaffolds with bone ingrow th[J].Biomaterials,2009 ,30(29):1440.
[6]Daniel D,Havazelet B ,Dror S.Defining the role of Matrix com pliance and proteolysis in three-Dimesionalcell spreading and remodeling[J].Biophys J,2008,94(4):2914.
[7]Deok-Ho K ,Karam H ,Kshitiz G,et al.Mechanosensitivity offibroblast cell shape and movement to anisotropic substratum topography gradients[J].Biomaterials,2009,30(6):5433.
[8]Engler AJ,Jean S.Biophysical Regulation of Endoderm By 3-Dimensional Fibronectin Matrix[J].Biophys J,2009,96(3):523.
[9]Reinhart KCA,Dembo M,Hammer DA.Cell-Cell mechanical communication through compliant substrates[J].Biophys J,2008 ,95(12):6044.
[10]Hadjipanayi E ,Mudera V ,Brow n RA.Close dependence offibroblast proliferation on collagen scaffold matrix stiffness[J].J Tissue Eng Regen Med,2008,33(5):1384.
[11]Levy-Mishali M ,Zoldan J,Leavenberg S.Effect of scaffold stiffness on myoblast differentiation[J].Tissue Eng Part A ,2008,51(11):2607.
[12]Karamichos D,Brown RA ,Mudera V.Collagen stiffness regulates cellular contraction and matrix remodeling gene expression[J].J Biomed Mater Res A,2007 ,83(4):887.
[13]Yi F,Gong YQ ,Prabar K,et al.Spatial Coordination of Actin Polymerization and ILK-Akt2 Activity during Endothelial Cell Migration[J].Deve Cell,2009 ,16(5):661.
[14]Cheng K,Lai YZ ,William S.Th ree-dimesnsional polymer scaffolds for high throughput cell-based assay systems[J].Biomaterials,2008 ,29(3):2801.
[15]Victor S,Marepalli N,Jason T,et al.Effect of scaffold mmaterial,construct length and mechanical stimulation on the in vitro stiffness of the engineered tendon construct[J].J Biomechan,2008,41(11):822.
[16]Jungreuthmayer C,Jaasma S.Deformation simulation of cells seeded on a collagen-GAG scaffold in a flow perfusion bioreactor using a sequential 3D CFD-elastostatics model[J].Med Eng Phys,2009,31(4):40.
[17]Dekel D,Shlanlamit L.Cell-scaffold mechanicalinterplay within engineered tissue[J].Semin Cell Deve Biol,2009,20(11):656.
[18]Simon C,Geralding R,Jennifer S,et al.The relationship between the mechanical properties and cell behaviour on PLGA and PCL scaffolds for bladder tissue engineering[J].Biomaterials,2009 ,30(7):1321.
[19]Kumiko M ,Shinichi T,Kosuke O,et al.Comparative study of silk fibroin porous scaffolds derived from salt/waterand sucrose/hexafluoroisopropanolin cartilage formation[J].J Biosci Bioeng ,2009,108(1):68.
[20]Christophe P,Kiyoshi T ,Yasuyuki S ,et al.A method for the design of3D scaffolds forhigh-density cellattachment and determination of optimum perfusion culture conditions[J].J Biomechan,2008,41(2):1436.
[21]Annegret H,Dahlmann N ,Belen M ,et al.Dynamic protrusive cell behaviour generates force and drives early matrix contraction by fibroblast[J].Exp Cell Res,2007,31(3):4158.
[22]Deepak V,Ranga R.Surfactant-free Cd Te nanoparticles mixed M EH-PPV hybrid solar cell deposited by spin coating technique[J].Solar Energy Mate Solar Cells,2009,93(9):1482.
[23]Ranjna CD,Aroop KD.Cell-interactive 3D-scaffold:advances and applications[J].Botechnol Adv,2009 ,27(2):334.

