藥物生物轉化研究方法簡述
劉偉卿 周 靜
藥物生物轉化是指藥物在體內經歷的化學結構的變化過程。大部分藥物經生物轉化后藥理活性降低甚至消失,最終隨尿和糞便排除體外,但也有一些藥物通過生物轉化后藥理活性增強或毒性增加。因此,藥物生物轉化不僅影響藥物作用的強弱和持續時間的長短,而且還會影響藥物治療的安全性,具有重要的現實意義。對于創新藥物,需了解其在體內的生物轉化情況。通過藥物生物轉化研究,發現并確定產生藥理作用的物質基礎,掌握藥物生物轉化規律,對于設計更合理的給藥途徑、給藥方法、給藥劑量,以及對制劑處方的設計、工藝改革和臨床都具有指導意義。
藥物生物轉化的主要部位在肝臟,肝外生物轉化場所有:消化道、肺、皮膚、腦、鼻黏膜、腎臟等,也可被腸內細菌轉化。肝臟外器官的生物轉化活性比肝臟要低得多,所以至今為止對藥物生物轉化的研究大多以肝臟為主。
1 傳統體內方法
傳統體內方法是指在動物或人服藥過后,經過一段時間后收集血液、尿液和膽汁等生物樣品(動物還可以獲得組織器官等實驗樣本)。然后用溶劑提取或采取柱色譜或薄層制備,有的經HPLC制備得到較純品,再對原藥及生物轉化產物進行紫外、紅外、質譜、磁共振等光譜分析,推斷生物轉化產物的結構,并用化學方法合成生物轉化產物的對照品,進一步驗證其結構。常用的動物有小鼠、大鼠、家兔和豚鼠等。
該方法可以綜合地考慮各種體內因素對藥物的影響,能夠真實全面地反映藥物生物轉化的體內整體特征。車慶明等[1]從口服黃芩苷的人尿液中,發現并鑒定了3個主要生物轉化產物的化學結構,并確定了黃芩苷元是主要藥物生物轉化產物的中間體,他們在體內共存,構成黃芩苷的藥效物質基礎。
本法的缺點是難度比較大,許多藥物在生物體內的分布都比較廣,加上生物轉化的器官和酶系的多樣性,使藥物及其生物轉化產物在體內的濃度都比較低,檢測具有一定的難度。但是,現代分析技術的進步和分析儀器靈敏度的提高將彌補傳統體內方法的不足,充分體現此方法的優越性。近年來不斷發展成熟的色譜-光譜聯用技術使得色譜分離和光譜鑒定成為一個連續的過程,它集色譜的高效分離與光譜的強鑒定能力于一體,分析快速方便,具有其他藥物生物轉化產物檢測及結構分析方法所不可比擬的優點。丁黎等[2]人通過收集給藥后大鼠膽汁,以液相/二級管陣列檢測器/質譜檢測器聯用(LC/DAD/MSD)技術為基礎,確定了鹽酸非洛普的Ⅱ相生物轉化產物。
2 微透析取樣研究法[3,4]
微透析取樣研究法是20世紀60年代中期發展起來的在體藥物生物轉化研究方法,此后的20年間進展不大,到80年代中期才有了長足的發展。微透析取樣法最初主要用于研究腦內神經遞質的釋放。
微透析取樣裝置主要由微透析探針和微量取樣泵組成。長4~10mm的再生纖維透析膜固定在一根微徑導液管上構成探針,外徑一般300μm左右,取樣窗口4~10mm;透析膜前有保護頭,可除去相對分子質量>50×103的分子。其原理如下:微型泵將灌注液泵入探針,灌注液與細胞外液組成完全一致時,透析膜不再發生水和離子交換,只有小分子物質按濃度剃度原理進、出探針所埋入的生理環境。進入膜內腔的位灌注液,透出膜內腔的為透析液。
微透析取樣研究法可在清醒、自由活動狀態下的動物體內多個器官以及同一器官多個位點連續取樣的實時在線分析;可連續跟蹤體內多種化合物隨時間的變化;取樣無需勻漿過程,可真實代表取樣點化合物的濃度,且樣品因不含蛋白質、酶等大分子物質,可不經預處理直接用于測定;用于研究藥物生物轉化,可維持實際生理條件,消除了傳統藥物生物轉化研究中因組織均勻化破壞細胞隔室造成對生物轉化研究結果的影響,并可獲得有關藥物生物轉化中間過程的信息,而傳統方法只能了解藥物的最終產物,不能反映其中間過程。此外,微透析取樣研究法還具有能埋入動物體液或組織中、對周圍環境損傷很小的特點。由于取樣少,不會造成小動物失血過多而死亡,因此實驗可以在同一動物身上進行,從而避免了個體差異對試驗結論準確性的影響。
隨著各種類型微透析探針出現和商品化,以及微量快速、靈敏的分析檢測手段的不斷完善,微透析取樣技術結合色譜分析已成為藥物生物轉化研究的強有力手段。
3 藥物肝臟生物轉化研究法
肝臟含有大部分的生物轉化活性酶,而且具有很高的血流量,是藥物生物轉化最重要的器官。目前,肝臟生物轉化的體外研究方法中有肝微粒體法、肝細胞體外溫孵法、肝臟灌流技術、肝組織切片法、基因組P-450酶系、微透析技術等。
3.1 肝微粒體法[3]
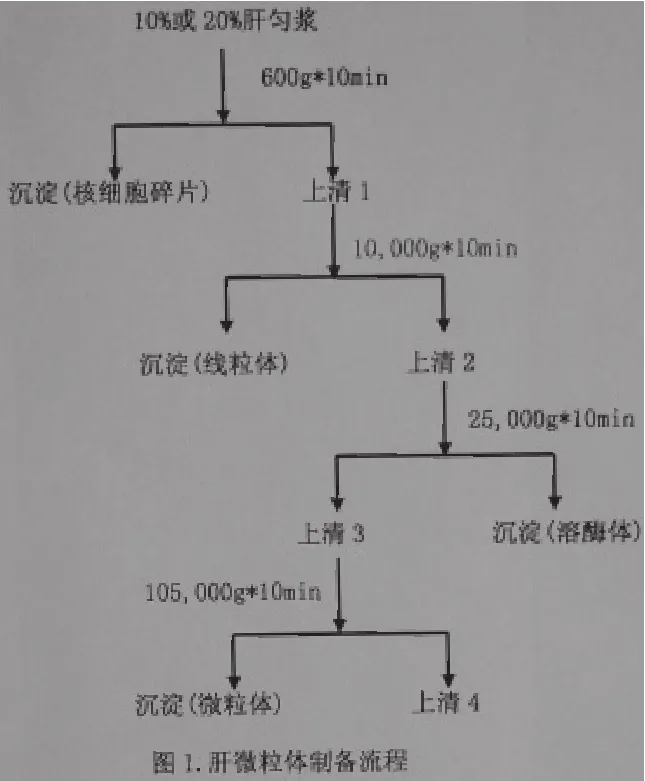
肝微粒體法有在體和離體兩種方法。前者多首先用腹腔注射苯巴比妥鈉來誘導肝細胞色素P-450后再給予動物待研究藥物,通過測定原型藥物和其生物轉化產物在正常動物和給藥動物血清和組織中的分布來研究藥物,通過測定原型藥物和其生物轉化產物在正常動物和給藥動物血清和組織中的分布來研究藥物生物轉化。后者是由制備的肝微粒體輔以氧化還原型輔酶,在模擬生理溫度及生理環境條件下進行生化反應的體系。此法制備簡單,生物轉化時間短,易于重現,方便大量操作以積累生物轉化樣品供結構研究;同時,該方法可用于對藥酶的抑制及體外生物轉化清除等方面的研究,因而應用較為普及。目前利用此法研究確定了抗焦慮新藥[5]AF-5的兩個主要生物轉化產物;結合整體動物實驗,還基本闡明一葉 堿[6]在大鼠體內生物轉化的途徑。廣泛應用的肝微粒體制備流程[3]如圖1所示。
3.2 肝細胞體外溫孵法
肝細胞體外溫孵法同肝微粒體法相似,即以制備的肝細胞輔以氧化還原型輔酶,在模擬生理溫度及生理環境條件下進行生化反應的體系,適于研究蛋白及mRNA水平藥物代謝酶誘導及酶活性,在評估藥物生物轉化過程中藥物間的相互作用時,該方法得到廣泛的應用。但肝細胞制備技術較復雜,目前以膠原酶灌注技術為主[7],且體外肝細胞活性僅能維持4h,不利于儲存和反復使用。
3.3 離體肝灌流法
離體肝灌流法與肝微粒體法、肝細胞體外溫孵法相比,一方面保留著完整細胞的天然屏障和營養液的供給,因而能在一段時間內保持肝臟的正常生理活性和生化功能;另一方面,具有離體系統的優點,能夠排除其他器官組織的干擾,可控制受試物質的濃度,定量地觀察受試物質對肝臟的作用。
Alexandra等[8]利用離體大鼠肝臟一過式灌流方法研究一種新的抗癌藥BR(苯甲酰胺核糖核苷)的體外代謝,分別以Wistar大鼠與TR2大鼠進行實驗,灌流過程中每隔5rnin取樣1次,監測BR及其代謝物,結果表明,Wistar大鼠灌流液中只有BR及其去氨基產物BR-COOH通過色譜檢測出來,而BAD(苯甲酰胺腺嘌呤雙核苷酸)未檢出TR2大鼠,灌流液的檢測結果與Wistar大鼠幾乎相同,但在BR與BR-COOH的檢出量上,TR2大鼠組低于Wistar大鼠組18%~23%。同時,應用Wistar大鼠分離肝細胞,對不同濃度的BR(0~3mmol/L)進行了溫孵實驗,通過檢測,BAD仍然無法檢出。通過對BR的離體肝灌流與肝細胞體外溫孵實驗結果比較,均發現BAD低于檢測限,未檢出,這說明BAD這種活性的代謝產物在大鼠肝臟中代謝率很低,BR-COOH為其主要的代謝途徑,故可推測,BR在人體的癌癥治療中,主要代謝生成為BR-COOH。當前,離體肝灌流亦應用于對藥物的藥動學參數進行考察。Christian等[9]運用該方法考察了藥物CPT~11在膽汁中的排泄、清除速率及AUC等藥動學參數,取得了較好的結果。離體肝灌流法具有器官水平的優勢,兼備體外實驗和整體動物實驗的優點,更適于定量研究藥物體外代謝行為和特點,并能解決在其他的體外肝代謝模型和整體動物實驗中不能得到滿意解決的難點,在藥理學和毒理學的研究中已受到廣泛的重視,但其對實驗設備及技術有一定的要求,一定程度上限制了其應用。
3.4 肝組織切片法
該方法的優點在于可以保留所有的肝藥酶及細胞器的活性,對于某些藥物生物轉化研究來說,有時采用肝組織切片技術比肝微粒體孵育更好.但由于該技術需要切片機等特殊的設備,因此近年來已經很少被采用。Harris用肝切片技術研究了紫杉醇的生物轉化,得到了3個產物,且與紫杉醇的肝微粒生物轉化產物相同,說明了這一技術在藥物生物轉化研究上的可行性。
3.5 體外純化酶系統模擬法
由于肝臟中藥物生物轉化主要是由P-450酶系統催化反應的,故可以通過純化的P-450同工酶、P-450混合酶來模擬體內肝臟中酶系統,與藥物底物溫孵培養,來進行藥物生物轉化研究。
4 藥物胃腸道生物轉化研究[3]
胃腸道是口服藥物的必經通道,近來隨著人類對腸道菌不斷認識,胃腸道作為藥物生物轉化的重要部位越來越引起研究者的重視。藥物在胃腸道各種酶的作用下可發生生物轉化,酶主要包括兩部分,一部分是消化道上皮細胞中產生的酶,主要是一些結合酶,另一部分就是消化道菌從產生的酶,主要以分解或還原反應為主,其種類比肝臟還多。胃腸道的不同部位具有不同的菌群眾特點,如消化道下部主要是厭氧菌,因而也就有不同生物轉化特征。
與肝臟相比,腸內菌群在藥物生物轉化的類型及功能上均有其獨特之處。肝臟對藥物兼有分解與合成的功能,多數藥物經肝臟生物轉化后相對分子質量增大,極性增強而易于從體內排除,主要表現為解毒作用;腸內菌群則幾乎全為分解反應使藥物相對分子質量減小,極性減弱,脂溶性增強,往往伴有藥效及毒性作用的增強。從某種意義上說,腸內菌群對藥物的生物轉化可視為肝臟的補充或對抗。
4.1 藥物的胃液生物轉化研究[3]
在正常飼養條件下飼喂大鼠,絕食過夜,在厭氧條件下按35mg/mL劑量腹腔注射苯巴比妥鈉進行麻醉。再開腹、取胃。將胃內容物全部洗出,黏附在胃壁上的內容物用生理鹽水洗下,與胃內容物合并,放入溫孵培養管內,用厭氧稀釋液定容,37℃預溫卵培養一段時間(一般為30min)。然后再加入一定濃度的待研究轉化藥物,再在37℃培養一段時間或定時取樣分析。此法適合研究胃內酶類的藥物結構轉化。
4.2 藥物的腸液生物轉化研究[3]
在厭氧條件下按上述方法(胃液的生生轉化研究)處理大鼠或小鼠,取出腸液,用厭氧稀釋液稀釋后在厭氧培養基內厭氧預溫孵培養一段時間(一般為30min)。然后再加入一定濃度的待研究轉化藥物,再在37℃培養一段時間或定時取樣分析。此法適合研究腸內細菌的藥物生物轉化,適合大規模制備轉化產物。對研究多細菌或混僵細菌或腸內菌叢的藥物轉化尤為合適。
4.3 腸內菌生物轉化研究方法
4.3.1 全糞便溫孵法
該法目前應用最廣泛的胃腸道生物轉化研究方法,由于腸道內需氧菌只占腸道菌叢的極少部分,其絕大多數的厭氧菌是藥物生物轉化的主要角色,因此,糞便溫孵法主要就是制造適合厭氧菌生長的厭氧環境和營養條件,在此條件下,加入藥物與細菌混合、溫孵,然后檢測藥物原型成分和生物轉化產物的種類和數量。使便出的厭氧菌存活下來的簡單而實用的方法[3]是:取一塑料袋,充滿二氧化碳氣(置換掉氧氣)。擠壓出來后,再次充滿二氧化碳氣,反復數次,盡量將空氣排盡。然后裝入糞便(由于糞便部分不同,菌叢亦不同,因此要使用全便)。用手擠壓使之均質化。取均質化的糞便2g,加入19mL厭氧菌稀釋液,培養,作為糞便菌液。
4.3.2 單一菌種溫孵法[3]
即用單一菌種與藥物共同進行厭氧培養,然后檢查藥物生物轉化情況的方法。目前,公認的、有代表性的腸道菌有20多種,利用它們與藥物一同進行溫孵,結果發現不如腸道混僵菌降解藥物明顯,但利用單一菌種降解藥物的條件易于控制,有利于有用的藥物生物轉化產物的工程化生產以及新的菌種的發現。
4.3.3 簡單的大腸菌叢培養法
此法操作同簡單的結腸菌群培養研究法,只是操作對象是大腸內容物而已。
4.3.4 腸菌酶法
腸菌酶法即把由腸菌中分得的酶作用于藥物,間接地研究腸道菌對藥物作用的方法。
4.3.5 結腸菌叢研究法[3]
4.3.5.1 簡單的結腸菌群培養研究法
在正常飼養條件下飼喂大鼠,絕食過夜。在厭氧條件下按35mg/mL劑量腹腔注射苯巴比妥鈉進行麻醉。再開腹、取結腸。將結腸內容物全部洗出,黏附在結腸壁上的內容物用厭氧菌稀釋液洗下,與結腸內容物合并,放入溫孵培養管內,用厭氧稀釋液定容,37℃溫孵培養一段時間或定時取樣分析。
此法的結腸菌所致的藥物轉化接近于真實情況,在中藥成分的腸內細菌代謝或生物轉化研究中被廣泛應用。
4.3.5.2 人結腸菌群體外模型法
現已建立不受宿主影響、適合研究微生物相互作用、細菌對藥物轉化活性的厭氧性連續培養系統。該系統的細菌菌叢在主要菌種、菌種多樣性等方面與接種糞便菌叢類似。但目前關于此方法的報道較少,體外模型法雖具有可控性等特點,但在研究哺乳動物及微生物等的酶所致外來化合物活化、毒性和藥效方面卻明顯不足。
4.3.5.3 人結腸菌叢在體模型法/無菌動物法
即取人糞便20%懸浮液1mL(相當于細菌數為5×1010)給予健康成年無菌動物(一般采用大鼠),飼養在無菌隔離器內。研究表明,人結腸菌叢酶的活性與定植在無菌大鼠的人腸內菌叢酶的活性基本沒有區別。因此,此實驗系統是一個相當好的模型。口服或靜脈給予的藥物經肝腸循環進入腸道內的藥物都有可能被腸內細菌所轉化,從而在動物組織或整個動物內分泌中發現的生物轉化產物實際上是藥物的腸內細菌轉化產物。因此,利用無菌動物研究藥物的腸內細菌生物轉化具有重要意義。
此外,將口服藥物給予無菌動物,然后測定動物組織或血中的藥物含量或生物轉化產物,可排除藥物經腸內細菌生物轉化的可能(對照組動物應該是同種類的普通動物)。與同種類的悉生動物配合應用可判斷腸內細菌轉化藥物的種屬特異性或生物轉化的連鎖性。如兒茶酚類化合物由腸內菌生物轉化是利用悉生動物得到證明的[3]。給普通大鼠服用多巴胺,尿中有3-對羥基苯乙酸和酷胺排出,在無菌大鼠尿內未發現這兩種物質。這一結果與給予患者服用L-多巴后在服用新霉素導致3-1對差基苯乙酸和酷胺在尿中排出降低的結果是一致的。柴胡皂苷-b1是中藥柴胡主要的抗炎有效成分之一,它的藥物作用機制是通過無菌動物、悉生動物、普通動物聯合應用揭示的。
[1]車慶明,黃新立,李艷梅,等.黃芩苷的藥物代謝產物研究[J].中國中藥雜志,2001,26(11):768.
[2]丁黎,張正行,倪沛洲,等.LC/DAD/MSD技術研究大鼠膽汁中鹽酸非洛普的II相代謝產物[J].藥學學報,2001,36(6):40.
[3]楊秀偉,王多佳.中藥成分代謝分析[M].北京:中國醫藥科技出版社,2003:160.
[4]余自成,陳紅專.微透析技術在藥物代謝和藥代動力學研究中的應用[J].中國臨床藥理學雜志,2001,17(1):76.
[5]張金蘭,劉穎,周同惠.微透析取樣技術在藥物代謝研究中的應用及前景[J].藥學學報,2001,36(7):528.
[6]李曉海,張金蘭,周同惠.左旋一葉 堿的代謝轉化[J].藥學學報,2002,37(4):288.
[7]王楠.缺血后處理對大鼠移植肝臟缺血再灌注損傷和細胞凋亡的保護作用[J].中國藥理學,2005,10(2):26-27.
[8]Alexandra S,Birgit H.Metabolism and disposition of the novel antileukaemic drug,benzamide riboside,in the isolated per fused rat liver[J].Life Sci,2001,69(21):2489-2502.
[9]Christian F,Marie-Christine H,Pierre G.Hepatic extraction,meta bolism,and biliary excretion of irinotecan in the isolated Per fused rat liver[J].J Pharmaceu Sci,2001,90(6):722.

