HtrA2/Omi與Survivin在胰腺癌中的表達及臨床意義
楊軍凱,劉 佳,張炳太
(1.山西醫科大學第二醫院普通外科,山西太原 030001;2.太原市中心醫院,山西太原 030009)
胰腺癌是惡性程度很高、預后很差的腫瘤,5年生存率<5.0%,其發生是一個多因素、多階段、多基因變異累積的復雜過程,細胞的凋亡與增殖在癌癥進展中發揮重要作用。促凋亡蛋白HtrA2/Omi可有效參與細胞凋亡過程,而Survivin是一種凋亡抑制蛋白,其特殊的分子結構及在細胞凋亡中發揮的功能也早已引起人們的關注。本研究通過觀察胰腺癌中HtrA2/Omi、Survivin蛋白的表達情況,揭示兩者之間的關系,進一步探討其與胰腺癌發生、發展的關系,并為胰腺癌的診斷及治療提供理論依據。
1 對象與方法
1.1 研究對象
病例組40例,均為2005年10月~2009年10月我院手術切除并經臨床診斷和病理檢查確診的胰腺癌患者,所有病例術前均未接受過放療或化療,其中,男24例,女16例;年齡42~78歲,平均52歲。按1997年UICC制訂的TNM分期,Ⅰ期8例,Ⅱ期15例,Ⅲ期13例,Ⅳ期4例;伴淋巴結轉移15例。病理分化程度:高、中分化15例,低分化25例。選擇癌旁正常胰腺組織20例作為對照。所有標本均經10%甲醛溶液固定,常規酒精脫水,石蠟包埋,4 μm厚連續切片。
1.2 實驗試劑與儀器
兔抗人HtrA2/Omi多克隆抗體購自北京博奧森生物技術有限公司,兔抗人Survivin多克隆抗體購自福州邁新生物有限公司,SP試劑盒購自北京中杉生物技術有限公司。
1.3 實驗方法
使用免疫組化SP法檢測胰腺癌及癌旁正常胰腺組織中HtrA2/Omi和Survivin的表達及分布情況,操作步驟依試劑盒說明書進行。
1.4 結果判定
HtrA2/Omi與Survivin均采用半定量積分法,將染色強度分為3級:無著色1分,淺著色2分,棕黃色3分;按陽性瘤細胞的百分比分3級:<25%為1級計1分,25%~75%為2級計2分,>75%為3級計3分。每張切片最后的得分為2次評分的乘積(1~9分),<3分為陰性;≥3分為陽性,其中,3~4 分為(+),5~6 分為(++),7~9 分為(+++)。
1.5 統計學分析
數據采用SPSS 13.0軟件分析,免疫組織化學的陽性率比較采用χ2檢驗,指標間相關性用Spearman秩相關進行統計學分析,P<0.05為差異有統計學意義。
2 結果
2.1 HtrA2/Omi的表達
HtrA2/Omi在癌旁正常胰腺組織細胞的胞質中存在表達(圖1),陽性表達率為30.0%,在胰腺癌中呈高表達(圖2),陽性表達率為82.5%,以胞質呈棕黃色為陽性細胞,與腫瘤TNM分期、分化程度相關(表1)。胰腺癌組織中的HtrA2/Omi陽性細胞數明顯高于癌旁正常胰腺組織(表2)。兩組HtrA2/Omi陽性表達率比較,差異有統計學意義(P<0.05)。
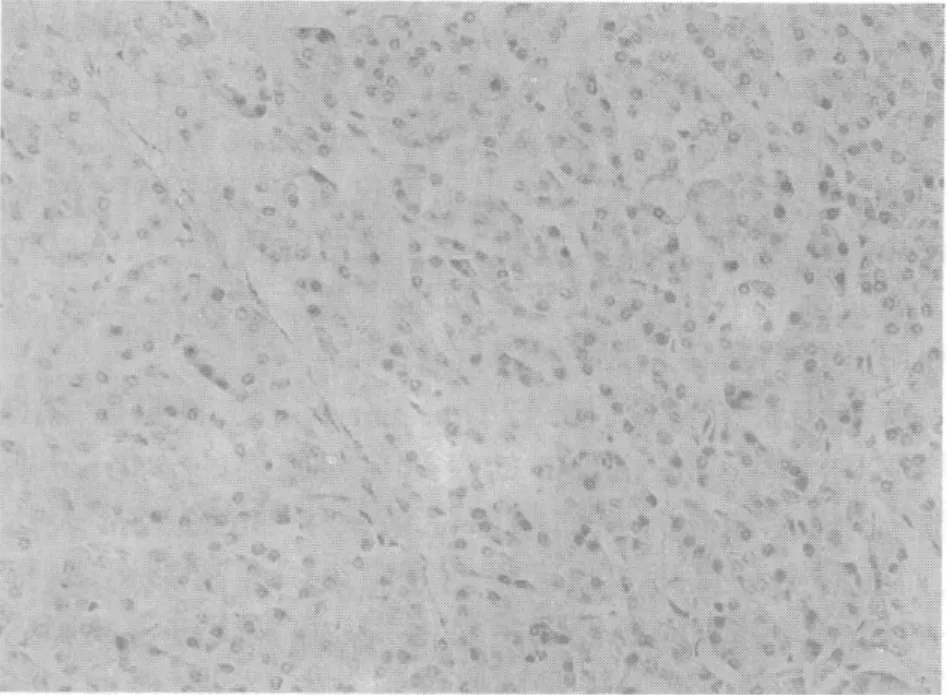
圖1 HtrA2/Omi在正常胰腺中的表達(SP×200)Fig.1 The expression of HtrA2/Omi in normal pancreas (SP×200)
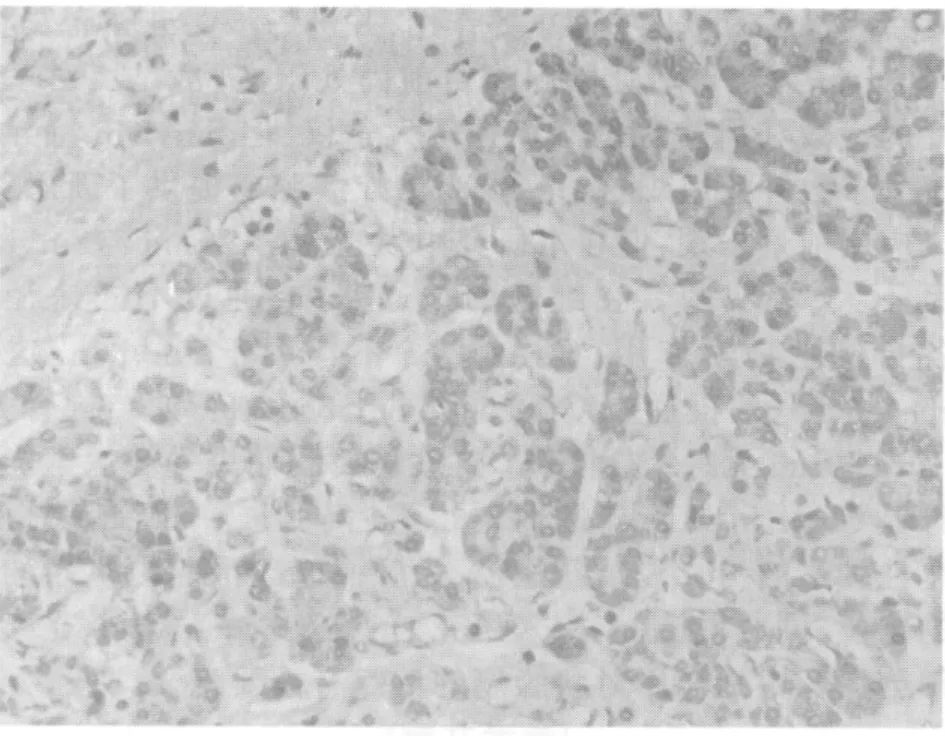
圖2 HtrA2/Omi在胰腺癌中的表達(SP×200)Fig.2 The expression of HtrA2/Omi in pancreatic carcinoma (SP×200)
2.2 Survivin的表達
Survivin在癌旁正常胰腺組織細胞中無陽性表達或低表達(圖3),陽性表達率為0,在胰腺癌組織胞核或胞質中呈高表達(圖4),陽性表達率為72.5%。Survivin以胞核或胞質呈棕黃色為陽性表達細胞,與腫瘤TNM分期、分化程度、腫瘤轉移相關(表1)。胰腺癌組織中的Survivin陽性細胞數明顯高于癌旁正常胰腺組織(表2)。兩組Survivin的陽性表達率比較,差異有統計學意義(P<0.05)。
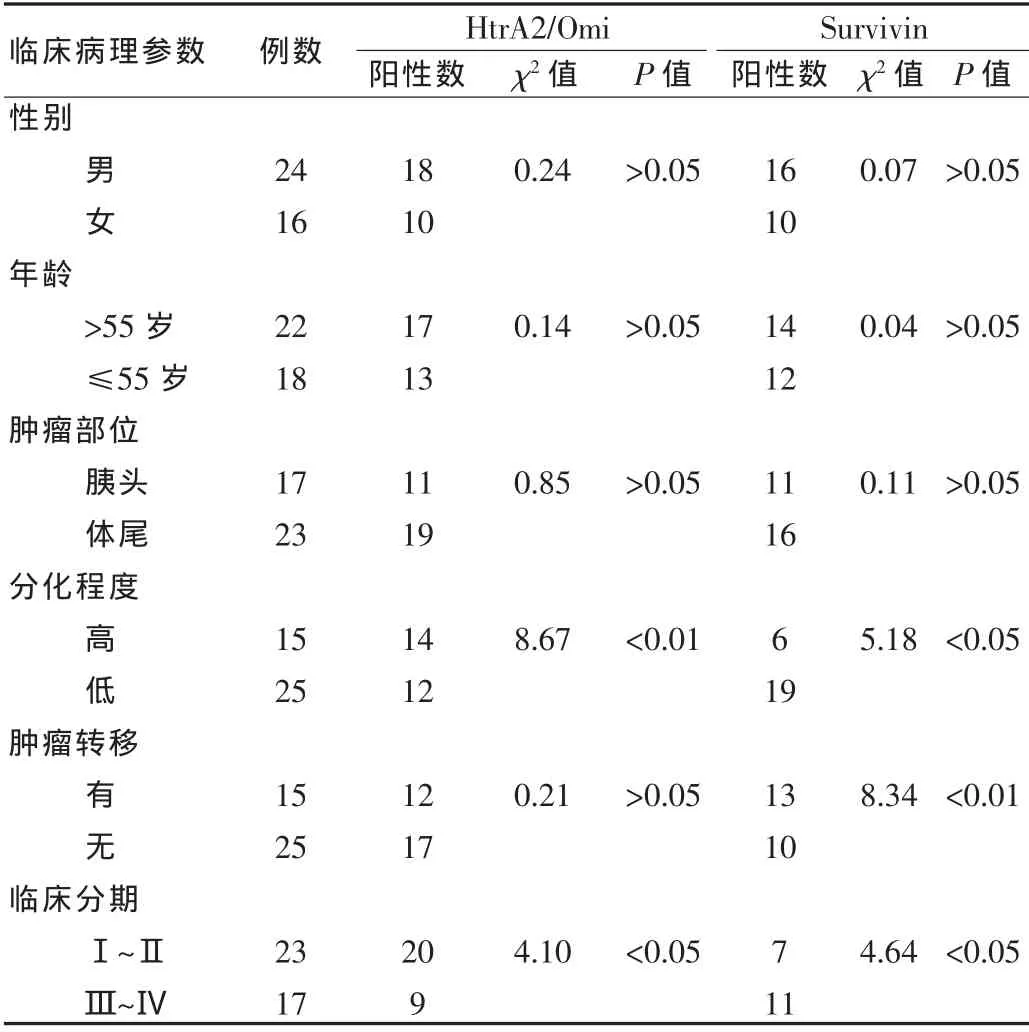
表1 胰腺癌組織中HtrA2/Omi、Survivin的表達與臨床病理學參數的關系(例)Tab.1 The relationship between the expression of HtrA2/Omi and Survivin in pancreatic carcinoma and the clinical pathology (case)
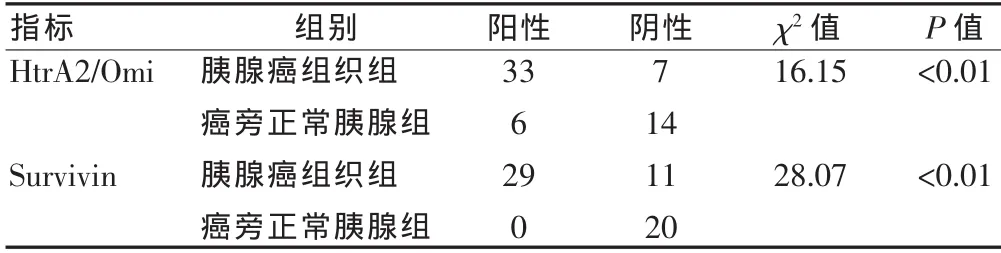
表2 HtrA2/Omi、Survivin在癌旁正常胰腺和胰腺癌組織中的表達(例)Tab.2 The expression of HtrA2/Omi and Survivin in normal pancreas and pancreatic carcinoma (case)
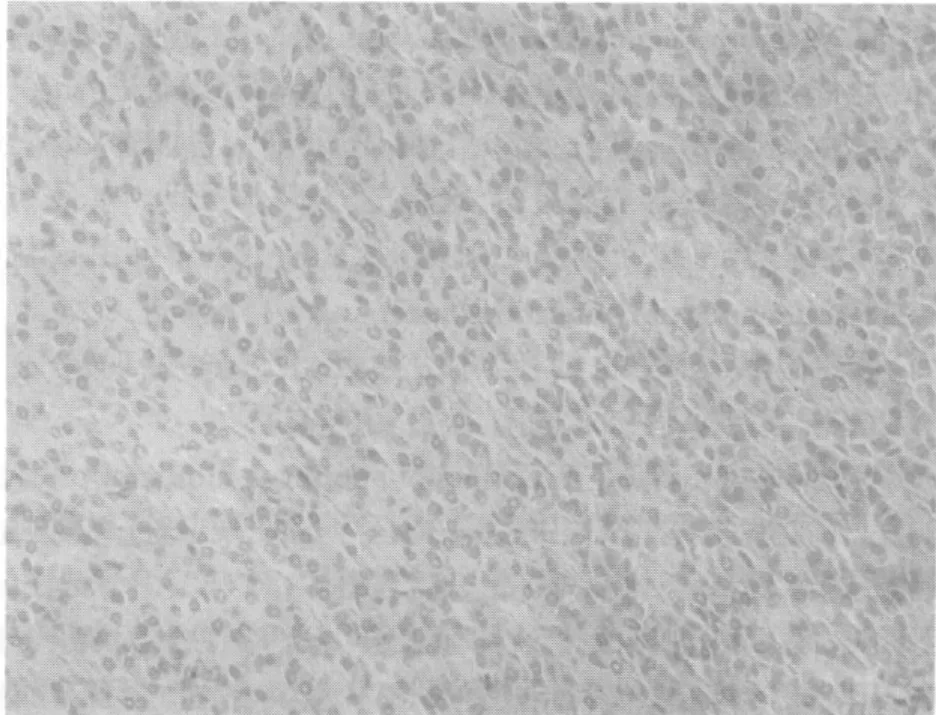
圖3 Survivin在正常胰腺中的表達(SP×200)Fig.3 The expression of Survivin in normal pancreas (SP×200)
2.3 HtrA2/Omi、Survivin之間的相關性分析
胰腺癌組中HtrA2/Omi的陽性表達與Survivin的陽性表達關系不大(r=0.105,P>0.05)(表 3)。

圖4 Survivin在胰腺癌中的表達(SP×200)Fig.4 The expression of Survivin in pancreatic carcinoma (SP×200)
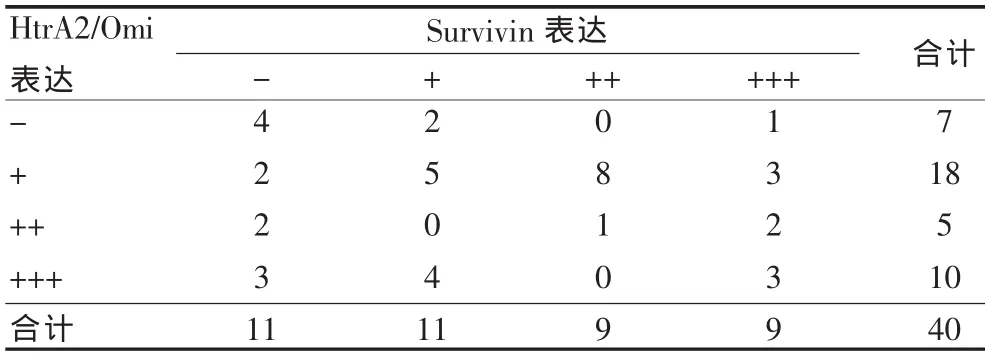
表3 HtrA2/Omi表達與Survivin表達的相關性(例)Tab.3 The correlation between the expression of HtrA2/Omi and Survivin (case)
3 討論
細胞凋亡是多細胞生物為維持自身穩定、調控自身細胞增殖和死亡之間的平衡而由基因控制的細胞自主的有序死亡,這一過程的紊亂與許多疾病的發生、發展有關,尤其與腫瘤的發生、發展關系密切。HtrA2/Omi是一種重要的促凋亡蛋白,是一種寡聚絲氨酸蛋白酶,存在于大部分正常組織器官中,它由458個氨基酸殘基組成,分子量為51 kD,編碼基因位于染色體2q13(或2p12),含有8個外顯子[1]。在最初的研究中發現,當細胞受到凋亡刺激時,HtrA2/Omi可由線粒體膜間隙(mitochondrial intermembrane space)釋放進入細胞質中,接著出現大量的細胞凋亡性死亡,這些現象表明HtrA2/Omi與細胞凋亡之間有著密切的關系[2-3]。
凋亡抑制蛋白家族(inhibitors of apoptosis family of protein,IAPs)是一類有抗凋亡活性的蛋白,至今已發現6個人類IAPs家族成員:XIAP、cIAP1/HIAP2、cIAP2/HIAP1、NIAP、Survivin、BRUCE[4]。IAP 主要有 3個結構域,BIR、RING、CARD 結構域,其中BIR結構域全稱為桿狀病毒IAP重復序列,為IAP抑制細胞凋亡所必需的,所有IAP家族成員至少含有一個BIR,大多數含有3個BIR[5]。Aurvivin是IAP家族中結構獨特的新成員,于1997年由耶魯大學的Smbrosini等[6]用效應細胞蛋白酶受體-1(effector cell protease receptor-1,EPR-1)cDNA在人類基因組庫的雜交篩選中首先分離出來。Survivin與其他IAP成員不同,Survivin單體NH3端只含有一個BIR結構。Survivin表達于胚胎、胎兒組織[7]以及大多數常見的腫瘤組織,如肺、胃、結腸、胰腺、乳腺、肝臟、前列腺以及大約50%的非霍奇金淋巴瘤,但不表達于終末分化的成人組織中[6]。Survivin是迄今發現最強的凋亡抑制因子,Caspase-3作為Caspase家族中最重要的凋亡執行者之一,是多種凋亡刺激信號傳遞的匯聚點,它的活化是凋亡進入不可逆階段的標志[8],Survivin通過一種BIR依賴性的方式與Caspase-3和Caspase-7相結合,并抑制其活性,從而抑制凋亡。Satoh等[9]發現,Survivin在胰腺腫瘤細胞中有表達,在正常胰腺或慢性胰腺炎細胞中不表達,與本研究結果一致。
當細胞受到凋亡刺激時,完整的HtrA2/Omi能進行自我加工,去除N末端133個氨基酸殘基的跨膜部分,形成成熟的HtrA2/Omi[10],并從線粒體膜間隙穿過線粒體膜,到達細胞質中與IAPs結合,從而解除IAPs對Caspases的抑制。同時,HtrA2/Omi對IAPs的抑制作用不僅僅來自于對IAPs的直接結合降解作用,它還可以抑制IAPs蛋白的翻譯[11]。HtrA2/Omi除了通過促進Caspase活化參與細胞凋亡過程外,還可以直接利用其蛋白酶活性發揮促凋亡作用[1]。
在本實驗中發現,HtrA2/Omi、Survivin在胰腺癌中的表達均明顯增高。HtrA2/Omi的表達與胰腺癌的分化、分期相關,在分化差和臨床晚期胰腺癌組織中HtrA2/Omi表達減少,而在腫瘤分化高和臨床早期肝癌組織中結果相反,提示HtrA2/Omi與胰腺癌的發展密切相關,可能促進了胰腺癌細胞的凋亡,其減少或缺失是胰腺細胞發生、發展、浸潤和轉移過程中的一個重要因素。Survivin的表達與性別、年齡、腫瘤部位并無相關性,但在有無遠處轉移、高分化與低分化癌、Ⅰ、Ⅱ期與Ⅲ、Ⅳ期間有顯著差異,表明Survivin在胰腺腫瘤從良性到惡性的轉化中起重要作用,并進一步促進腫瘤發展。以Survivin為靶點治療胰腺癌目前尚處于實驗階段,對基因治療的療效和風險也仍然存在較大爭議,但Survivin特異表達于大多數腫瘤組織這一特點為治療胰腺癌提供了新思路,臨床應用前景樂觀;但在本研究中發現HtrA2/Omi與Survivin關系不大,說明兩者在細胞凋亡通路中,通過不同途徑發揮各自的生物學作用,HtrA2/Omi不作用于Survivin,這與Verhagen等[12]的報道一致,可能與Survivin獨特的結構有關,同HtrA2/Omi無法結合降解。這就需要我們進一步探索能有效抑制Survivin的特異性促凋亡蛋白,促進腫瘤細胞凋亡,為惡性腫瘤的治療提供新途徑,為腫瘤基因治療提供新的可能的靶位。同時,進一步深入研究HtrA2/Omi、Survivin在胰腺癌細胞生長中的作用對胰腺癌的治療有重要意義。
[1]王曉,王瑾,呂小萍,等.線粒體絲氨酸蛋白酶Omi/HtrA2與細胞凋亡[J].生理科學進展,2006,37(3):286.
[2]Garrido C,Kroerner G.Life's smile,death's grin:vital functions of apoptosis-executing proteins[J].Curr Opin Cell Biol,2004,16(6):639-646.
[3]周彩虹,黃啟福.凋亡與腫瘤及其治療進展[J].中國病理生理雜志,2004,20(11):172-181.
[4]紀慶,楊純正.IAP蛋白小分子抑制劑研究進展[J].醫學研究通訊,2004,33(6):30-32.
[5]Crook NE,Clem RJ,Miller LK,et al.An apoptosis-inhibiting baculovirus gene with a zinc finger-like motif[J].J Virol,1993,67(4):2168-2174.
[6]Ambrosini G,Adida C,Altieri DC.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nature Med,1997,(8):917-921.
[7]Adida C,Crotty PL,Mc Grath J,et al.Developmentally regulated expression of the novel cancer anti-apoptosis gene survivin in human and mouse differentiation[J].Am J Pathol,1998,152(1):43-49.
[8]Cryns V,Yuan J.Protease to die for[J].Genes Dev,1998,12(11):1551-1570.
[9]Satoh K,Kaneko K,Hirota M,et al.Expression of Survivin is correlated with cancer cell apoptosis and is involved in the development of human pancreatic duct cell tumors[J].Cancer,2001,92(2):271-278.
[10]Li W,Srinivasula SM,Chai J,et al.Structural insights into the proapoptotic function of mitochondrial serine protease HtrA2/Omi[J].Nat Struct Biol,2002,9(6):410-412.
[11]Holley CL,Olson MR,Colon-Ramos DA,et al.Reaper eliminates IAP proteins through stimulated IAP degradation and generalized translational inhibition[J].Nat Cell Biol,2002,4(6):439-444.
[12]Verhagen AM,Ekert PG,Pakusch M,et al.Identification of DIABLO,a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins[J].Eur J Biochem,2000,267:5699-5710.

