發作間期18F-FDG聯合13N-NH3·H2O PET腦顯像在顳葉內側癲癇術前定位中的價值
陸東燕,高 碩,楊衛東,蔡 莉,李彥生,李偉龍
(天津醫科大學總醫院,天津 300052)
顳葉內側癲癇由于其致癇病因復雜和顳葉內側特殊的病理學改變,80%以上患者對抗癲癇藥耐藥,成為臨床上最常見的難治性癲癇之一。術前致癇灶的精確定位及腦功能區的評價是決定手術成敗的關鍵。18F-FDG PET顯像定位癲癇灶與術中皮層腦電圖(ECoG)和切除標本病理結果具有較高的符合率,定位價值已獲得較多肯定,但目前國內外對PET血流灌注顯像定位癲癇灶的研究較少。本研究回顧性分析17例顳葉內側癲癇患者發作間期18F-FDG與13N-NH3·H2O PET腦顯像圖像,采用感興趣區(ROI)分析法,探討血流聯合代謝PET顯像對顳葉內側癲癇定位診斷的價值。
1 資料與方法
1.1 研究對象
收集2003年10月~2008年12月本院PET/CT中心檢查的頑固性顳葉癲癇患者17例,所有患者均符合1981年國際抗癲癇聯盟的診斷標準及分類,其中男8例,女9例;年齡13~55歲,平均 (34.12±14.20)歲;病程 2~40 年,平均(17.82±11.13)年;發作持續時間數秒至10分鐘不等;發作頻率數次/年至十幾次/天不等。其中復雜部分性發作2例,全面性發作6例,部分繼發全面性發作9例。17例患者均在PET檢查前2周內行腦MRI檢查(5例提示一側海馬異常,余MRI檢查未見異常)和頭皮腦電圖及動態視頻腦電圖檢查。17例患者由術中深部腦電圖(DEEG)及ECoG證實為左顳內側癲癇8例,右顳內側癲癇9例。17例均行Ⅰ期單側海馬、杏仁核、鉤回射頻毀損術,其中14例行Ⅱ期額顳皮層軟膜下橫切術或熱灼術,術后復查腦電恢復正常。所有患者皆隨訪6個月以上,平均18個月。根據Engel療效分級(Ⅰ級:術后無發作;Ⅱ級:極少發作;Ⅲ級:發作較術前減少75%;Ⅳ級:較術前無改善)標準,17例患者術后改善均為Ⅲ級以上。
1.2 PET/CT 檢查
儀器與顯像劑:采用美國GE公司Discovery LS PET/CT儀。18F-FDG合成用GE公司MINItrace回旋加速器及Tracerlab MXFDG合成器完成,放化純>99%。13N-NH3·H2O采用靶內直接還原法制備。
患者檢查前空腹6h以上,靜脈注射13N-NH3·H2O 顯像劑 555~740MBq (15~20mCi)2min 后檢查,結束后休息20min,注射18F-FDG顯像劑222~370MBq(6~10mCi),安靜、暗光條件下休息 40min 后重復檢查。PET掃描參數:3D模式采集,發射掃描采集10min,軸向采集間隔4.25mm,采集層厚5mm。CT掃描參數:峰值電壓為120kV,電流為160mA,螺旋掃描,球管旋轉速度 0.8s/周,床速 15mm/周,螺距 6∶1。圖像融合通過Xeleris軟件進行。
1.3 圖像分析
視覺聯合半定量分析法:17例患者PET圖像均由2位有經驗的核醫學科醫師同時雙盲閱片。除擺位不正及先天性左右不對稱等因素外,連續2幀及2個斷面以上見局限性放射性減低或增高區,判定為異常區[1]。于視覺分析異常區勾畫感興趣區(ROI)測定放射性分布不對稱指數(Aymmetric index,AI),AI=(SUV病灶ROI-SUV對側ROI)/(SUV病灶ROI+SUV對側ROI)×200%。AI>15%視為異常。聯合兩種顯像劑顯像結果綜合分析,定位標準:兩種顯像結果定位一致時共同定位。若不一致,當一種顯像劑顯像結果為陽性而另一種的顯像結果為陰性時依據陽性結果定位;若一種顯像結果可以定側而另一種未能定側時亦定側為單側病變;若兩種顯像結果定側相反時不能定側。
1.4 統計學處理
采用SPSS 11.5軟件,對兩種顯像方法的一致性檢驗采用Kappa檢驗,定位準確性比較采用Mc-Nemar檢驗,兩種顯像方法所測AI值進行配對t檢驗,以P<0.05為有統計學意義。
2 結果
見表1。
2.1 18F-FDG PET 顯像

表1 17例顳葉內側癲癇患者18F-FDG、13N-NH3·H2O PET 顯像結果
17例癲癇患者18F-FDG PET顯像對癲癇灶準確定側12例(70.6%),其中3例表現為單側顳葉內側海馬區高代謝,9例表現為同側顳葉內側海馬區和/或顳葉外側皮層低代謝。準確定位5例(29.4%),其中3例表現為單側顳葉內側海馬區高代謝,2例表現為單側顳葉內側海馬區低代謝。未能正確定位5例(5/17),其中4例定側錯誤,1例右側頂葉、右側小腦代謝減低。
2.2 13N-NH3·H2O PET 顯像
17例癲癇患者13N-NH3·H2O PET顯像對癲癇灶準確定側9例(52.9%),其中3例表現為單側顳葉內側海馬區或顳葉外側皮層高灌注,6例表現為單側顳葉內側海馬區和/或顳葉外側皮層低灌注。準確定位4例(23.5%),其中2例癲癇灶側海馬區低灌注,2例海馬區高灌注。未能正確定位8例,其中2例定側錯誤,6例雙側海馬區血流灌注均增高,無明顯差異(AI<15%)。
2.3 18F-FDG、13N-NH3·H2O PET 顯像綜合分析
綜和分析17例癲癇患者18F-FDG與13N-NH3·H2O PET顯像結果,對癲癇灶準確定位8例(47.1%):2 例代謝、血流顯像結果一致(圖 1);3 例依據代謝顯像定位,血流顯像未能定位;2例代謝顯像未能定位,依據血流顯像定位;1例左顳葉內、外側皮層代謝均減低(海馬區AIFDG為15.95%,外側皮層AIFDG為15.47%),雙側海馬區血流灌注增高(AINH3為3.36%),致癇灶定位為左側海馬區(圖2)。
2.4 統計學分析
18F-FDG、13N-NH3·H2O PET 兩種顯像方法對癲癇灶定側性能具有中度一致性 (Kappa=0.638,P=0.005),定側準確性經 McNemar檢驗,P=0.250>0.05,差異無統計學意義。兩種顯像方法ROI所測顳葉內側海馬區平均 AIFDG為 (13.94±8.29)%,AINH3為(10.18±8.29)%,經配對 t檢驗 P=0.150>0.05,差異無統計學意義;顳葉外側皮層平均AIFDG為(14.59±7.97)%,AINH3為(10.89±10.03)%,經配對 t檢驗 P=0.134>0.05,差異無統計學意義。
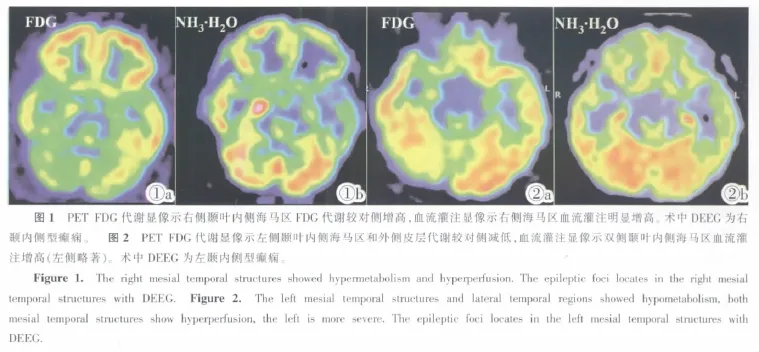
3 討論
目前18F-FDG PET已被公認為頑固性癲癇術前較好的無創性定位方法[2],尤其對于腦MRI檢查未見異常的癲癇患者價值更大[3]。癲癇發作期癲癇灶反復的、過度的超同步化放電,是一個顯著的耗能過程,因此癲癇灶局部或相關腦區局部腦血流量、局部腦葡萄糖利用率成倍增加,PET顯像表現為局灶性放射性增高,發作后短期內(1~15min)細胞膜靜電位延長和細胞膜內外化學物質恢復平衡也是耗能過程,局部也可能表現為放射性增高。而隨后的發作間期無額外耗能,癲癇灶的特征表現為低代謝低血流灌注,其機制并不十分清楚,一般認為是由于癲癇灶神經元缺失和皮層萎縮所致。由于發作期成像條件苛刻、費時耗力,臨床多進行發作間期顯像。70%~90%的顳葉內側癲癇患者表現為發作間期致癇灶側顳葉FDG代謝減低,少數也可表現為局部代謝增高,本研究中所有患者均為發作間期顯像,但亦發現有癲癇灶高代謝表現者,考慮為亞臨床發作或“發作后效應”所致[4]。采用ROI視覺聯合半定量法對顳葉內側癲癇定側準確性可達69%~90%[5]。本研究17例顳葉內側癲癇患者18F-FDG PET腦顯像ROI法準確定側12例 (70.6%),具有良好的定側價值。而MRI檢查僅5例(29.4%)發現一側海馬區異常,定位準確性明顯低于18F-FDG PET檢查。
腦血流灌注顯像目前最常用的是SPECT血流顯像,癲癇灶通常表現為發作間期血流灌注減低,但有時表現為全腦血流灌注未見異常、復雜多發腦區血流灌注減低、癲癇灶對側或雙側血流灌注減低,諸多不確定因素使得單獨發作間期血流灌注顯像定位價值受到爭議[5]。本研究選擇13N-NH3·H2O PET腦灌注顯像,靈敏性、分辨率要高于SPECT,顯影清晰,具有良好的信噪比。13N-NH3·H2O為脂溶性,可經自由擴散的方式通過血腦屏障進入腦組織,首次通過攝取率接近100%,洗脫很慢,半衰期為60~70min,提供腦組織微血管分布和血流灌注信息,因腦血流灌注變化靈敏,可以反應癲癇灶較短時間內的狀態,較代謝顯像提供更多的信息幫助定位。本研究17例顳葉內側癲癇患者13N-NH3·H2O PET顯像,ROI法準確定側9例(52.9%),高于Ohta等[6]報道的顳葉內側癲癇患者 [15O]H2O PET顯像定側準確性SPM法為27.3%(3/11)、ROI法為 36.4%(4/11),他們提出發作間期血流灌注PET顯像似乎難以單獨應用于癲癇灶定側。本研究對血流及代謝顯像結果進行比較,發作間期13N-NH3·H2O PET顯像定側準確性(52.9%)低于18F-FDG PET顯像(70.6%)。兩種顯像劑定側性能經 Kappa 檢驗(Kappa=0.638,P=0.005),具有中度一致性,定側準確性經McNemar檢驗(P=0.250>0.05),差異無統計學意義。顳葉內側海馬區及外側皮層平均 AIFDG與 AINH3經配對 t檢驗(P>0.05),差異無統計學意義。說明癲癇灶的局部腦血流改變與局部葡萄糖代謝率改變一致,血流灌注顯像對于顳葉癲癇灶的定位能力亦是肯定、有效的。但因樣本量較小,仍需擴大樣本進一步研究證實。
近年有研究報道癲癇灶腦血流和葡萄糖代謝并不總是緊密相關,有時存在明顯不一致現象。Lee等[7]研究了顳葉癲癇發作間期血流、葡萄糖代謝不匹配現象,發現血流、代謝異常部位基本一致,但低灌注的范圍明顯小于低代謝范圍,癲癇灶的低代謝不僅對應低灌注亦可表現為灌注正常或高灌注。本研究17例患者中5例表現為癲癇灶低代謝、高灌注。這種低代謝、高灌注表現可能對癲癇灶有更高的特異性,為定位提供幫助。推測造成這種血流、代謝不匹配的原因可能有:①發作間期癲癇灶的棘波發放(亞臨床發作)常可以導致血流、代謝增加,因腦對18F-FDG的攝取需40min左右才能平衡,18F-FDG PET顯像代表了癲癇灶一個相對較長時間的狀態,而13N-NH3·H2O PET顯像反應的是一個較短時間內的狀態,癲癇灶亞臨床發作的高灌注表現較高代謝更多見。②癲癇發作后常可以持續數十分鐘至數小時血流高灌注狀態,被稱為“發作后效應”[7]。而這種發作間期血流高灌注常使癲癇灶低代謝變為代謝正常,但“發作后效應”高代謝表現亦有過報道[8]。因代謝、血流不匹配現象,代謝、血流顯像優勢互補,本研究聯合兩種顯像方法綜合分析的定位準確性(47.1%)較單獨18F-FDG(29.4%)或13N-NH3·H2O(23.5%)PET 顯像高,說明聯合代謝、血流顯像更有助于癲癇灶定位。
總之,發作間期18F-FDG PET顯像對顳葉內側癲癇定側有較高的準確性。13N-NH3·H2O PET腦血流顯像定側顳葉癲癇灶的能力與18F-FDG代謝顯像具有中度一致性,初步肯定了13N-NH3·H2O PET定位癲癇灶的臨床應用價值。當聯合兩種顯像劑顯像時,優勢互補,定位準確性明顯提高,且癲癇灶低代謝、高灌注表現使診斷特異性增加,更有助于顳葉癲癇灶準確定位。通過分析同一癲癇灶的血流及代謝變化,為臨床評估癲癇灶提供了更有價值的影像學特征。
[1]吳湖炳,王全師,王明芳,等.18F-FDG PET顯像對致癇灶的定位及在外科治療中的價值[J]. 中華核醫學,2006,26(2):69-72.
[2]Mastin ST,Drane WE,Gilmore RL,et al.Prospective localization of epileptogenic foci:comparision of PET and SPECT with site of surgery and clinical outcome[J].Radiology,1996,199(2):375-380.
[3]Uijl SG,Leijten FS,Arends JB,et al.The added value of[18F]-Fluoro-D-deoxyglucose positron emission tomography in screening for temporal lobe epilepsy surgery[J].Epilepsia,2007,48(11):2121-2129.
[4]Kim YK,Lee DS,Lee SK,et al.Differential features of metabolic abnormalities between medial and lateral temporal lobe epilepsy:quantitative analysis of18F-FDG PET using SPM[J].J Nucl Med,2003,44(7):1006-1012.
[5]Henry TR,Duncan JS,Berkovic SF,et al.PET:cerebral blood flow and glucose metabolism presurgical localization[J].Advances in neurology,2000,83:105-120.
[6]Ohta Y,Nariai T,Ishii K,et al.Voxel- and ROI-based statidtical analyses of PET parameters for guidance in the surgical treatment of intractable mesial temporal lobe epilepsy[J].Ann Nucl Med,2008,22(6):495-503.
[7]Lee DS,Lee JS,Kang KW,et al.Disparity of perfusion and glucose metabolism of epileptogenic zones in temporal lobe epilepsy demonstrated by SPM/SPAM analysis on15O water PET,[18F]FDG-PET,and[99mTc]-HMPAO SPECT[J].Epilepsia,2001,42(12):1515-1522.
[8]Leiderman DB,Albert P,Balish M,et al.The dynamics of metabolic change following seizures as measured by positron emission tomography with fluorodeoxyglucose F-18[J].Arch Neurol,1994,51(9):932-936.

