IL-25與支氣管哮喘
西安交通大學醫學院第二附屬醫院呼吸內科(西安 710004)張秋紅 綜述 李雅莉 審校
支氣管哮喘是由多種細胞 (如 EOS、肥大細胞、T淋巴細胞、中性粒細胞、氣管上皮細胞等)和細胞組分參與的氣管慢性炎癥性疾病,是呼吸系統的常見病和多發病。全球約有 3億患者,約 40%的患者有家族史。哮喘發作影響患者的生活質量,并帶來沉重的經濟負擔。由于哮喘病因及發病機制尚不完全清楚,故尚無特效的治療方法。哮喘炎癥反應是由多種炎癥細胞、炎癥介質和細胞因子參與和相互作用的結果,關系復雜,需進一步研究。目前圍繞哮喘患者 Th1/Th2細胞因子分泌失衡的研究居多。多項研究顯示 IL-25誘導 Th2類型細胞因子產生,促進嗜酸性粒細胞(EOS)向氣道募集、粘液過多分泌、上皮細胞增生肥大,導致血清中 Ig E水平增加,引起氣管高反應性(AHR),與支氣管哮喘的發生密切相關。現就 IL-25的來源與結構、生物學作用及誘導哮喘發生的可能機制等進行簡單的介紹,并在基本結構方面與 IL-17家族其他成員進行簡單的橫向比較。
1 IL-25結構及其來源 IL-25是 Lee等[1]首先報道命名為 IL-17E,為 IL-17家族的新成員,應用逆轉錄聚合酶鏈反應檢測到 IL-17E在腦、腎、肺、前列腺、睪丸、脊髓、腎上腺、氣管存在低水平表達。同時 Fort等[2]發現了由 Th2細胞產生、結構與 IL-17存在相似的細胞因子,命名為 IL-25,在 NCBI表達序列標簽(EST)數據庫中進行了 BLAST搜索,找到一段與 IL-17有顯著同源性的 EST序列,利用反向遺傳學的方法克隆了 IL-25的基因。鼠 IL-25cDN A全長 985bp,內含一個長 507bp的開放閱讀框,編碼 169個氨基酸殘基,分子量 17.5kDa。人 IL-25定位于 14q11.2,其 cDN A全長 3987bp,內含一個 483bp的開放閱讀框,編碼 161個氨基酸殘基,分子量 16.7kDa。鼠 IL-25與人 IL-25具有 80%的同源性[2]。
IL-17家族最早于 1995年[3]發現了第一個成員 IL-17(IL-17A),此后在 2000年至 2002年期間共發現了其他 5個成員(IL-17B-F)[1,4~7]。這個特殊的細胞因子家族 ,其成員在結構上與 IL-17A相比,IL-17F與其同源性最高(50%)[6,7]、IL-17B(29%)[4]、 IL-17D(25%)[5]、IL-17C(23%)[4],而 IL-17E(IL-25)最少 (17%)[1,2]。IL-25主要來源于向 Th2細胞極化的 T細胞[2]和骨髓源性肥大細胞[8],Angkasekwinai等[9]研究發現經變應原刺激后肺上皮細胞及肺泡巨噬細胞亦可表達 IL-25。而IL-17A來源于外周血活化的 CD4+記憶 T細胞[3,10]和 CD8+記憶 T細胞[10,11];IL-17B和 IL-17C表達于多種組織[4],但其細胞來源目前尚不清楚;IL-17D來源于靜止期 CD4+T細胞和CD19+B細胞[5];IL-17F來源于活化的 CD4+T細胞和單核細胞[6]。
2 IL-25受體 IL-17家族第一個被確定身份的受體為IL-17R[12],其定位于染色體 22q11.1,IL-17R是Ⅰ類跨膜蛋白,其胞外區域由 293個氨基酸組成,由 21個氨基酸組成跨膜區域,另有一長達 525個氨基酸片段組成胞質尾區。在人類細胞中,IL-17R mRNA于上皮細胞、成纖維細胞、B/T淋巴細胞、骨髓單核細胞及骨髓間質細胞中均可檢測到[13]。IL-17F與 IL-17A有著高度的同源性,利用腺病毒轉染技術,在小鼠氣管內過表達 IL-17F同樣也導致支氣管肺泡灌洗液中中性粒細胞數量增加,與 IL-17A相似可誘導 G-CSF、CXCL8產生[14],或許IL-17F也依賴 IL-17R進行信號轉導,但 Hymowitz等[7]采用表面等離子體共振技術未發現 IL-17F與 IL-17R可以結合的證據。最新研究發現 IL-17C的受體為 IL-17RE,IL-17D的受體目前尚不清楚[15]。 IL-17B與 IL-17RB具有低親和力[1],IL-17RB具體結構及來源將在下文中闡述。
IL-25受體為 IL-17RB/EV I27,因與 IL-17R同源,亦被稱為 IL-17Rh1[1,16]。 IL-17RB定位于染色體 3p21.1[17],Webb[18]等報道染色體片段 3p21周圍區域與過敏性疾病有關。IL-17RB分子量為 56kDa,為Ⅰ類跨膜蛋白,編碼 502個氨基酸,與 IL-17R有 26%的同源性[1]。 RN A和蛋白質分析顯示 IL-17BR存在兩種亞型:膜結合型和可溶型[16]。 Lee等[1]用 Northern印跡法于肝臟、腎臟、腦、結腸、小腸、骨骼肌中檢測到 IL-17RB,且定量 PCR提示在肝臟和腎臟 IL-17BR存在高表達。Angkasekwinai等[9]研究發現 IL-17BR在原始 T細胞中有表達,在 Th2細胞中持久表達,Wang等[19]發現在人記憶 Th2細胞中 IL-17BR表達增加。 Jung等[20]研究分析了 IL-17RB基因多態性,提示頻率較小的 IL-17BR+5661G/A的 A等位基因有對抗支氣管哮喘發展的顯性保護性遺傳效應。
3 IL-25的生物學作用
3.1 誘導 IL-4、 IL-5、IL-13、 Eotaxin產生 Fort等[2]將野生型小鼠分為腹膜腔內注射純化 IL-25蛋白組及灌注生理鹽水對照組,10d后對實驗小鼠的臟器組織利用定量 PCR法檢測分析細胞因子 mRNA的含量。在 IL-25蛋白處理組小鼠中發現 IL-13mRNA在脾臟、胃、小腸、腎臟、肝臟、肺、結腸組織中均有表達;IL-4mRNA及 IL-5mRN A在脾臟中有著明顯的高表達,但在其他組織中變化較大;IL-6mRN A及嗜酸細胞活化趨化因子(Eotaxin)在脾臟、胃及小腸的表達水平增加,與鹽水對照組進行統計學分析均有顯著性差異。同時檢測 IL-25蛋白處理組的 IL-1 α、 TN F-α、IL-10及 INF-γ的表達 ,與對照組相比無顯著性差異。Lee等[1]研究證實對 IL-25蛋白產生應答,誘導 IL-5、IL-13表達的是一組 non-T/non-B譜系陰性的細胞群。 Sharkhuu等[21]發現,BALB/c小鼠肺組織細胞或支氣管周圍淋巴結(Peribronchial lymph nodes,PBLN)體外暴露于 IL-25環境中 24h后,在肺細胞培養上清液中可檢測到 IL-4、IL-5、IL-13表達增加,在 PBLN細胞培養上清液中檢測到 IL-5、IL-13、Eotaxin和 精氨酸(Arg-I)表達增加,第 8天時檢測 Th2類細胞因子水平仍高,第 16天時 IL-5及 IL-13水平仍高于對照組。Hurst等[14]利用腺病毒轉染技術將 IL-25鼻內給藥,于小鼠肺組織和支氣管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)均檢測到 IL-4、 IL-5、 IL-13和 Eotaxin。
3.2 IL-25對核轉錄因子 N F-κ B的作用 NF-κB在刺激T細胞抗原受體(TCR)后的信號傳導通道中起作用,是一個重要的核內轉錄因子。 Lee等[1]研究發現在腎癌細胞中 IL-25可以活化 NF-κ B。 IL-25R的胞質尾區存在腫瘤壞死因子受體相關因子 6(Tumor necrosis factor receptor-associated factor6,TRAF6)結合基序。 Maezawa等[22]研究發現 IL-25R信號轉導與 TRAF6有關。T RAF家族蛋白含有一個與其他同源受體或細胞之間信號蛋白相互作用的 TRAF-C功能域,而 T RAF6的TRAF-C域的肽基序有著獨特的特點,其結構為 X-X-Pro-XGlu-X-X-(芳香 /酸性氨基酸殘基),TRAF6結合基序在銜接蛋白例如 IL-1R相關激酶 (IL-1R-associated kinase,IRAK-1)和TRAF相互作用蛋白(T RAF-interacting protein,TIFA),以及膜 結合蛋白例如 CD40和 N F-κ B受體活化因子 (Receptor activator of N F-κB,RANK)中存在,更重要的是在人和鼠的IL-25R中存在。研究發現,IL-25R介導 N F-κ B以及細胞外信號調節激酶 ERK、JN K和 p38的活化,同時發現顯性失活的TRAF6的表達抑制 IL-25R活化 NF-κ B。 在 TRAF6-/-小鼠的成纖維母細胞中 ,IL-25R對 NF-κB的活化降低 ,同時發現 IL-25R介導的 IL-6、TGF-β、G-CSF和胸腺活化調節趨化因子(Thymus and activation-regulated chemokine,TARC)的表達亦降低。另外,共免疫沉淀法提示 TRAF6與 IL-25R除了直接的配體依賴方式 ,還存在配體非依賴方式。總之,TRAF6在 IL-25R介導的 NF-κ B活化和基因表達中扮演著重要的角色。
3.3 IL-25其他可能誘導 Th2細胞因子產生的機制 轉錄因子 GATA-3通過 3種不同的機制促進 Th2效應[23]:① 促進 Th2細胞因子的生成;②Th2細胞選擇性生長;③抑制 Th1細胞特異性因子。Angkasekwinai等[9]研究發現 IL-25通過 IL-4和 STAT6依賴方式促進 Th2細胞分化和 GAT A-3表達。而IL-25又可通過活化 N FATc1(Nuclear factor of activated T cells,cytoplasmic 1)和 JUNB誘導早期 IL-4的表達。 Claudio等[24]發現 IL-25R胞質尾區包含一個 SEFIR域,可以結合銜接蛋白 CIKS(Act1),Act1-/-的小鼠對 IL-25無反應,提示銜接蛋白 CIKS(Act1)對 IL-25介導的變態反應性疾病是必需的。Wang等[19]發現胸腺間質淋巴細胞生成素 (Thymic stromal lymphopoietin,TSLP)為類似 IL-17的細胞因子,支氣管上皮細胞 TSLP的強表達可以活化樹突細胞(Dendric cell,DC)表達 Th2細胞極化信號、OX40配體。經過 TSLP-DCs的刺激之后,被活化的 Th2記憶細胞可以上調 IL-25R轉錄本和表面蛋白的表達。IL-25可協同 TSLP-DCs通過上調轉錄因子 GAT A-3、c-M AF和 JUNB的表達刺激 Th2記憶細胞增殖、Th2細胞極化和細胞因子的產生。
4 IL-25與支氣管哮喘 支氣管哮喘是一種變應性氣管炎癥疾病,以氣管內大量 EOS和 CD4+T細胞浸潤、黏液分泌過多、氣管高反應性、氣管重塑和 Ig E產生為特征。多項研究顯示抗原誘導的變應性氣管炎癥主要是由 Th2細胞及其細胞因子 IL-4、IL-5、IL-13介導,IL-5介導致敏小鼠經抗原誘導產生的 EOS向氣管內募集。 IL-13是誘導杯狀細胞增生、氣管重塑和氣管高反應性的關鍵因子。IL-4可促使原始 Th0細胞向 Th2細胞分化,也誘導 B細胞分化成熟,促進 IgE的合成[25,26]。
Fort等[2]實驗研究中 IL-25處理組小鼠除了 IL-4、IL-5、IL-13表達增加外,同時發現其血 EOS增多 ,血清 IgE水平增高,肺組織的組織切片發現 EOS及單核細胞浸潤、黏液產生過多、上皮細胞增生肥大。Sharkhuu等[21]其實驗研究中同樣也發現 IL-25可以導致 AHR、EOS炎癥、黏液分泌增加、Th2細胞因子進行性增加及 Arg-Ⅰ和 Eotaxin增加。同時用 IL-25處理IL-13-/-、 IL-4R α-/-及 ST AT6-/-小鼠 ,發現 AHR明顯減輕、黏液分泌減少、肺組織 EOS增多雖減輕但仍明顯;而 IL-4-/-、IL-5/eotaxin-/-的缺陷小鼠,用 IL-25處理后,AHR被抑制,但是粘液分泌分泌未被完全抑制。實驗結果表明,單劑量 IL-25可有效誘導持續性 AHR和急性伴隨 EOS增多的肺部炎癥。IL-25誘導 AHR依賴于 Th2細胞因子的產生,移除 IL-13和其信號轉導通路可阻止 IL-25誘導的氣管炎癥和 AHR。IL-25通過促進 Th2細胞因子應答和上調 Arg-Ⅰ及 Eotaxin產生級聯效應,加重氣管炎癥。 Tamachi等[25]在其研究中證實經變應原吸入而致敏的小鼠肺組織中發現 IL-25mRNA的表達,用 sIL-25R中和 IL-25后減少了 EOS及 CD4+T細胞向氣道內募集。Ballantyne等[27]制備了 IL-25單克隆抗體,中和封閉 IL-25,有效抑制了哮喘模型小鼠的 AHR。
迄今為止,關于 IL-25參與支氣管哮喘發生的研究報道較多,推測其 IL-25促進 Th2型免疫反應可能的機制[28]為:活化的 Th2細胞和肥大細胞產生 IL-25;在 IL-25總量充足的情況下,其直接作用于一種譜系陰性的抗原呈遞細胞(未明確的細胞 A),產生 Th2細胞因子引起變應性炎癥;在 IL-25總量受限的情況下,其可能通過未明確的細胞 B產生趨化因子 TARC誘導抗原特異性 CD4+T細胞募集,然后增強 CD4+T細胞介導的變應性炎癥(見附圖)。
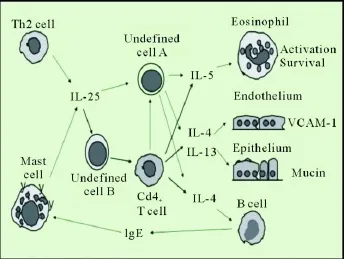
附圖 IL-25介導 Th2型免疫應答可能機制
5 展望 迄今為止 ,關于 IL-25的基本結構、細胞來源、受體結構、生物學作用及與哮喘發生可能的機制方面都有了比較深入的研究,所有研究的最終目的都是希望可以為臨床哮喘治療提供一定的依據。 Ballantyne等[27]成功制備了鼠 IL-25單克隆抗體,作用于支氣管哮喘模型小鼠,發現其在致敏階段、激發階段甚至 Th2炎癥反應階段都可以中和 IL-25,阻斷其與受體的結合,有效的減輕 AHR。這為臨床以 IL-25作為哮喘治療靶點提供了有力證據。目前關于 IL-25應答細胞及確切的信號轉導機制仍需進一步研究明確,以助更深入的了解 IL-25與支氣管哮喘,甚至與變態反應性疾病的作用關系,為臨床治療學提供新的策略。
[1]Lee J,Ho W H,Maruoka M,et al.IL-17E,a novel proinflammatory lingand for the IL-17 receptor homolog IL-17Rh1[J].J Biol Chem,2001,276(2):1660-1664.
[2]Fort MM,Cheung J,Yen D,et al.IL-25induces IL-4,IL-5,and 13 and Th2-associated pathologies in vivo[J].Immunity,2001,15(6):985-995.
[3]Yoo ZB,Painter SL,Fanslow W C,et al.Human IL-17:a novel cytokine derived from T cells[J].J Immunol,1995,155(12):5483-5486.
[4]LiHZ,Chen J, Huang A,et al.Cloning and characterization ofIL-17B and IL-17C, two new members of the IL-17 cytokine family[J].Proc Natl Acad Sci USA,2000,97(2):773-778.
[5]Starnes T,BroxmeyerHE,Robertson M J,et al.Cutting edge: IL-17D,a novel member of the IL-17 family,stimulates cytokineproduction and inhibits hemopoiesis[J].J Immunol,2002,169(2):642-646.
[6]Starnes T,Robertson M J,Sledge G,et al.Cutting edge:IL-17F,a novel cytokine selectively expressed in activated T cells and monocytes,regulates angiogenesis and endothelialcellcytokine production [J]. J Immunol,2001,167(8):4137-4140.
[7]Hymowitz SG,Filvaroff EH,Yin JP,et al.IL-17s adopt a cystine knot fold:structure and activity of a novel cytokine,IL-17F,and implications for receptor binding[J].EM BO J,2001,20(19):5332-5341.
[8]Ikeda K,Nakajima H,Suzuki K,et al.Mast cells produce interleukin-25 upon Fc epsilon RI-mediated activation[J].Blood,2003,101(9):3594-3596.
[9]AngkasekwinaiP,Park H,Wang YH,et al.Interleukin 25 promotes the initiation of proallergic type 2 responses[J].J Exp Med,2007,204(7):1509-1517.
[10]Ferretti S,Bonneau O,Dubois GR,et al.IL-17,produced by lymphocytes and neutrophils,is necessary for lipopolysaccharide-induced airway neutrophilia:IL-15as a possible trigger[J].J Immunol,2003,170(4):2106-2112.
[11]Happel KI,Zheng MQ,Young E,et al.Cutting edge:roles of Toll-like receptor4 and IL-23 in IL-17 expression in response to Klebsiella pneumoniae infection[J].J Immunol,2003,170(9):4432-4436.
[12]Yao ZB,Fanslow WC,Seldin MF,et al.Herpesvirus saimiri encodes a new cytokine,IL-17,which binds to a novel cytokine receptor[J].Immunity,1995,3(6):811-821.
[13]Silva W A,Covas DT,Panepucci RA,et al.The profile of gene expression of human marrow mesenchymal stem cells[J].Stem Cells,2003,21(6):661-669.
[14]Hurst SD,Muchamuel T,Gorman DM,et al.New IL-17family members promote Th1or Th2responses in the lung:in vivo function of the novel cytokine IL-25[J].J Immunol,2002,169(1):443-453.
[15]Gaffen SL. Structure and signalling in the IL-17 receptor family[J].Nat Rev Immunol,2009,9(8):556-567.
[16]Gratchev A,Kzhyshkowska J,Duperrier K,et al.The receptor for interleukin-17E is induced by Th2cytokines in antigen-presenting cell[J]. Scand J Immunol,2004,60(3):233-237.
[17]Shi YG,Ullrich SJ,Zhang J,et al.A novel cytokine receptor-ligand pair: identification, molecular characterization,and invivo immunomodulatory activity[J].J Biol Chem,2000,275(25):19167-19176.
[18]Webb BT,Van-Den-Oord E,AkkariA,et al.Quantitative linkage genome scan for atopy in a large collection of caucasian families[J].Hum Genet,2007,121(1):83-92.
[19]Wang YH,Angkasekwinai P,Lu N,et al.IL-25 augments type2immune responses by enhancing the expansion and functions ofTSLP-DC-activated Th2 memory cells[J].J Exp Med,2007,204(8):1837-1847.
[20]Jung JS,Lae Park B,Sub Cheong H,et al.Association of IL-17RBgene polymorphism with asthma[J].Chest,2009,135(5):1173-1180.
[21]Sharkhuu T,Matthaei KI,Forbes E,et al.Mechanism of interleukin-25 (IL-17E)-induced pulmonary inflammation and airways hyper-reactivity[J].Clin Exp Allergy,2006,36(12):1575-1583.
[22]Maezawa Y, Nakajima H, SuzukiK,etal.Involvement of TNF receptor-associated factor6in IL-25 receptor signaling[J].J Immunol,2006,176(2):1013-1018.
[23]Zhu JF,Yamane H,Cote-Sierra J,et al.GAT A-3 promotes Th2responses through three different mechanisms:induction of Th2cytokine production,selective growth of Th2cells and inhibition of Th1cellspecific factors[J].Cell Res,2006,16(1):3-10.
[24]Claudio E,Sonder SU,Saret S,et al.The adaptor protein CIKS/Act1 is essential for IL-25-mediated allergic airway inflammation[J].J Immunol,2009,182(3):1617-1630.
[25]TamachiT,Maezawa Y,Ikeda K,et al.IL-25 enhances allergic airway inflammation by amplifying a Th2 cell-dependent pathway in mice[J].J Allergy Clin Immunol,2006,118(3):606-614.
[26]Nakajima H,Takatsu K.Role of cytokines in allergic airway inflammation[J].Int Arch Allergy Immunol,2007,142(4):265-273.
[27]Ballantyne SJ,Barlow JL,Jolin HE,et al.Blocking IL-25prevents airway hyperresponsiveness in allergic asthma[J].J Allergy Clin Immunol,2007,120(6):1324-1331.
[28]Tamachi T,Maezawa Y,Ikeda K,et al.Interleukin 25in allergic airway inflammation[J]. IntArch Allergy Immunol,2006,140(Suppl 1):59-62.

