錳基化合物在化學電源中的優勢與潛力(Ⅱ)
夏 熙
(新疆大學應用化學研究所,新疆烏魯木齊 830046)
2.5 MnO2在非水溶液中的可充性
γ-MnO2在非水溶液嵌脫 Li+與在水溶液中嵌脫H+恰恰相反,一般應有最大的有序,即缺陷結構參數小,Mt→0,或Pt→0。如在 Li/MnO2電池中,將 EMD加熱處理脫水成為 HEMD,生成β/γ-MnO2,接近β-MnO2而呈有序化[29]。
α-MnO2在嵌 Li電池中是研究的熱點之一。因為α-MnO2具有[2×2]隧道結構,甚或[3×3]隧道結構,可能用于嵌Li+。為了嵌Li+,有一系列制備α-MnO2的方法:早期的M n2+氧化,M n2O3在H2SO4中的岐化;Li2MnO3在酸中處理,目的是制得不含K+、Ba2+等雜離子的、含水量大的α-MnO2?0.15H2O,因為它具有較高的熱穩定性(490 ℃)。顯然,水分子能取代雜離子并在隧道中穩定α-MnO2的結構。NH3分子與水分子的大小相近、鍵合性質相似,因而用NH3氣在低溫下處理,可制備在隧道中由NH3與H+形成NH4+、穩定 α-MnO2結 構 的 NH3-α-MnO2;用 水 化 型 α-MnO2?0.15H2O與 LiOH混合、干燥、在300℃下燒結,形成 Li2O-α-MnO2;用 NH3與 Li2O 混合,形成 Li2O-NH3-α-MnO2。 這些不同的隧道分子的α-MnO2,在電解液為1 mol/L LiPF6/EC+DMC(1∶1)的 Li/MnO2電池中,以 0.2 mA/cm2在3.8~2.0 V循環,初始放電比容量均超過220 mAh/g,Li2O-NH3-α-MnO2、Li2O-α-MnO2、NH3-α-MnO2與α-MnO2?0.15H2O 第20次循環的放電比容量分別為223 mAh/g、188 mAh/g、167 mAh/g和123 mAh/g。前3種α-MnO2的放電曲線并無下降趨勢,即改善了α-MnO2的循環性能[30-31]。
層狀結構δ-MnO2可由 Li2MnO3潷析出而得到 Li2O,組成 Li/δ-MnO2電池,以0.2 mA/cm2在3.6~2.4 V 充放電,初始比容量約為200 mAh/g,在第8次循環時,放電比容量只有 140 mAh/g左右,衰減迅速[32]。
三維網狀結構的λ-MnO2。美國曾擬制備 Li/λ-MnO2電池取代Li/SO2電池,在部隊中使用。因為它有較好的低溫性能,且在高電位區優于 Li/HEMD(β/γ-MnO2)電池,特別是4 V平臺對低溫性能有利[33]。作為二次電池,λ-MnO2的放電易發生多相變化,因此未見實用化。
2.6 MnO2與錳氧化物的應用拓展
從圖1可知,各類MnO2的互變及各種錳基原料,如Mn2+化合物、MnO2、Mn2O3和Mn3O4,都可制備EV 和HEV用鋰離子電池的正極活性材料,如尖石晶型、層狀及層狀化合物的復合材料,引人關注。
主要的錳基鋰離子電池正極材料基本的物理參數和電化學性能如表1所示。
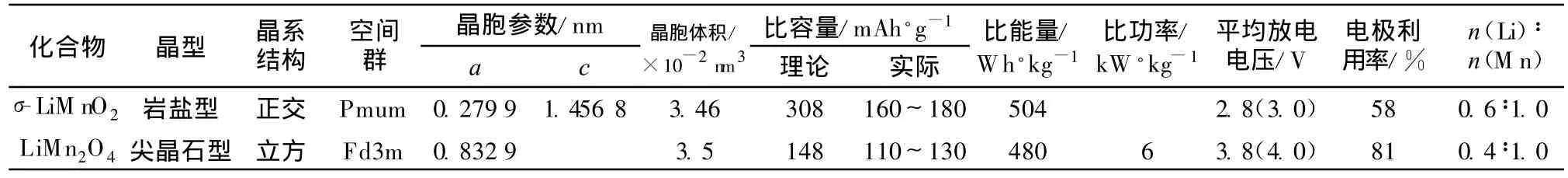
表1 錳基鋰離子電池正極活性材料的物理參數和電化學性能Table 1 Physical parameters and electrochemical performance of Mn-based positive electrode active material for Li-ion battery
材料必須具備單一的物相,良好的一致性,均勻的顆粒形態,并有亞微細粒甚或超微的粒子分布,以及大的比表面積。影響其本征性質的是粒子的形狀,尺寸(粒徑),取向、空隙、晶粒間界有大的原子分數。這就需要調整制備的條件。同樣的制備方法可能有不同的效果。
2.6.1 LiMn2O4的優勢與存在的問題
LiMn2O4具有尖晶石型三維網絡結構。Li+占據四面體(8a)的晶格點,Mn離子占據八面體(16d)的晶格點,氧處于32e晶格點,呈敞開式立方密堆積排列。在M n2O4構架中,晶隙空間可視為四面體8a位置起著Li+遷移嵌脫的通道,因此LiMn2O4具有適宜用作鋰離子正極活性材料的本征性質,且原料豐富、成本低廉、對環境友好、熱穩定性好且安全性佳,是具有發展潛力的鋰離子正極材料。由于Mn基材料固有的性質,LiMn2O4在循環過程中的容量衰減主要是因為M n的存在,如Mn2+在非水電解液中的溶解損失;在高電位下,由于Mn3+的岐化導致Jahn-Teller效應而引起結構不穩定的損失;在高溫下,PF-6與水發生反應形成的HF對電極的侵蝕;隨著循環深入,Mn由16d位置移向8a位置堵塞了Li+通道造成的損失及產生結構無序化的損失。這些都與充放電過程中的結構變化有關。解決容量衰減的方法大致有:改善合成材料的方法(見表2)和條件(特別是燒結溫度與時間);對體相摻雜或取代部分Mn;對材料表面改性,修飾和處理;或者既取代又表面改性。
錳基化合物的制備方法如表2所示。
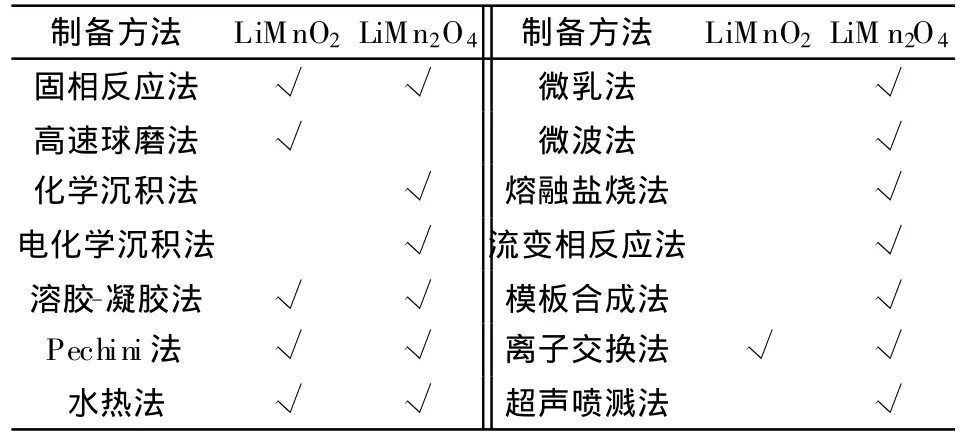
表2 Mn基化合物的制備方法Table 2 Preparation methods for Mn-based compounds
摻雜取代的方式有單元或多元陽離子取代,單元或多元陰離子取代,陽離子取代Mn和陰離子取代O同時進行。取代摻雜是一種折中的選擇,有利也有弊。有的能改善循環,卻可能要降低初始容量;有的陽離子取代,可提高容量,卻可使循環性能變差。多元陰陽離子取代,可能帶來合成的困難或條件的苛刻。所有的摻雜、取代,都有最適量,否則會帶來結構的變化。
對Mn基化合物體相改性取代的摻雜元素如表3所示。
對摻雜改性元素的選擇大致有以下4條規律:
①摻入元素M(如Co、Ni及Cr)與O的結合能要比 Mn與O的結合能大,使晶胞收縮,縮短M—O的鍵長,提高尖晶石LiMn2O4的結構穩定性;但還要有不同的特性,如摻Co能提高Li在體相的擴散系數,有助于提高循環性能;摻Ni優選出取代量為0.5,即LiNi0.5Mn1.5O4,不同制備方法的初始比容量均有135~140 mAh/g,循環數在40~60次時的容量損失為0~4.5%;當取代量為0.05~0.50時,初始比容量也有約 130 mAh/g,循環在100次以上時,容量衰減率僅有2%~5%。這是因為Ni—O鍵的鍵能大,弱化了 Li—O鍵的鍵能,降低了Li+擴散的內阻,但未見倍率性能的報道。
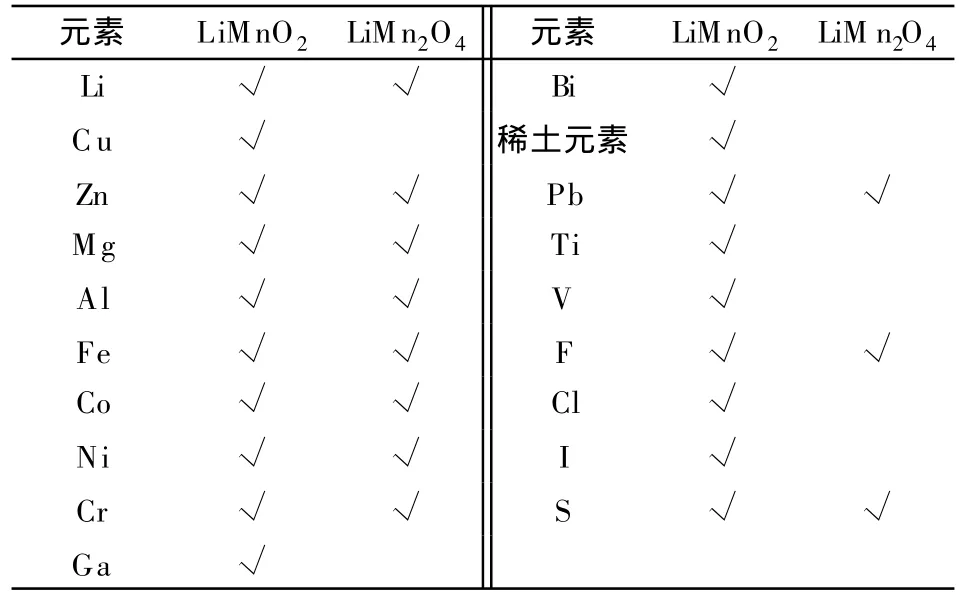
表3 摻雜Mn基正極活性材料的摻雜取代元素Table 3 Doped-substituted elements for Mn-based positive electrode active materials
②摻雜元素M—O的鍵能與M的離子半徑 r有關。rMn3+=0.064 5 nm,rCr3+=0.061 5 nm,rTi4+=0.060 5 nm,Cr3+與 Ti3+的半徑均小于 Mn3+,因而會使晶胞收縮、結構穩定,在循環時不易形變,提高了循環性能,但一般初始容量會有所降低。一般要提高循環性能,就要選擇與M n離子半徑相近或稍小的金屬離子。
③要抑制材料的Jahn-Teller效應,一般要選擇+2或+3價的離子,主要是提高LiMn2O4中Mn的平均價態;若既要提高循環性能,又有好的比容量,主要應制備單一的物相[34]。Al3+、Ga3+和 Fe3+的半徑與 Mn3+相同或相近,但均既占據四面體8a晶格點位置又占據八面體16d晶格點位置,而形成反尖晶石離子LiMn5O8存在,不過只要M 的摻雜量最優化,也有利于提高循環性能[35]。
④陰離子(F-)取代,一般負電性比氧大,吸電子能力強,會降低Mn在電解液中的溶解,使LiMn2O4的初始容量提高,但降低了Mn的價態,容易發生 Jahn-Teller效應,循環性能會降低,因此一般用F取代O,必須有相應的陽離子取代Mn加以協調。
上述原則是以單元取代而言,它們的不足可用多元取代或摻雜來改善。如Ni取代的效果顯著,但未見高倍率的報道,近來用不同的合成法,用Mg取代部分 Ni構成LiMgδNi0.5-δMn1.5O4(δ=0.07),理論比容量 為 148.7 mAh/g,很接近未加任何取代元素的理論值148.2 mAh/g。研究發現,Li/LiMg0.07Ni0.43Mn1.5O4在3.5~4.8 V循環,用固相法、溶膠-凝膠法和干凝膠法制得樣品的0.2 C初始比容量分別為116 mAh/g,108 mAh/g和106 mAh/g;1.0 C初始比容量分別為104.4 mAh/g、>97 mAh/g和>95.4 mAh/g;循環30次后,5.0 C放電比容量分別為<70 mAh/g、>64.8 mAh/g和>74.2 mAh/g,表明倍率性能良好[36]。用Ti取代Mn,以電解法先制得Ti-EMD,再用固相反應法制得Li0.973Ti0.045Mn1.893O4,在2.5~4.6 V的初始放電比容量達206 mAh/g,第40次循環的容量保持率為 20%,貯存3個月后,樣品的初始比容量可達144 mAh/g,第40次循環時的容量保持率為14%;貯存電池在4.3~3.4 V循環約150次,容量保持率達94.7%。結果表明,二元取代既有好的初始比容量、循環性能,又有良好的貯存性能[37]。
不少摻雜取代的離子(無論是+2價或高價)在室溫下循環性能都不錯,但在高溫(55℃)、高電位(5 V)下容量衰減快,循環性能下降。這主要是因為:①引起材料的氧的缺陷;②引進入16d位置,使混亂度增大。不過,摻Cu構成的LiCuxMn2-xO4(0.025≤x≤0.1)的性能較好,如 x=0.1時,在3~5 V時的初始比容量達130 mAh/g,隨后的循環中可穩定在120 mAh/g[38]。5 V級的材料早已做過研究,如LiCu0.5Mn1.5O4和LiNixCu0.5-xMn1.5O2。它們的優點是可使用高電位負極,使整個電池有較高的工作電壓,但仍受到電解液的限制[39]。
對LiMn2O4的體相改性,雖然作了大量的研究,取得了一些進展,但對容量衰減的機理并未形成統一的認識,有些實驗得出不同的結論,尤其是高功率大電流充放電,還未有很好的解決方法。
對LiMn2O4的表面改性,可滿足不同應用的需求,或為了提高材料的表面電子電導率(如C包覆);或為了防止材料表面受到電解液的侵蝕溶解(如Al2O3);或為了提高表面的孔隙率以適應高倍率充放電,延長循環性能;或為了除去表面膜層,提高活性材料的利用率[40]。
選擇的包覆物應與表面形成均勻的包覆薄層,包覆過程的溫度不能破壞材料的結構,包覆方法要盡可能簡便。
已研究過的Mn基材料包覆物有單質、金屬氧化物或其混合物、無機鹽及有機物等,如表4所示。
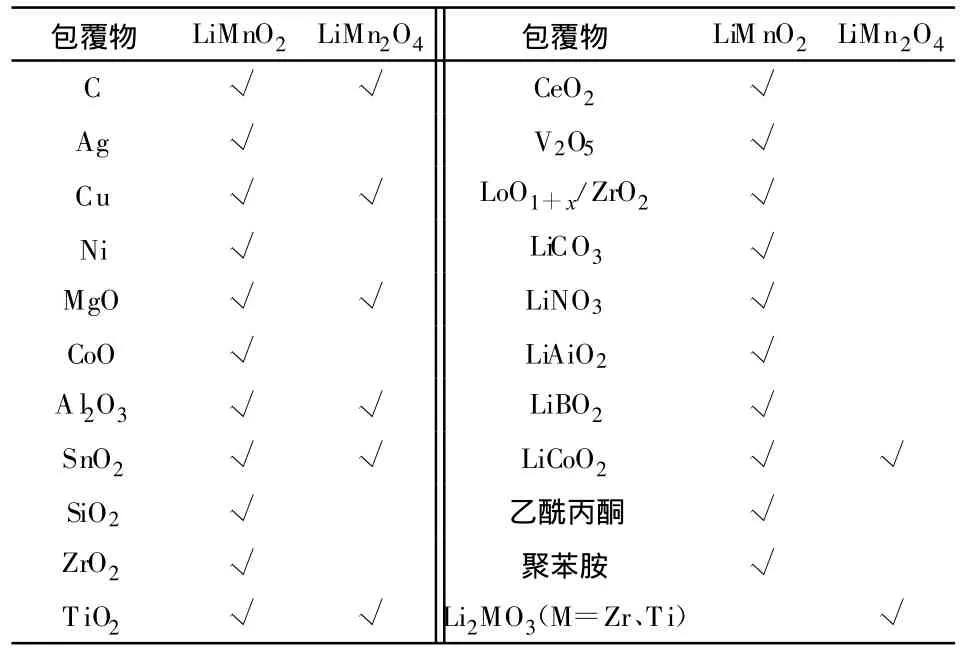
表4 Mn基正極活性材料的包覆物Table 4 Coating materials for Mn-based positive electrode active compounds
用單質C、Ag等包覆LiM n2O4,主要是提高材料的表面電子電導率;鍍Ni可提高電極的高溫性能[41];用金屬氧化物包覆,在材料表面引入M—O(M為金屬元素)鍵,抑制氧的活性,并抑制Mn的溶解,提高材料的循環性能;ZrO2的包覆還可提高放電容量[42];鹽類(如LiCO3等)的包覆,可抑制電解液中產生的HF對電極材料的侵蝕;LiBO2包覆可提高離子電導率,從而減小比表面積,減緩HF的侵蝕,且可在高電壓下抑制電極與電解液的接觸,減少電解液的分解[43];LiCoO2的包覆,一方面降低了 LiM n2O4與電解液的接觸,抑制了材料的溶解,另一方面Co3+可進入16d晶格點位,抑制Jahn-Teller效應,減少Mn3+的岐化,既可提高電極的比容量,也可提高電池的可逆比容量[44];有機物(如乙酰丙酮)包覆LiMn2O4,可與表面上的Mn空軌道成鍵,使之不再對電解液的分解起催化作用,抑制電解液的分解,在發生配位成鍵的同時,還可溶解一些Mn離子,形成非電活性的Li2MnO3,也可防HF的侵蝕。
LiMn2O4本身以及與電解液的熱穩定性不同。電池荷電態的不同,引起開始反應溫度與反應熱不同。在4.3 V充電時,反應熱較高,此時的反應溫度為151℃[45],但低于本身在4.3 V的240℃,也是較為安全的。
有研究者合成了LiMn1.5Ni0.5O4,以2.2 C放電,比容量超過了 100 mAh/g,循環100次后,容量沒有明顯的衰減;該材料還可進行11 C放電[46]。
有研究者研發了以Li4Ti5O12為負極、LiMn2O4為正極的鋰離子電池,具有極高的功率密度、壽命和安全性。循環3 000次后,容量保持率達80%;50 C放電時的容量為低電流放電時的90%[47]。他們已經證明,尖晶型的 Li4Ti5O12/LiMn2O4鋰離子電池是安全的體系[48]。相關性能指標,已接近或達到HEV的要求。
2.6.2 層狀LiMnO2
LiMnO2有多種晶型,屬層狀結構的有α-NaFeO2型單斜m-LiMnO2和巖鹽型呈正方的σ-LiMnO2。在熱力學平衡條件下,σ-LiMnO2比 m-LiMnO2穩定,前者的理論比容量為308 mAh/g,后者為285 mAh/g,均高于 LiCoO2。由于Mn3+中3d電子能帶分布(t2geg)的反鐵磁相互作用,引起Jahn-Teller效應,使氧的排列發生畸變,難以形成理想的密堆積,影響結構的穩定。在充放電過程,物相轉變為尖晶石型結構。層狀LiMnO2和尖晶石型 LiMn2O4的Mn基化合物結構的變化,會引起容量衰減,都是Mn為核心造成的,不同的是前者的Mn為+3,而后者的Mn平均氧化價為+3.5,因此,兩者的制備方法,對體相的改性和表面的處理修飾,均是大同而有異。若部分Mn被 Ni或Co取代,結構呈O2型(O表示八面體氧配位,2表示兩層,每單元晶胞為MO2),即結構變穩些,可抑制相變。隨著制備方法和取代離子的不同,還有O3型結構即為氧八面體配位形成3層,或形成氧四面體配位的 T2型,或菱形Na+配位的 P2型結構。P2型轉化為O2型只需MO間互相滑移即可,即是離子交換法的理論根據。在電化學充放電過程,T2也可轉變為O2型。如取代形成富鋰并Ni取代的層狀物,會構成四面體氧配位的T2型結構。這也是在層狀LiMnO2中,Ni取代Mn為研究熱點,并具有良好的容量和循環性的原因。
關于LiM nO2的制備方法、體相改性和表面修飾,分別在表 2、3和 4中已經列出。
在體相改性中,值得一提的是構成富鋰(或過嵌鋰)和缺鋰的兩類化合物。
鋰的嵌入,總的來說取代部分Mn,占據Li層中四面體位置,有利于保持結構的穩定。過嵌鋰可以提高Mn的平均氧化態,并且抑制Jahn-Teller效應。Z.H.Lu等[49]合成了 Li[NixLi(1/3-2x/3)M n(2/3-x/3)]O2,當 x=5/12 時,在 3.0~ 4.4 V以 30 mA/g的電流放電,比容量達 150 mAh/g;且安全性優于LiCoO2,容量和循環性能都得到了提高[50]。Li(Li0.2Ni0.1Co0.2Mn0.5)O2可視為兩種層狀物的固溶體,也可視為過嵌或取代的層狀化合物或超晶格結構的化合物,初始比容量達234 mAh/g,第40次循環的容量保持率達98.3%。過嵌鋰要適中,或可提高容量,或可改進循環性能。有的富鋰材料,如Li[LixNi0.5Mn0.5]O2的混排度低于 LiNi0.5Mn0.5O2;而Li[LixNi1/3Co1/3Mn1/3]O2(0.03≤x≤0.17)的混排度比Li(Ni1/3Co1/3Mn1/3)O2小,有序性增大,對提高容量有利。
缺鋰的 LiMnO2可轉化為 O2型,O2-Li2/3+x(Co0.15M n0.85)O2(x=0、1/3)兩種化合物,當 x=1/3時為化學計量化合物,當 x=0時為缺鋰的層狀化合物,可轉化為O2型。O2-Li2/3+x(Co0.15Mn0.85)O2電流為5 mA/g時的可逆比容量均約為180 mAh/g,在電流為140 mA/g(即1 C)時的可逆比容量均約為100 mAh/g(2.5~4.6 V)。EIS研究表明,在循環10~15次后,材料的容量衰減增大,這與表面膜的形成、體相的電阻增大一致。隨后的循環(≤6)中,鋰離子擴散系數DLi為 2×10-11~10×10-11cm2/S,而O2(Li)為 0.5×10-10~3×10-10cm2/S;即化合物的容量衰減,除了界面動力學外,也與 DLi值(即體相內)的變化有關[51]。這說明缺鋰化合物對抑制容量衰減有利。此外,由Na0.7(Ni1/6Mn5/6)O2通過離子交換法制得的Li0.7(Ni1/6Mn5/6)O2是缺鋰化合物,在2.0~4.6 V循環容量沒有明顯的衰減,作者認為是因為具有一種面缺陷結構[52]。
總之,富鋰和缺鋰的層狀化合物均有較好的性能,是值得關注的課題。Zn、Mg等較大離子半徑的元素取代 Mn,在M n3+的價帶引入空穴,產生干擾反鐵磁自旋排列的Mn4+,可提高m-LiMnO2的結構穩定性。
Co、Cr和 Ni等過渡金屬的離子半徑與 Mn3+相近,若占據八面體位置可抑制Jahn-Teller效應、穩定層狀結構。特別是Ni在層狀中取代,有良好的性能[53]。
LiMnO2的包覆,與LiMn2O4的包覆機理類似。主要是抑制錳的分解,電解液對電極的侵蝕。金屬氧化物的包覆、金屬M—O的強度、抑制表面氧的活性或提高Li+擴散途徑,以提高電化學性能,不再贅述。
2.6.3 層狀Li2MnO3的復合
Li2MnO3屬巖鹽型單斜晶系結構,空間群為C2/m,與LiMnO2不同的是:氧不是理想的密堆積,八面體層中交疊的是Li+與Mn4+層。由于Mn是4價,Li2MnO3本身不具有電化學活性,Li+也不能脫出;要使之成為正極活性物,一種方法是用3d金屬取代部分Mn,形成固溶體復合物,而終端產物可視為Li2MnO3與其他層狀物的復合物[54]。
層狀Li2MnO3與層狀化合物[LiMO2(M=Co、Ni或 Fe等)]的復合。許多LiMO2與 Li2MnO3多為同構物,已研究過的有 LiCoO2-Li2MnO3、Li1-xNi1-xO2-Li2MnO3,進而又有LiCoO2-LiNi0.5Mn0.5O2復合物[55]。這些復合物正極一般都有高電位、高能量密度的特性,因此引起了人們的關注;但制備方法和條件都十分苛刻,成本也因為含Co等而較高。
LiFeO2也是層狀化合物,將LiFeO2-Li2M nO3復合,由于Fe、Mn均價廉,因而很吸引人,但立方α-LiFeO2與四方γ-LiFeO2和 Li2MnO3都是非電化學活性物,要用 Fe部分取代Li2MnO3中的Mn,就必須用軟化學(低溫)法,即H+/Li+交換或Na+/Li+交換制備,并限定 n(Fe)/n(Mn+Fe)。早先用Fe取代Li2MnO3的部分Mn,用固相反應法n(Fe)/n(Mn+Fe)<0.3或水熱-燒結法 n(Fe)/n(Mn+Fe)<0.75,在650~700℃燒結制得,復合物中的Fe為+3與+4的混合態。Li取代樣充放電的性能較差,在2.5~4.8 V充放電,650℃燒結產物的初始放電比容量雖有170 mAh/g,卻是在低電流 7.5 mA/g下得到的[55]。M.Tabuchi等[56]改變制備條件,用Fe(NO3)3+MnCl2[n(Fe)/n(Mn+Fe)=0.3~ 0.7]在-10℃下沉積,再在LiOH+EtOH中25℃鼓泡共沉淀,洗滌后,加入LiOH?H2O+KOH+KClO3,用水熱法在 220℃時處理8 h,得到 Li1+x(FeyMn1-y)1-xO2;再在空氣中、不同溫度(500~750℃)下熱處理 20 h,干燥洗滌,得到粒徑小于100 nm的Li1+x(FeyMn1-y)1-xO2,該終端產品在y=0.5時由層狀巖鹽型和立方巖鹽型物相組成。在650~750℃下熱處理得到的樣品性能最佳,此時n(Li)/n(Fe+Mn)=1.45~1.50,x=0.185~0.20,y=0.5。升高熱處理溫度,并未影響n(Fe)/n(Fe+Mn)。結構分析表明,產物為由Mn取代的 LiFeO2(立方)和Fe取代的Li2MnO3(層狀巖鹽型)構成的復合物,以42.5 mA/g恒流在2.5~4.8 V充放電,初始充、放電比容量分別大于300 mAh/g和200 mAh/g,而循環40次,放電比容量仍大于150 mAh/g。當y=0.5時,初始放電比容量達 215 mAh/g。這種 Fe取代的Li2MnO3的電化學性能大有改善,與產物的粒徑小、比表面積增大、Li含量增大[n(Li)/n(Fe+Mn)=1.45]及主要調整了平均化學組成有關。這對廉價3 V級大型鋰離子電池是極有競爭力的,但作為商品化電池正極材料,循環性能仍需改善。
層狀Li2MnO3與尖晶石型結構的復合。尖晶石型結構是三維網狀,可以設想與層狀Li2MnO3的復合物的制備要困難一些,已經做過的是 Li2MnO3與 LiMn2O4的復合,制備出xLi2MnO3-(1-x)Li1+δMn2-δO4(0 <x<1,0≤δ≤0.33)復合物[57],卻是調整 Li和Mn之間的組成,而沒有其他3d金屬的取代,由此可設想形成 xLi2MnO3-(1-x)Li1+δMn2-δO4(M=Ni、Co)等層狀-尖晶型的復合物。
層狀 Li2MnO3與 δ-MnO2和層狀 LiMnO2的復合。Li2MnO3用H2SO4潷析出 Li2O[30]是 H+與 Li+間的離子交換,自Li2MnO3層間移去 Li2O,首先得到的產物是(1-x)[Li(Li0.33Mn0.67)O2]?x(0.67MnO2)或(1-x)Li2MnO3-xMnO2,XRD分析表明,MnO2層狀結構在聚合物鋰離子電池中以C/15倍率在2.0~3.8 V循環12次,放電比容量為155 mAh/g。放電曲線表明,循環中樣品未轉化為尖晶石結構,似逐漸轉化為無定型;隨后嵌 Li+不能進入Li2MnO3中,而只能進入MnO2中,成為LiMnO2,構成 xLi2MnO3-(1-x)LiMnO2。由此也可設想形成(1-x)Li2M′O3?x LiMnO2(M′=Ti4+,M=Ni3+、Mn3+)的新層狀與層狀結構的復合物,如0.05Li2TiO3-0.95Li(Mn0.5Ni0.5)O2等。
3 結論
錳資源豐富、價格低廉、對環境友好且安全性能較好,結構研究較為深入,既可用于一次電池,又可用于二次電池。各種晶型之間又可互相轉化成Li-Mn-O化合物、層狀的LiMnO2和三維尖晶石型LiMn2O4,是動力電池正極材料的候選者,有望取代LiCoO2。Mn基材料既有優勢,又有發展潛力,因而引人注目。 (全文完)
[29]Jouanneau S,Sarciaux S,Le Gal La Salle A,et al.Influence of structural defects on the insertion behavior of γ-M nO2:comparison of H+and Li+[J].Solid State Ionics,2001,140(3-4):223-232.
[30]Johnson C S.Development and utility of manganese oxides as cathodes in lithium batteries[J].J Power Sources,2007,165(2):559-565.
[31]Rossouw M H,Thackeray M M.Lithium manganese oxides from Li2M nO3for rechargeable lithium battery applications[J].Mater Res Bull,1991,26(6):463-473.
[32]Rossouw M H,Liles D C,Thackeray M M,et al.Alpha manganese dioxide for lithium batteries:a structural and electrochemical study[J].Mater Res Bull,1992,27(2):221-230.
[33]Read J,Driedger A,Foster D,et al.Low temperature performance of λ-MnO2in lithium primary batteries[J].Electrochem Solid-State Lett,2001,4(10):A162-A163.
[34]Hiromasa I,Kouichi T,Masataka W.The effect of chromium substitution on the phase transition of lithium manganese spinel oxides[J].Thermochim Acta,2004,414(2):227-232.
[35]YI Ting-feng(伊廷鋒),XIA Ji-cai(夏繼才),HU Xin-guo(胡信國).反尖晶石離子摻雜對 LiMn2O4結構性能的影響[J].Dianchi Gongye(電池工業),2006,11(6):401-405.
[36]Locatia C,Lafonta U,Simonin L,et al.Mg-doped LiNi0.5Mn1.5O4spinel for cathode materials[J].J Power Sources,2007,174(2):847-851.
[37]Tong Q S,Yang Y,Shi J C,et al.Synthesis and storage performance of the doped LiMn2O4spinel[J].J Electrochem Soc,2007,154(7):A656-667.
[38]Sulochana A,Thirunakaran R,Sivashanmugam A,et al.Sol-gel synthesis of 5 V LiCuxMn2-xO4as a cathode material for lithium rechargeable batteries[J].J Electrochem Soc,2008,155(3):A206-A215.
[39]Scrosati B.Recent advances in lithium ion battery material[J].Electrochim Acta,2000,45(15-16):2 461-2 466.
[40]Li C,Zhang H P,Fu L J,et al.Cathode materials modified by surface coating for lithium ion batteries[J].Electrochim Acta,2006,51(19):3 872-3 883.
[41]XU Ming-fei(許名飛),LI Xin-hai(李新海),ZHANG Yun-he(張云河),et al.化學鍍鎳包覆提高尖晶石LiMn2O4的高溫性能[J].Dianyuan Jishu(電源技術),2004,28(2):88-96.
[42]T hackeray M M,Johnson C S,Kim J S,et al.ZrOand Li2ZrOstabilized spinel and layered electrodes for lithium batteries[J].Electrochem Commun,2003,5(9):752-758.
[43]Chan H W,Duh J G,Sheen S R.Electrochemical performance of LBO-coated spinel lithium manganese oxide as cathode material for Li-ion battery[J].Surf Coat Technol,2004,188-189:116-119.
[44]ZHANG Ren-gang(張仁剛),ZHAO Shi-xi(趙世璽),XIA Jun-lei(夏君磊),et al.尖晶石 LiMn2O4的表面改性研究[J].Electrochemistry(電化學),2002,8(3):269-274.
[45]Wang Q S,Sun J H,Chen C H.Thermal stability of delithiated LiM n2O4with electrolyte for lithium-ion batteries[J].J Electrochem Soc,2007,154(4):A263-A267.
[46]WANG Chong(王),CHEN Jia-jia(陳嘉嘉),ZHENG Ming-sen(鄭明森),et al.化學電源研究展望——美國電化學會第 213次會議評述[J].Battery Bimonthly(電池),2008,38(5):297-299.
[47]CHEN Zong-hai(陳宗海),QIN Yan(秦燕).動力鋰電池的研發現狀——第一屆動力鋰電池國際會議評述[J].Battery Bimonthly(電池),2008,38(5):293-296.
[48]Belharouak,I Sun Y K,Lu W,et al.On the safety of the Li4Ti5O12/LiM n2O4lithium-ion battery system[J].J Electrochem Soc,2007,154(12):A1 083-A1 087.
[49]Lu Z H,M acNeil D D,Dahn J R.Layered cathode materials Li[NixLi(1/3-2x/3)Mn(2/3-x/3)]O2for lithium-ion batteries[J].Electrochem Solid State Lett,2001,4(11):A191-A194.
[50]Myung S T,Komaba S,Kumagai N.Effect of excess lithium on LiNi0.5Mn0.5O2+δand its electrochemistry as lithium insertion material[J].Solid State Ionics,2004,170(1-2):139-144.
[51]Shaju K M,Rao G V S,Chowdari B V R.EIS and GIT T studies on oxide cathodes,O2-Li(2/3)+x(Co0.15Mn0.85)O2(x=0 and 1/3)[J].Electrochim Acta,2003,48(18):2 691-2 703.
[52]Park K S,Park S H,Sun Y K,et al.Synthesis and electrochemical characteristics of Li0.7[Ni1/6Mn5/6]O2cathode materials[J].J Electrochem Soc,2002,149(9):A1 250-A1 254.
[53]Park K S,Cho M H,Park S H,et al.T he effects of Ni and Li doping on the performance of lithium manganese oxide material for lithium secondary batteries[J].Electrochim Acta,2002,47(18):2 937-2 942.
[54]Johnson C S,Li N,Vaughey J T,et al.Lithium-manganese oxide electrodes with layered-spinel composite structures x Li2MnO3?(1-x)Li1+yMn2-yO4(0<x<1,0≤y≤0.33)for lithium batteries[J].Electrochem Commun,2005,7(5):528-536.
[55]Tabuchi M,Nakashima A,Shigemura H,et al.Synthesis,cation distribution,and electrochemical properties ofFe-substituted Li2MnO3as a novel 4 V positive electrode material[J].J Electrochem Soc,2002,149(5):A504-A512.
[56]Tabuchi M,Nabeshima Y,Shikano M,et al.Optimizing chemical composition and preparation conditions for Fe-substituted Li2MnO3positive electrode material[J].J Electrochem Soc,2007,154(7):A638-A648.
[57]Sun Y C,Xia Y G,Shiosaki Y,et al.Preparation and electrochemical properties of LiCoOLiNi0.5Mn0.5OLi2MnO3solid solutions with high M n contents[J].Electrochim Acta,2006,51(26):5 581-5 586.

