2型糖尿病患者外周血內皮祖細胞與CD62P改變的臨床意義
毛文文 田偉盟 陳國強 周 寧
1 昆明市第二人民醫院老年科(650204)
2 昆明市延安醫院內分泌科(650051)
陜西省第四人民醫院呼吸內科(710043)
內皮祖細胞(endothelial progenitor cells,EPCs)亦稱內皮前體細胞,是指能分化增殖為成熟內皮細胞的一群祖細胞。目前,EPCs 介導的血管再生及損傷血管修復已經成為糖尿病、心血管疾病、腫瘤等疾病中的研究熱點。2型糖尿病中微血管損傷及血小板活化機制的揭示正受到許多學者的關注。本研究觀察2型糖尿病患者EPCs與CD62P改變,探討其在糖尿病發生、發展中的作用。
1 材料與方法
1.1 標本來源
檢測用的外周血標本采自30例糖尿病患者(DM)及10例糖耐量正常的健康對照者。30例糖尿病患者包括測定10例血糖控制良好(HbA1c<7%)T2DM患者(A組)、10例血糖控制中等(HbA1c7%~11%)T2DM患者(B組)、10例血糖控制較差(HbA1c>11%)T2DM患者(C組)。
1.2 EPCs的檢測
1.2.1 細胞表面標志
采用CD45-Cy5,CD133-RPE等標記。內皮祖細胞(EPCs):CD133+/CD45。
1.2.2 檢測方法
采用熒光抗體標記,流式細胞儀檢測。抽取外周血3mL抗凝,血標本用PBS液2倍稀釋,Ficoll分離,1800r/min離心20min,PBS洗2次。將細胞加入96 孔板中,每孔5×105個細胞,加入抗體5μL,4℃孵育30~60min,用PBS液洗滌標本2次,100μL的1 %多聚甲醛固定,流式細胞儀檢測。
1.3 CD62P的檢測
試驗組及對照組測定血小板及其參數均使用EDTA-K2抗凝管抽靜脈血2mL送檢,采血后均在2h內進行測定。使用儀器為日本Sysmex公司生產的XE22100型血細胞分析儀,所用檢測試劑均為原裝配套試劑。血液分析所用的EDTA-K2抗凝試管為美國BD公司提供的真空采血管,血小板CD62P測定采用美國BD公司FACS Calibur型流式細胞儀及配套試劑并嚴格按儀器要求操作。
1.4 統計學分析
所有資料使用SPSS10.0統計軟件包進行處理,數據以均數±標準差表示,數據比較應用兩組均數t檢驗,P<0.05為差別具有統計學意義,以Spearman相關系數評價變量間相關性。
2 結 果
2.1 DM與對照組患者外周血EPCs、CD62P水平值變化
EPCs在初診T2DM組顯著低于健康對照組;血小板CD62P表達陽性程度在2型糖尿病患者中顯著高于對照組(P<0.01) ,見表1。
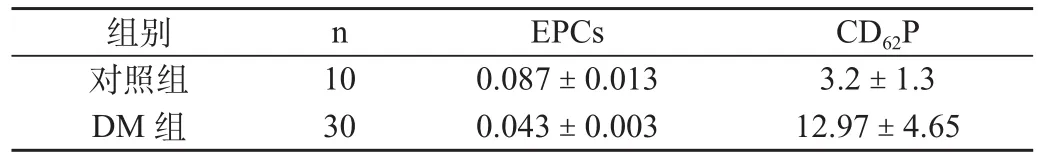
表1 糖尿病組患者外周血中EPCs 、CD62P水平變化(%)
2.2 不同病變程度DM患者外周血EPCs 、CD62P水平值變化
C組EPCs水平明顯低于B組及A組,C組與B組有差異(P<0.05);C組與A組有差異(P<0.01);B組低于A組,但無統計學意義(P>0.05);C 組CD62P的水平顯著高于B組及A組(P<0.05,P<0.01),B組與A組相比,差異有統計學意義(P<0.05),見表2。
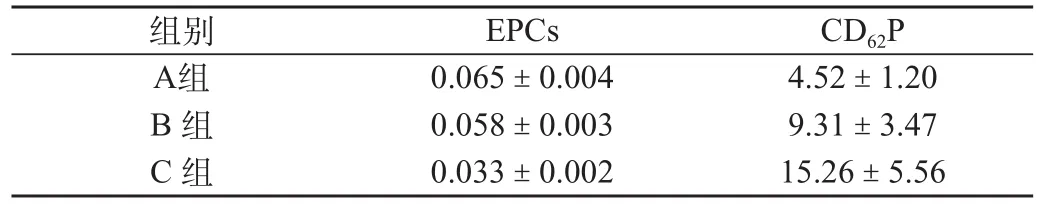
表2 不同病變程度DM患者(按糖化血紅蛋白分組)外周血CD62P、EPCs水平變化(%)
2.3 T2DM患者外周血中CD62P、 EPCs相關性分析
相關性顯示,EPCs與CD62P(r= -0.564,P<0.01)呈負相關;EPCs與FPG(r= -0.341,P<0.05)呈負相關;CD62P與FPG(r= 0.443,P<0.01)呈正相關。鑒于資料有限未行多因素分析。
3 討 論
糖尿病為一種慢性代謝性疾病,除葡萄糖、蛋白質及脂質代謝紊亂外尚有凝血纖溶系統功能的紊亂,可導致各種并發癥尤其是血管并發癥的出現[1-10]。有報道認為患者的高凝血活性與并發癥的發生、發展相關,其凝血活性與患者病情的控制情況的好壞相關[8]。
CD62P又稱血小板α顆粒膜蛋白140(granule membrane protein-140,GMP-140),是血小板內α顆粒的成分,當血小板被激活后可表達于血小板表面,是血小板活化的分子標志物。2型糖尿病患者由于在疾病過程中存在血管內皮細胞受損、脂質過氧化等原因可導致血小板激活,患者的高血糖狀態本身也可導致血小板活化,血小板被激活后其凝血活性增高,表現在聚集功能增強、細胞表面α-顆粒膜蛋白表達量增多等[1-6]。目前有關內皮祖細胞與血小板活化因素研究較少[8-10]。
本研究中探討內皮祖細胞及CD62P的變化,發現糖尿病患者內皮祖細胞數目減少而血小板CD62P的陽性表達程度增高,二者間存在一定的相關性。內皮祖細胞數目減少說明2型糖尿病患者體內存在血管損傷[9]。CD62P陽性表達程度增高可反映2型糖尿病患者體內存在著血小板的活化及消耗的情況,說明2型糖尿病患者處于高凝狀態[7-10]。血管內皮損傷和血小板激活在糖尿病患者的病情發展、并發癥的發生方面起一定的作用,對糖尿病患者進行抗血小板功能藥物的治療可能有助于糖尿病病情的控制并可預防其血栓性并發癥的發生。但具體機制仍需進一步探討。
[1]Avogaro A,Fadini GP,Gallo A,et al.Endothelial dysfunction in type 2 diabetes mellitus[J].Nutr Metab Cardiovasc Dis,2006,16(S1):39-45.
[2]Wong CY,Qiuwaxi J,Chen H,et al.Daily intake of thiamine correlates with the circulating level of endothe lial progenitor cells and the endothelial function in patients with type II diabetes[J].Mol Nutr Food Res,2008,52(12):1421-1427.
[3]Brunner S,Schernthaner GH,Satler M,et al.Correlation of different circulating endothelial progenitor cells to stages of diabetic retinopathy:first in vivo data[J].Invest Ophthalmol Vis Sci, 2009,50(1):392-398.
[4]Luk TH,Dai YL,Siu CW,Habitual physical activity is associated with endothelial function and endothelial progenitor cells in patients with stable coronary artery disease[J].Eur J Cardiovasc Prev Rehabil,2009,16(4):464-471.
[5]Kusuyama T,Omura T,Nishiya D.Effects of treatment for diabetes mellitus on circulating vascular progenitor cells[J].J Pharmacol Sci,2006,102(1):96-102.
[6]Tepper OM,Galiano RD,Capla JM,Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation,adhesion,and incorporation into vascular structures[J].Circulation,2002,106(22):2781-2786.
[7]Fadini GP,Miorin M,Facco M.Circulating endothelial progenitor cells are reduced in peripheral vascular complications of type 2 diabetes mellitus[J].J Am Coll Cardiol,2005,45(9):1449-1457.
[8]Martin Fontecha A,Baumjohann D,Guarda G,et al.CD40L+CD4+memory T cells migrate in a CD62P-dependent fashion into reactive lymph nodes and license dendritic cells for T cell priming[J].J Exp Med,2008,205(11):2561-2574.
[9]Sambuceti G,Morbelli S,et al.Diabetes impairs the vascular recruitment of normal stem cells by oxidant damage,reversed by increases in pAMPK,heme oxygenase-1,and adiponectin[J].Stem Cells,2009,27(2):399-407.
[10]Mohler ER,Shi Y,Moore J,et al.Diabetes reduces bone marrow and circulating porcine endothelial progenitor cells,an effect ameliorated by atorvastatin and independent of cholesterol[J].Cytometry A,2009,75(1):75-82.

