催化酯化-吸附脫水聯合工藝合成富馬酸二乙酯
郝鳳嶺 丁斌 關昶
實驗以富馬酸和乙醇為原料,大孔強酸性陽離子交換樹脂NKC-9為催化劑,采用催化酯化-吸附脫水聯合工藝合成富馬酸二乙酯,并對該過程的影響因素進行了研究。
1 實驗
1.1 試劑與儀器
NKC-9,氫型、干態、球狀,干樹脂氫離子濃度≥4.7 mmol/g,南開大學化工廠提供,使用前用乙醇洗滌至無色;富馬酸、無水乙醇,工業品;其它試劑均為市售分析純試劑。
PE SPECTRUM 1000紅外光譜儀,美國PE公司制造。
1.2 富馬酸二乙酯的制備
反應在帶有攪拌器、氣相冷凝器、分子篩填充床、液相節點溫度計的500 ml四口燒瓶中進行,采用可控溫電加熱器加熱。實驗裝置參考丁斌等(2007)。
按設計摩爾比向四口燒瓶中加入計量的乙醇和富馬酸。加熱、攪拌,待反應液相達到規定溫度時,取樣測定反應液的酸值,同時向四口燒瓶中加入計量的NKC-9催化劑,并開始計時。在沸騰或微沸狀態下,部分乙醇和反應生成的水經氣相冷凝器冷凝連續進入外循環分子篩填充床,用3A分子篩吸附混合液中的水,脫水后的混合液連續返回酯化反應器。反應一定時間后,停止反應。反應液經冷卻、過濾出催化劑后為無色油狀液體。分別稱量反應液和吸附混合液的質量,測定反應液和吸附混合液的酸值,計算反應液的總酸量和富馬酸的轉化率。常壓蒸餾回收過量的乙醇,收集 100~110 ℃(2.67~3.00 kPa)的餾分,產物用紅外光譜表征。
反應液的總酸量等于反應液酸量與吸附混合液酸量之和。實驗表明,吸附混合液的酸量可忽略不計,故酸量=液體質量×液體酸值計算,酸值的測定采用氫氧化鈉乙醇標準溶液滴定法。
富馬酸的轉化率(%)=(1-測定總酸量/初始酸量)×100。
2 結果與討論
2.1 攪拌轉速對酯化反應的影響
NKC-9為 7.0%(w)、n/n0為 5.0: 1(其中 n為乙醇,為n0富馬酸,下文同),在沸騰或微沸(反應溫度≤120℃)狀態下反應6.0 h,攪拌轉速對酯化反應的影響結果見表1。
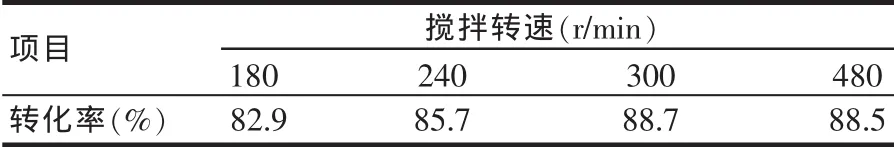
表1 攪拌轉速對酯化反應的影響
由表1可知,當攪拌轉速≥300 r/min時,富馬酸的轉化率基本保持不變。亦即,當攪拌轉速≥300 r/min時可以消除外擴散傳質過程對酯化反應的影響。考慮到增加催化劑用量會增大外擴散傳質阻力,故實驗固定攪拌轉速為480 r/min。
2.2 乙醇與富馬酸的摩爾比對酯化反應的影響
NKC-9為7.0%(w),在沸騰或微沸(反應溫度≤120℃)狀態下酯化反應6.0 h。乙醇和富馬酸的初始摩爾比(n/n0)對酯化反應的影響結果見圖1。
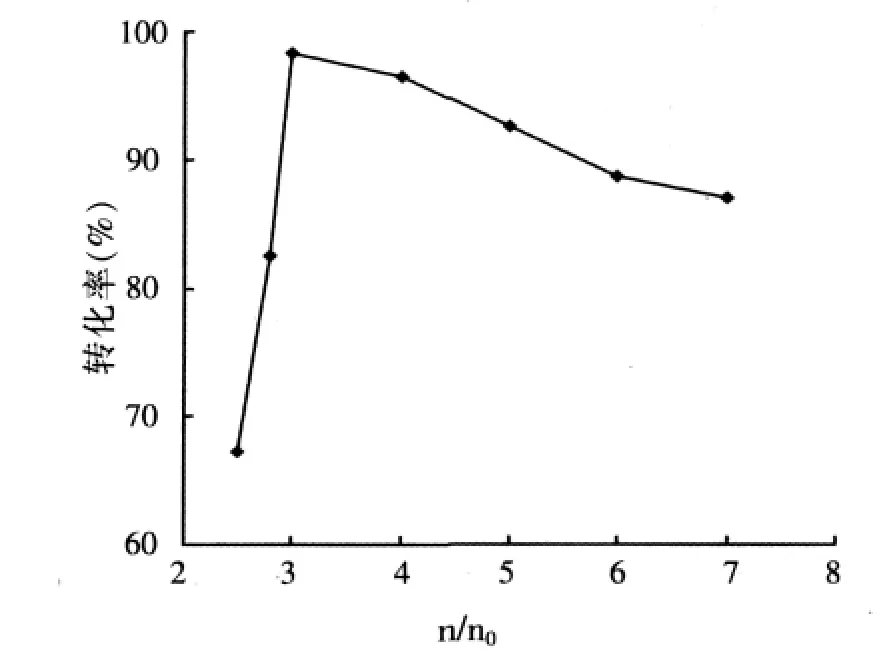
圖1 乙醇和富馬酸的初始摩爾比對酯化反應的影響
乙醇和富馬酸摩爾比的提高對酯化反應的影響有以下方面:酯化反應速率加快,平衡轉化率提高;過量的乙醇導致反應溫度降低,酯化反應速率減慢;乙醇的蒸發量增大,加快反應體系中水的脫除,降低了酯水解速率,提高了富馬酸的平衡轉化率。由圖1可知,當乙醇和富馬酸的初始摩爾比為3.0:1時轉化率最高,繼續增大初始摩爾比會使反應溫度降低,反應速度減小,富馬酸的轉化率下降。此外,初始摩爾比過大也降低了3A分子篩的吸附脫水速率。可見適宜的初始摩爾比為3.0:1。因此,在催化酯化-吸附脫水聯合工藝中,采用傳統的提高進料中的醇和酸摩爾比的方法能夠提高富馬酸二乙酯的生成速率,具有一定的積極意義。
2.3 催化劑用量對酯化反應的影響
初始摩爾比(n/n0)為3.0: 1,在沸騰或微沸(反應溫度≤120℃)狀態下酯化反應6.0 h。NKC-9用量對酯化反應的影響結果見圖2。
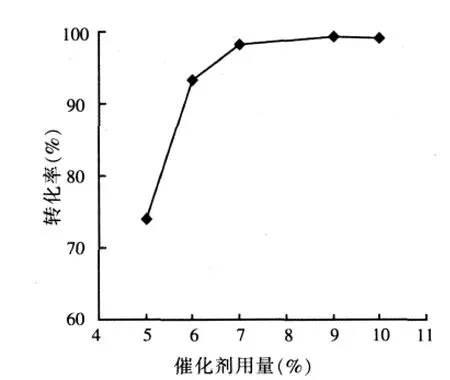
圖2 催化劑用量對酯化反應的影響
由圖2可知,催化劑用量增大,反應速率增大,溶液中水含量增大,脫水速率增大,降低了酯水解速率,提高了酸的平衡轉化率。但催化劑用量過多,會由于攪拌不充分使傳質阻力增大,導致反應速度降低。適宜的催作劑用量為7.0%。因此,在催化酯化-吸附脫水聯合工藝中,同樣可以通過控制催化劑用量來調節達到一定酸轉化率所需的反應時間,為實際的生產過程中優化生產成本和操作費用提供了多種選擇。
2.4 反應溫度對酯化反應的影響
溫度升高,反應速率增大,生成水速率也增大。體系中水含量增加,脫水速率增大,溶液中最終水含量減小,降低了酯水解速率,提高了酸的平衡轉化率。
常壓下在大孔強酸性陽離子交換樹脂NKC-9上實現富馬酸的乙酯化反應,由于乙醇的沸點低,即使在沸騰狀態下反應初期的液相溫度也很低,尤其在乙醇過量較大的情況下,由于液相溫度低,所以反應速率小。隨著反應的進行,反應液中富馬酸二乙酯的含量增加,乙醇含量減少,液相溫度逐漸升高,反應速率增大,富馬酸轉化率增勢變大。考慮到NKC-9催化劑的長期使用溫度高于120℃時,結構會受到熱損壞,因此,控制反應后期溫度在120℃以內。
2.5 反應時間對酯化反應的影響
NKC-9 為 7.0%(w)、n/n0為 3.0: 1,在沸騰或微沸(反應溫度≤120℃)狀態下,反應時間對酯化反應的影響結果見圖3。
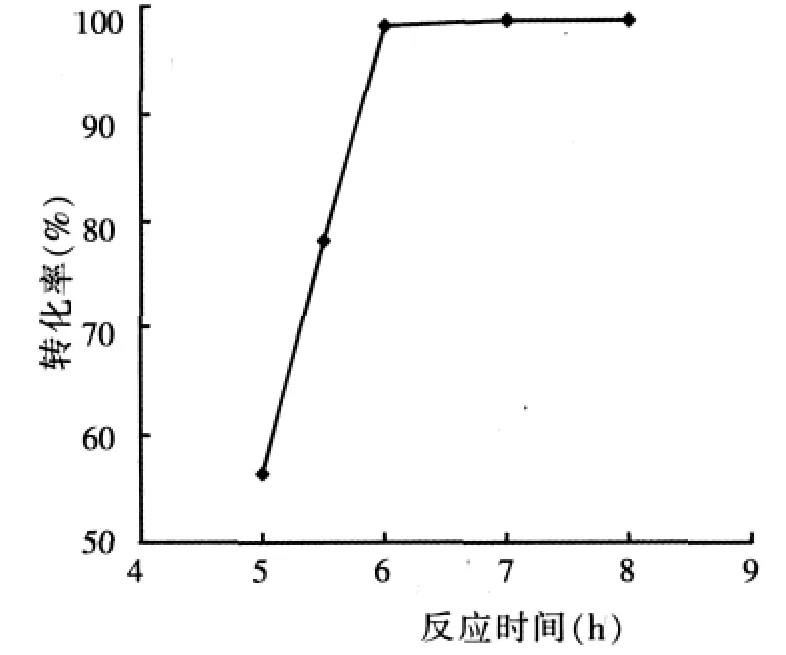
圖3 反應時間對酯化反應的影響
由圖3可知,在催化酯化-吸附脫水聯合工藝中,酯化反應的進程有3階段。①溶解及反應動力學阻力共同控制階段(<5.0 h):由于酯化反應溫度低以及富馬酸在乙醇中飽和溶解度較小,反應液存在固體富馬酸顆粒,亦即反應液為溶解的富馬酸所飽和。另外,富馬酸的乙酯化反應需在NKC-9催化作用下完成,所以仍是溶解的富馬酸與乙醇之間進行的酯化反應。由于反應液中富馬酸含量是上述溶解和反應二過程的綜合結果,因此總反應速率應由溶解和反應二個阻力共同控制;②不可逆反應階段(5.0~6.0 h):酯的生成速率遠遠大于酯的水解速率,酯化速率很快,反應生成的水連續地被醇帶出體系,由于脫水速率小于酯的生成速率,反應體系中酯的含量迅速上升,而水含量上升相對緩慢,反應速率主要由酯化反應動力學決定,酯化為不可逆反應,且酯化率很高;③可逆反應階段(>6.0 h):經歷了第二個反應階段后,由于反應體系中酯的含量已增至較高值,酯的水解速率加快,而酸的含量降至較低值,酯的生成速率減慢,但仍大于其水解速率,因此酯化速率較慢,反應體系中酯的含量緩慢上升。反應速率受脫水速率和酯化反應動力學共同制約,酯化為可逆反應。由于反應生成的水連續地被醇帶出體系,而且3A分子篩在水含量較低時仍有很高的吸附容量,因此酯化反應的化學平衡不斷地發生移動。由圖3可知,當反應時間為6.0 h時,富馬酸的轉化率達到98.3%,隨后再延長反應時間,轉化率增加不大。適宜的反應時間為6.0 h。
2.6 催化劑的重復使用
NKC-9 為 7.0%(w)、n/n0為 3.0: 1,在沸騰或微沸(反應溫度≤120℃)狀態下,反應時間6.0 h。新鮮催化劑使用一次后,不經任何處理,重復使用多次所得實驗結果見圖4。
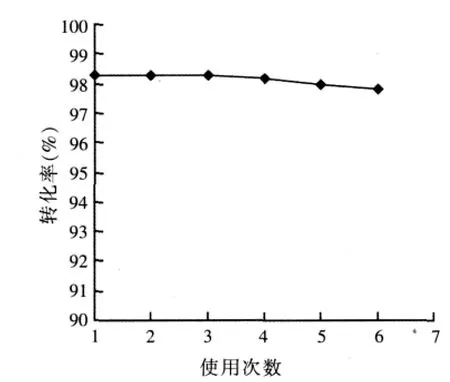
圖4 催化劑的重復使用結果
由圖4可知,催化劑重復使用6次后,富馬酸轉化率僅由98.3%降至97.8%,催化活性并未明顯降低。在反應過程中,隨著富馬酸轉化率增大,反應體系的溫度逐漸上升,當轉化率達到98%以上時,反應體系的溫度在110~120℃之間,催化劑熱穩定性較好。催化劑在使用過程中,原料夾帶的金屬離子雜質會導致催化劑表面的酸中心數減少,酸強度減弱,催化活性降低。
2.7 吸附劑對酯化反應的影響
初始摩爾比(n/n0)為 3.0: 1、NKC-9 為 7.0%(w),在沸騰或微沸(反應溫度≤120℃)狀態下酯化反應6.0 h。有無吸附劑時對富馬酸轉化率的影響結果見表2。

表2 吸附劑對酯化反應的影響
由表2可知,采用酯化-吸附聯合的外循環吸附脫水技術,可顯著提高富馬酸的轉化率。由于水分子能夠進入3A分子篩孔道并吸附在分子篩表面上,乙醇分子不能進入3A分子篩孔道而返回反應器,從而使酯化反應向生成富馬酸二乙酯的方向進行,提高了富馬酸的轉化率。
2.8 與硫酸、對甲苯磺酸催化效果的比較
采用酯化-吸附脫水技術,初始摩爾比(n/n0)為3.0: 1、NKC-9為7.0%(w),在沸騰或微沸(反應溫度≤120℃)狀態下酯化反應6.0 h。NKC-9、硫酸和對甲苯磺酸催化酯化反應結果見表3。

表3 NKC-9與硫酸、對甲苯磺酸催化活性的比較(%)
由表3可知,NKC-9陽離子交換樹脂催化劑與硫酸、對甲苯磺酸(p-TSA)催化劑的催化活性相當。使用H2SO4、p-TSA作催化劑,存在后處理工藝復雜、廢水排放量大、設備腐蝕、副反應多等問題。而使用NKC-9作催化劑,克服了H2SO4、p-TSA作催化劑所存在的問題,同時NKC-9催化劑可重復使用,具有很高的工業應用價值。
2.9 催化酯化-吸附脫水聯合工藝
富馬酸的乙酯化為熱效應較小的可逆吸熱反應。由于醇的沸點低,即使在沸騰狀態下反應初期的液相溫度也很低,尤其在醇過量的情況下,由于液相溫度低,富馬酸在乙醇中飽和溶解度較小,反應速度慢,反應受溶解和反應動力學二個阻力共同控制。隨著富馬酸顆粒溶解,反應液中產物含量逐漸增加,液相溫度逐漸上升,反應轉向受動力學控制,隨著反應的進行可逆性逐漸增強,反應逐步轉向受熱力學控制。
因此,在常壓下為提高富馬酸乙酯化反應的速率,除了采用低溫活性高的催化劑外,反應初期可通過控制較低的醇、酸摩爾比或不移出反應生成的水,使反應在相對高的液相溫度下進行,降低溶解和反應動力學阻力。隨著富馬酸轉化率的增加,反應的可逆性逐漸增強,反應后期應增大醇、酸摩爾比并不斷地將生成的水移出反應系統,從而提高產物的平衡組成并使富馬酸充分轉化。
催化酯化-吸附脫水聯合工藝是采用低溫活性很好的大孔強酸性陽離子交換樹脂NKC-9作催化劑。反應初期由于受溶解和反應動力學二個阻力共同制約,控制在較低的醇、酸摩爾比和不移出反應生成水的條件下進行酯化反應,由于液相溫度較高,酯化反應速度較快。在沸騰狀態下反應一段時間,使部分乙醇將反應生成的水帶出反應體系,經冷凝連續進入外循環分子篩填充床,用3A分子篩吸附混合液中的水,脫水后的混合液連續返回酯化反應器,隨著反應的進行,在較高醇、酸摩爾比的條件下,酯的生成速率遠遠大于酯的水解速率,酯化率很高,反應速率主要由酯化反應動力學決定,酯化為不可逆反應。隨著反應體系中酯的含量增高和酸的含量降低,酯的水解速率加快,酯的生成速率減慢,酯化速率減慢,反應速率受脫水速率和酯化反應動力學共同制約。由于反應生成的水連續地用醇帶出體系,而且3A分子篩在水含量較低時仍有很高的吸附容量,酯化反應的化學平衡不斷地發生移動,使富馬酸能夠更充分地轉化。催化酯化-吸附脫水聯合工藝能夠通過調整醇和酸摩爾比、反應溫度和物料外循環速率,使富馬酸乙酯化反應在最佳反應條件下進行。具有過程能耗低、產品收率高、反應器的生產能力大和分離過程負荷小的特點。
與采用加入提取劑、酯化-精餾耦合和催化精餾工藝相比,催化酯化-吸附脫水聯合工藝是通過設置外循環分子篩填充床,采用分子篩液相吸附脫水技術分離反應生成水,因此過程的能耗較低,同時脫水后的醇連續返回酯化反應器,保證了酯化反應在較高醇、酸摩爾比的條件下進行,酯化反應的化學平衡不斷地發生移動,使富馬酸更充分地轉化。此外,分子篩吸附脫水技術在化學工業中應用廣泛,技術成熟,易于推廣使用。
2.10 產品分析
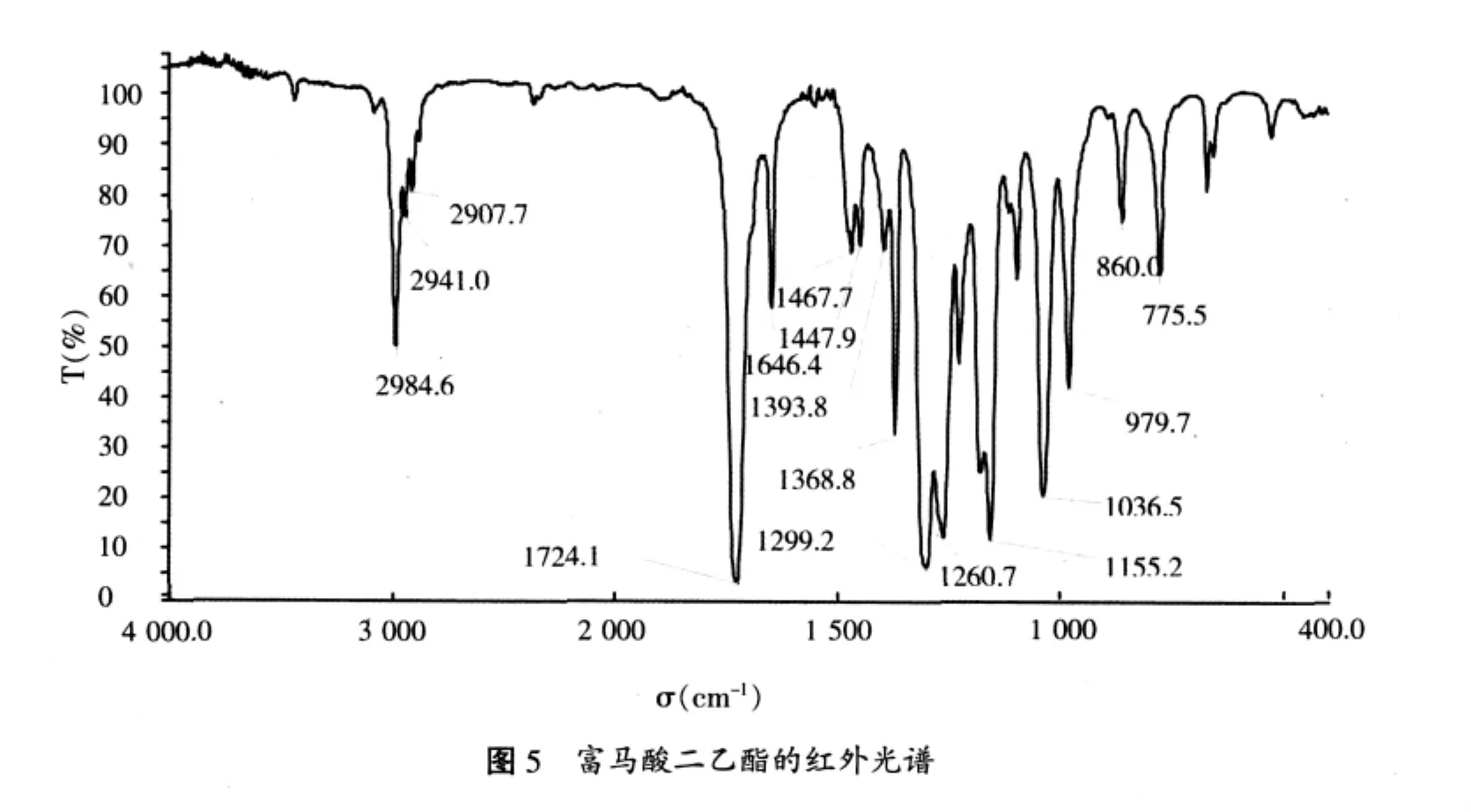
產品的紅外光譜見圖5。2984.6 cm-1CH3中C-H伸展振動,2941.0 cm-1CH2中C-H伸展振動,2907.7 cm-1CH中C-H伸展振動,1724.1 cm-1酯C=O伸展振動,1646.4 cm-1C=C伸展振動,1467.7/1447.0 cm-1CH3不對稱變形振動和CH2變形振動的疊合,1368.8cm-1CH3對稱變形振動,1299.2 cm-1、1260.7 cm-1酯 C-O反對稱伸展振動,1155.2 cm-1(雙峰)酯C-O對稱伸展振動,1036.5 cm-1與酯C-O有關的振動,979.7 cm-1反式雙鍵C-H面外變形振動,860.0 cm-1C-C骨架振動,775.5 cm-1酯C-O-C變形振動。結果與標準譜圖一致,表明為富馬酸二乙酯。
3 結論
①NKC-9陽離子交換樹脂催化劑是催化富馬酸乙酯化合成富馬酸二乙酯的良好催化劑。該催化劑活性高、選擇性好、可重復使用。
②NKC-9催化酯化-吸附脫水聯合工藝合成富馬酸二乙酯的最佳反應工藝條件是n/n0=3.0:1、NKC-9為7.0%(w)、在沸騰或微沸(反應溫度≤120℃)狀態下,反應時間6.0 h。在該條件下富馬酸的轉化率達到98.3%。
③催化劑重復使用6次后,催化活性有所降低,但富馬酸轉化率仍可達到97.8%,催化劑仍具有較高的催化活性。
④催化酯化-吸附脫水聯合工藝是一種環境友好型的新工藝,具有過程能耗低、產品收率高的特點。
18篇,刊略,需者可函索)

