培養基組成對米曲霉產氨基酰化酶的影響
氨基酸的制備方法有蛋白質水解法、微生物發酵法和化學合成法等,其中化學合成法因成本低、適于大規模生產等優點而獨具優勢。但市場大量需要的是單一構型的氨基酸,而化學合成法得到的產物為外消旋混合物,必須通過手性拆分才能得到單一構型的產品。高效、綠色、安全的氨基酰化酶法是拆分氨基酸的最佳方法之一,目前人們主要應用該方法拆分化學合成法生產的氨基酸DL-消旋體。
氨基酰化酶又稱N-酰化氨基酸亞胺基水解酶或酰化酶,是一類能夠水解N-酰基-DL-氨基酸上酰胺鍵的酶。具有光學異構專一性,能夠選擇性地水解N-酰基-DL-氨基酸[1],通過分離即可得到光學純L-或D-氨基酸。因此,高活力和高立體選擇性的氨基酰化酶的生產菌株的選育和產酶條件的優化,是高效、低成本制備氨基酸的基礎。
氨基酰化酶的來源很廣,已經發現的氨基酰化酶廣泛存在于各種動植物的器官內、微生物胞內或發酵液中。氨基酰化酶的制備方法有動植物組織提取法和微生物發酵法,由微生物發酵法制備的氨基酰化酶比動植物提取法制備的更穩定、更經濟、底物專一性更強。
目前,用于氨基酸拆分的氨基酰化酶大多由米曲霉發酵得到。 雖然氨基酰化酶不是米曲霉的主要酶系,但由于其生長速度快、酶活性高、底物專一性強,尤其適于α-氨基和羥基消旋物特別是外消旋氨基酸的大規模拆分。因此,由米曲霉發酵制備大量高活性的氨基酰化酶對化工產品的后續加工非常重要。
作者在此對誘變而得的最優米曲霉菌株的發酵條件進行優化,探求從外界環境進一步提高米曲霉產氨基酰化酶的能力,以使氨基酰化酶的產量和質量達到工業生產的需求,為工業化、規模化生產奠定基礎。
1 實驗
1.1 材料、試劑與儀器
米曲霉菌株,實驗室誘變所得;麩皮,自購。
N-乙酰-DL-蛋氨酸,張家港市華昌藥業有限公司;其余試劑均為國產分析純。
SHZ-82型氣浴恒溫振蕩器,721型可見分光光度計,YXQG02型手提式電熱壓力蒸汽消毒器,SW-CJ-2FD型雙人單面凈化工作臺,各種玻璃器皿。
1.2 培養基
斜面培養基:馬鈴薯200 g,切塊煮沸30 min,過濾得清液,自來水補足1000 mL,加入葡萄糖20 g,瓊脂15~20 g,pH值自然,1×105Pa滅菌30 min。
初始發酵培養基:麩皮0.6 g,蛋白胨0.6 g,硫酸鎂0.03 g,磷酸二氫鉀0.06 g,水30 mL,pH值自然,1×105Pa滅菌30 min。
1.3 方法
1.3.1 斜面培養
接種PDA斜面,于30℃培養4 d,產生大量綠色孢子。
1.3.2 發酵培養
用無菌水分2次洗下斜面上的孢子,在玻璃珠三角瓶內150 r·min-1振蕩15 min,制得孢子懸液。接種3 mL孢子懸液于30 mL發酵培養基中,于30℃、150 r·min-1培養48 h,收獲培養物。發酵液抽濾,將菌絲體用蒸餾水沖洗3次,抽干,稱重。
1.4 酶活測定
取1 g菌體放入100 mL三角瓶中,加入pH值7.0的磷酸緩沖溶液10 mL、0.2 mol·L-1的N-乙酰-DL-蛋氨酸溶液10 mL,于37℃、150 r·min-1搖床振蕩1 h,過濾,濾液在水浴中煮沸10 min,使酶失活。
采用茚三酮顯色法測定拆分出的L-蛋氨酸的物質的量(mmol·L-1):將上述濾液稀釋一定倍數,取稀釋后濾液1 mL,加入pH值5.4的2 mol·L-1醋酸緩沖溶液1 mL和茚三酮顯色液1 mL,混勻后于沸水浴中加熱15 min,自來水冷卻放置5 min后,加入3 mL60%乙醇稀釋,搖勻后用721型分光光度計測定OD570。根據標準曲線計算反應液L-蛋氨酸的物質的量。
酶活定義[2]:在37℃、pH值為7.0的條件下,1 g濕菌體1 h拆分所產生的L-蛋氨酸的微摩爾數。
根據下式計算酶活:
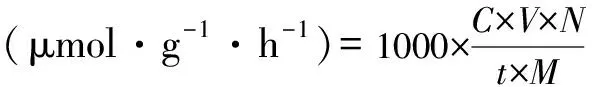
式中:C為L-蛋氨酸的物質的量,mmol·L-1;V為酶促反應的總體積,L(本實驗為0.02 L);N為稀釋倍數;t為搖瓶時間,h(本實驗為1 h);M為濕菌絲用量,g(本實驗為1 g);1000為μmol與mmol的換算基數。
2 結果與討論
2.1 碳源及其含量的選擇
固定培養基的其它條件不變,考察碳源對米曲霉菌株產氨基酰化酶的影響,結果見圖1。
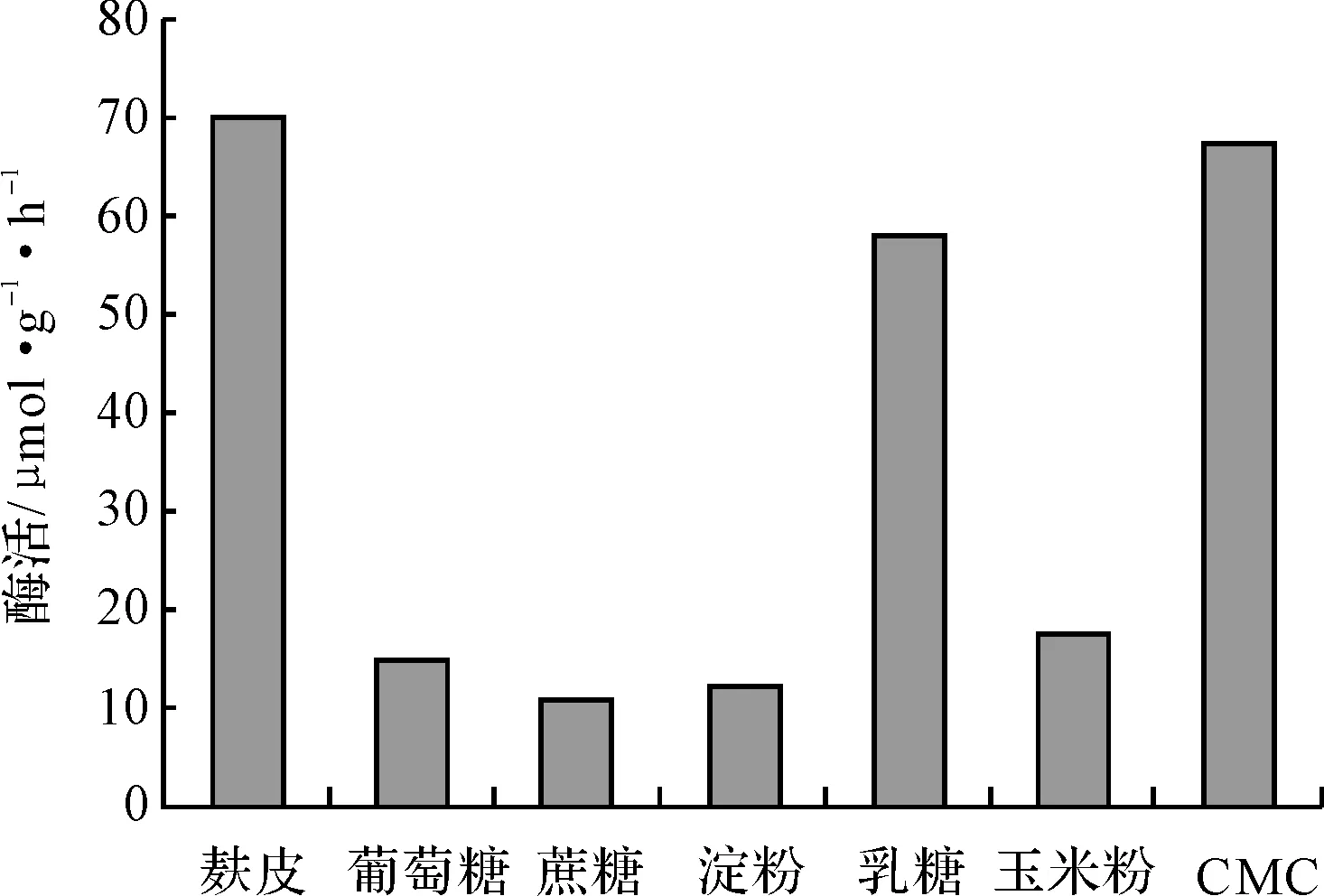
圖1 碳源對米曲霉產氨基酰化酶的影響
從圖1可看出,碳源對氨基酰化酶的酶活影響很大。以葡萄糖、蔗糖、淀粉、玉米粉作為碳源時,氨基酰化酶的酶活很低;以麩皮為碳源時,酶活最高;以乳糖或CMC作碳源時,酶活很高,但菌體量很低。這可能是因為,麩皮不但可以提供菌體生長所需的碳水化合物,而且其含有的微量因子可能對氨基酰化酶的產生有促進作用,同時麩皮能增強培養基的通透性,利于好氧菌的生長[3~5];而以乳糖和CMC作為碳源時,由于菌體大量產酶的同時影響了菌體本身的生長,所以盡管酶活很高,但菌體量很低,而且用CMC作為碳源的發酵液極其粘稠,不易分離。因此,選擇麩皮為適宜的碳源。
以麩皮為碳源,考察其含量對米曲霉產氨基酰化酶的影響,結果見圖2。
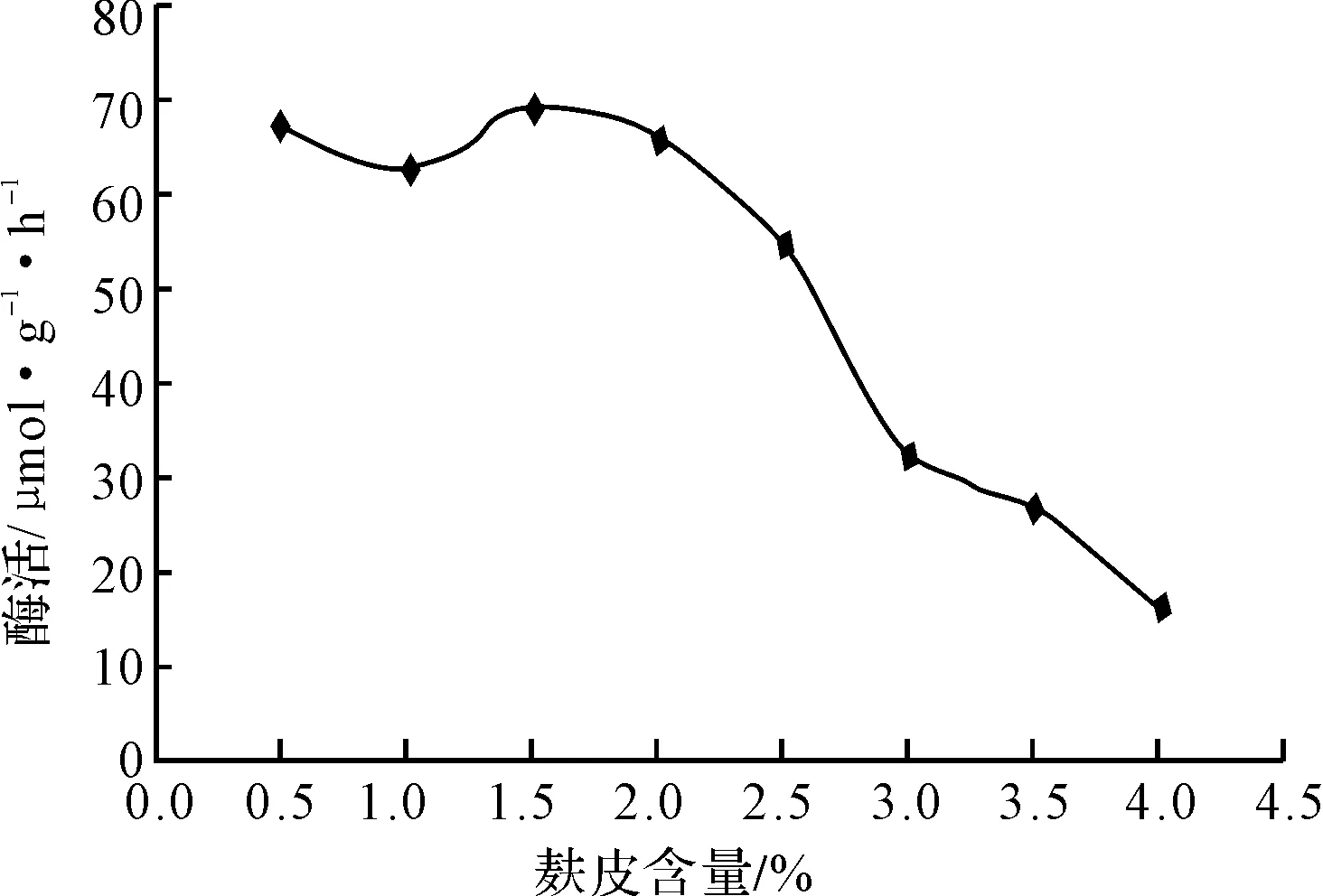
圖2 麩皮含量對米曲霉產氨基酰化酶的影響
從圖2可看出,麩皮含量為1.5%時,氨基酰化酶的酶活最高;隨著麩皮含量的增加,菌體量明顯增加,酶活反而下降。這可能是麩皮中某種微量元素的增加造成的,該元素可能特異性促進菌體生長,而不促進或者抑制酶的分泌。
2.2 氮源及其含量的選擇
固定培養基的其它條件不變,考察氮源對米曲霉菌株產氨基酰化酶的影響,結果見圖3。
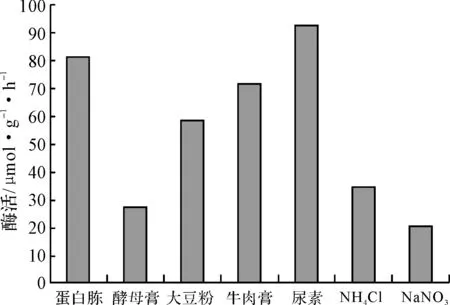
圖3 氮源對米曲霉產氨基酰化酶的影響
從圖3可看出,選用無機氮源時氨基酰化酶的酶活較低,而有機氮源大多能提高氨基酰化酶的酶活,其中尿素為氮源時的酶活最高。因此,選擇尿素為適宜的氮源。
陳曦等[6]報道,培養基的不同成分可誘發產生不同的酶;孫春華等[7]報道,尿素對米曲霉產蛋白酶的影響很小;從本實驗可看出,尿素對米曲霉產氨基酰化酶有很大的影響。以尿素為氮源,考察其含量對米曲霉產氨基酰化酶的影響,結果見圖4。
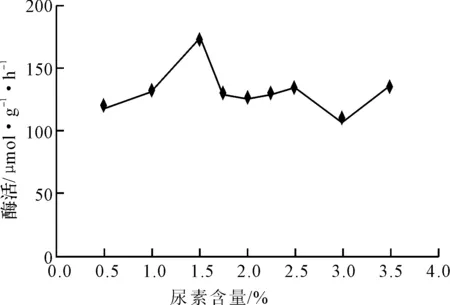
圖4 尿素含量對米曲霉產氨基酰化酶的影響
從圖4可看出,當尿素的含量為1.5%時,米曲霉產氨基酰化酶的酶活最高。
2.3 磷酸鹽及其含量的選擇
磷在微生物生長繁殖過程中起著重要作用,它既是合成核酸、磷脂等含磷化合物的重要元素,又是代謝過程中許多酶或輔酶的重要組成元素。
以發酵培養基為基礎,考察磷酸鹽對米曲霉產氨基酰化酶的影響,結果見圖5。

圖5 磷酸鹽對米曲霉產氨基酰化酶的影響
從圖5可看出,在含磷酸二氫鈉的培養基中,米曲霉產氨基酰化酶的酶活較高。因此,選擇磷酸二氫鈉作為磷酸鹽。
磷酸二氫鈉含量對米曲霉產氨基酰化酶的影響見圖6。
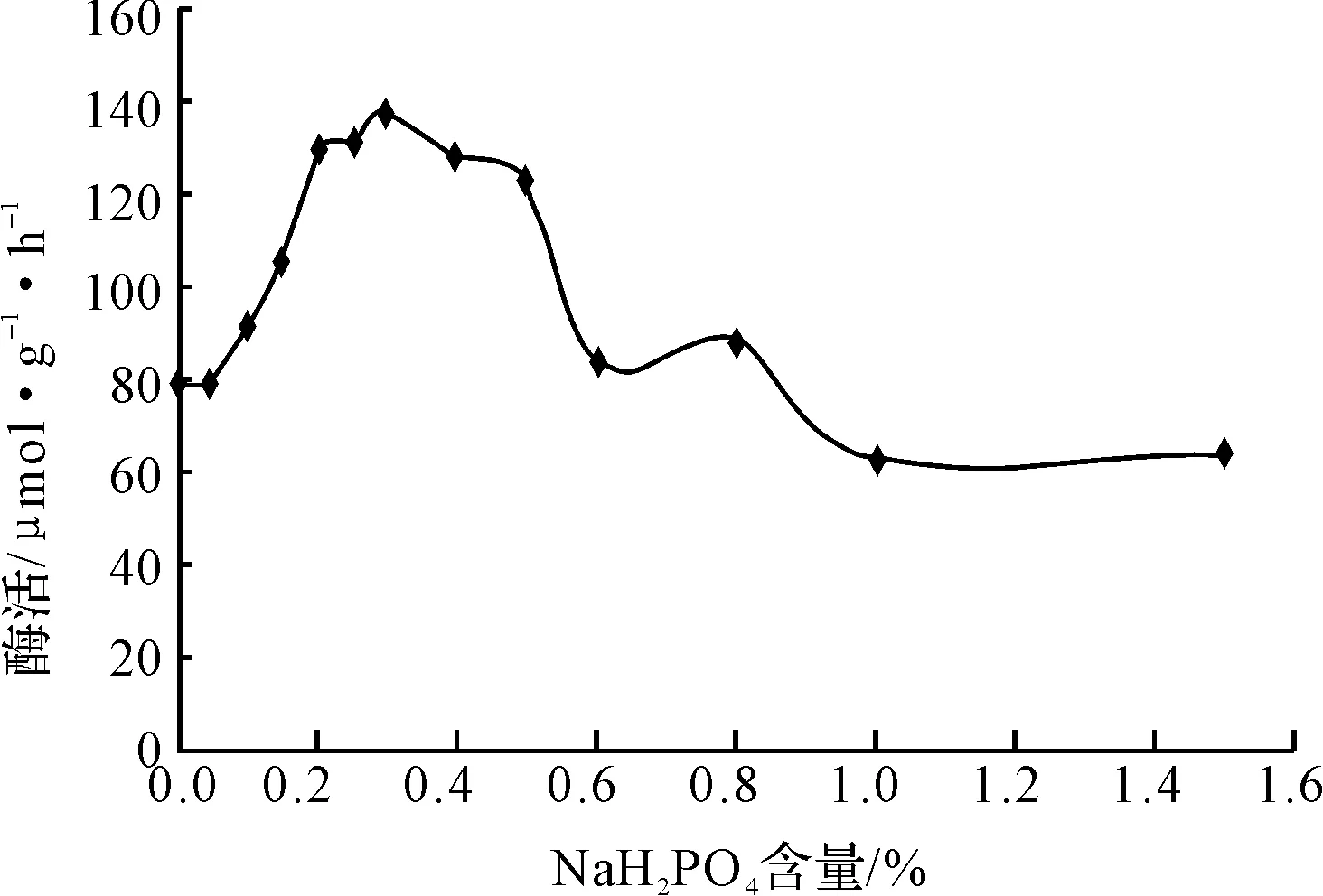
圖6 磷酸二氫鈉含量對米曲霉產氨基酰化酶的影響
從圖6可看出,當磷酸二氫鈉含量為0.2%~0.4%時,酶活較高;當其含量大于0.6%后,對米曲霉產氨基酰化酶不僅沒有促進作用,反而有所抑制。這可能是由于隨著磷酸二氫鈉含量的增加,發酵培養基的pH值下降較大,因而抑制了菌體產酶。
2.4 表面活性劑及其含量的選擇
Tween-80等表面活性劑通常可以增強菌體細胞膜的通透性,利于菌體攝取營養成分,并能促進酶等代謝物分泌到胞外。郭海風[8]報道,表面活性劑對米曲霉產β-葡萄糖苷酶并無促進作用。固定培養基其它條件不變,考察表面活性劑對米曲霉產氨基酰化酶的影響,結果見圖7。

圖7 表面活性劑對米曲霉產氨基酰化酶的影響
從圖7可看出,與不加任何表面活性劑相比,在培養基中加入表面活性劑Tween-80對酶活的增加稍有促進,其中加入0.1% Tween-80效果更好;而加入Span-80則稍有抑制。因此,選擇在培養基中加入0.1%的Tween-80。
2.5 鎂離子及其含量的選擇
添加鎂離子有利于米曲霉產酶[9]。固定培養基其它條件不變,考察鎂離子含量對米曲霉產氨基酰化酶的影響,結果見圖8。
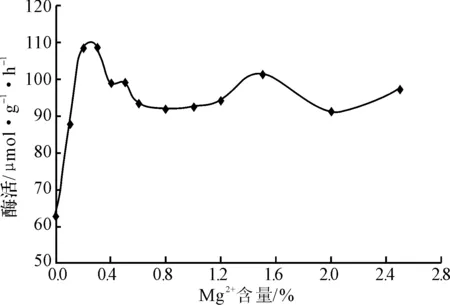
圖8 Mg2+含量對米曲霉產氨基酰化酶的影響
從圖8可看出,隨著Mg2+含量的增加,酶活逐漸升高;在Mg2+含量為0.2%~0.3%時,酶活達到最高;而后酶活隨著Mg2+含量的增加反而降低;當Mg2+含量達到0.6%后,酶活的變化不大。因此,在培養基中加入適量Mg2+可以促進產酶。
2.6 正交實驗
根據單因素實驗結果,培養基的碳源、氮源、磷酸鹽及鎂離子對米曲霉產氨基酰化酶均有較大影響,進一步采用L9(34)正交實驗確定最佳的培養基組成,實驗結果與分析見表1。
從表1可知,各因素對米曲霉產氨基酰化酶影響大小依次為:硫酸鎂>尿素>麩皮>磷酸二氫鈉,其培養基中最適含量為:麩皮2%、尿素1.5%、磷酸二氫鈉0.3%、硫酸鎂0.35%,添加Tween-80 0.1%。以此培養基發酵3批樣品,平均酶活為440.51 μmol·g-1·h-1。
3 結論
通過單因素實驗,確定最佳碳源為麩皮,最佳氮源為尿素,磷酸鹽、鎂離子、Tween-80對米曲霉產氨基酰化酶均有促進作用。通過正交實驗確定最優培養基為:麩皮2%、尿素1.5%、磷酸二氫鈉0.3%、硫酸鎂0.35%、Tween-80 0.1%,酶活可高達440.51 μmol·g-1·h-1。與優化前相比,單位酶活提高6倍左右。

表1 正交實驗結果與分析
參考文獻:
[1] Chibata I,Ishikawa T,Yamada S.L-Amio acid production by aminoacylase fromAspergillus[J].Bull Agr Chem Soc Japan,1957,21:300-306.
[2] 王淑豪,宋正孝,馬忠海,等.米曲霉3042的液體培養特性及其產氨基酰化酶的特性研究[J].食品科學,2000,21(7):9-11.
[3] Acuna-Arguelles M E,Gutierrez-Rojas M,Viniegra-Gonzalez G, et al.Production and properties of three pectinolytic activities produced byAspergillusnigerin submerged and solid-state fermentation[J].Appl Microbiol Biotechnol, 1995, 43(5): 808-814.
[4] Kitano H,Kataoka K,Furukawa,et al.Specific expression and temperature-dependent expression of the acid protease-encoding gene(pepA) inAspergillusoryzaein solid-state culture(rice-koji)[J]. J Biosci Bioeng, 2002, 93(6): 563-567.
[5] 石開風,曹飛,周華,等.米曲氨基酰化酶液態發酵條件的研究[J].食品與發酵工業,2004,30(7):78-81.
[6] 陳曦,趙建國.飼用酶高產菌株的篩選[J].飼料工業,2006,27(6): 14-15.
[7] 孫春華,燕磊,常維山.不同碳源和氮源對米曲霉產酶影響的研究[J].西南農業學報,2007,20(5):986-990.
[8] 郭海風.β-葡萄糖苷酶產生菌及其發酵培養基的優化[J].揚州職業大學學報,1999,3(4):7-12.
[9] 董靜,孟憲軍.米曲霉UC6-90產曲酸的發酵培養基優化[J].食品研究與開發,2007,28(6):52-56.

