豆類來源D-海因酶的提取及特性研究
D-對羥基苯甘氨酸(D-HPG)是一種重要的醫藥精細化學品,白色結晶粉末,是合成β-內酰胺類半合成抗菌素的側鏈,用于生產阿莫西林、頭孢等抗菌素藥物。目前D-HPG的生產方法有化學合成法和生物轉化法兩種。化學合成法得到的是外消旋的對羥基苯甘氨酸,需要經過拆分才能得到光學純的D型氨基酸,同時存在原料昂貴、產量低、反應時間長以及產生大量廢棄物等缺點,逐漸被淘汰。生物轉化法是以化學合成的DL-對羥基苯海因 (D,L-p-Hydroxyphenylhydantoin,DL-HPH) 作為生物酶作用的底物,利用D型特異的生物酶將其轉化為D-HPG。D-海因酶( D-Hydantoinase,DHase) 和N-氨甲酰水解酶(N-Carbamoylase,DCase) 是生物酶法合成D-HPG中起催化作用的兩種酶,由于大部分篩選的海因酶是二氫嘧啶酶,且為D-選擇性的,所以許多文獻都將DHase等同于二氫嘧啶酶。從D-5單取代海因得到D-氨基酸,先后經過兩個步驟:DHase催化底物DL-苯海因或DL-對羥基苯海因生成N-氨甲酰基-D-苯甘氨酸或N-氨甲酰基-D-對羥基苯甘氨酸,再在DCase的作用下生成D-苯甘氨酸(D-PG)或D-HPG[1]。
目前應用較多的海因酶大多從微生物或動物中提取,研究表明二氫嘧啶酶也存在于豆類、番茄和小麥等植物中[2],但是植物來源的二氫嘧啶酶的提取及特性還未見報道,也未見有用于工業化生產D-氨基酸的研究。作者從幾種豆子中提取二氫嘧啶酶并進行酶活測定,從中篩選到D-海因酶酶活較高的紅小豆,并對紅小豆來源的D-海因酶特性進行了研究。
1 實驗
1.1 材料與試劑
紅小豆、花紅小豆、蕓豆、綠豆、黑豆、豌豆,市售。
DL-對羥基苯海因、5-芐海因、5-苯海因、5-甲基海因、對二甲氨基苯甲醛(PDAB),上海邦成化工有限公司。
1.2 D-海因酶的提取及純化
紅小豆、花紅小豆、蕓豆、綠豆、黑豆、豌豆去皮,各稱取2 g,用20 mL pH值9.0的硼酸緩沖溶液將其研磨充分,4℃、8000 r·min-1離心60 min。取上清于錐形瓶中,55℃放置10 min以去除熱不穩定性蛋白。4℃、12 000 r·min-1離心10 min,取上清分別加入適量硫酸銨,使其成為40%、50%、60%、70%的飽和溶液,4℃反應1 h后于4℃、12 000 r·min-1離心10 min,棄上清,將沉淀溶于5 mL pH值7.0的Tris緩沖溶液中,-20℃儲存。
1.3 D-海因酶酶活的測定
4.5 mL 0.4% 底物溶液于37℃預熱15 min,加入0.5 mL酶液(對照加入0.5 mL 50 mmol·L-1pH值7.0 Tris緩沖溶液),37℃反應30 min,加入5滴6 mol·L-1HCl終止反應,反應液于8000 r·min-1離心10 min,取上清加入2 mL 5% PDAB溶液,于438 nm測吸光值。
以每分鐘轉化1 μmol 底物所需的酶量為一個酶活單位U[3]。
1.4 SDS-PAGE
將蛋白樣品與等體積的2× SDS 上樣緩沖溶液 (0.1 mol·L-1Tris-Cl,10%β-巰基乙醇,0.005% 溴酚藍,20% 甘油,4%SDS,pH值6.8) 混合后煮沸 10 min,經 12 000 r·min-1離心10 min,取上清進行SDS-PAGE。以 50 V 電壓電泳至樣品在積層膠和分離膠界面上被壓成細線。再以120 V電壓電泳1~2 h。電泳結束后以考馬斯亮藍 R250染液染色 4 h 以上,并以甲醇-冰乙酸脫色液脫色[4]。
2 結果與討論
2.1 不同豆類來源D-海因酶酶活和底物特異性
以不同的單取代海因作為底物,以70%硫酸銨沉淀溶解液為酶液,檢測不同豆類來源的D-海因酶的活力,結果如表1所示。
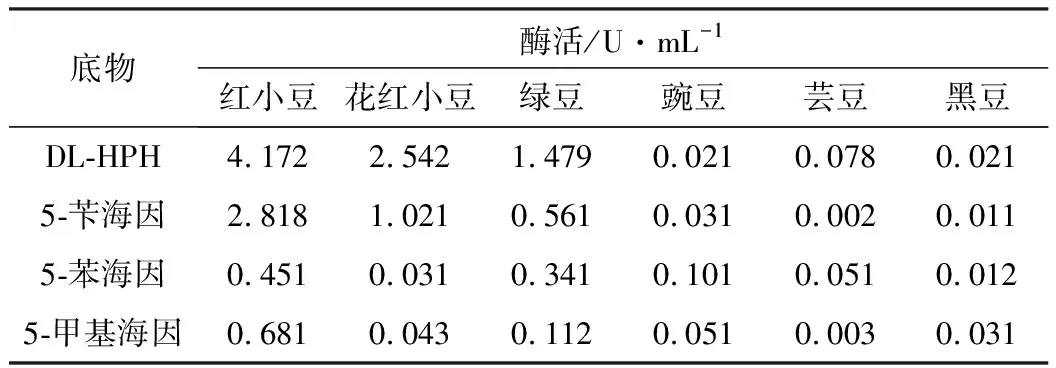
表1 不同豆類來源D-海因酶酶活及底物特異性
從表1可以看出,紅小豆、花紅小豆、綠豆提取物含有D-海因酶活力,而豌豆、蕓豆、黑豆幾乎沒有D-海因酶活力。其中紅小豆來源的D-海因酶酶活最高,最佳的底物是DL-HPH。后續實驗均以紅小豆來源的D-海因酶為研究對象。
2.2 不同濃度硫酸銨沉淀溶解液的D-海因酶酶活
為了獲得最佳的硫酸銨濃度,對紅小豆來源的D-海因酶進行了5種濃度的沉淀實驗,并測定了以DL-HPH為底物時,在不同硫酸銨濃度下獲得的沉淀溶解液的D-海因酶酶活,結果如表2所示。

表2 不同濃度硫酸銨沉淀溶解液的D-海因酶酶活
從表2可以看出,70%硫酸銨沉淀獲得的酶液酶活最高。
2.3 不同濃度硫酸銨沉淀溶解液的SDS-PAGE 檢測
對不同濃度硫酸銨沉淀的溶解液進行SDS-PAGE電泳分析,結果如圖1所示。

1.粗提液 2~6.40%、50%、60%、70%、80%硫酸銨沉淀溶解液
從圖1可以看出,研磨得到的紅小豆粗提液蛋白質種類多,經過不同濃度的硫酸銨沉淀后蛋白質種類減少,并且在分子量為100 kD處有單一蛋白的富集,其中70%硫酸銨沉淀中蛋白純度最高,只有一條明顯的蛋白帶,表明該濃度下D-海因酶酶活最高,由此可以推斷此蛋白帶為D-海因酶。由于D-海因酶亞基的分子量在50~60 kD,而D-海因酶活性形式大多是同型二聚體或四聚體[5],本研究結果表明D-海因酶在紅小豆中以二聚體形式存在。
2.4 酶促反應的最佳條件
2.4.1 反應溫度
將紅小豆來源的70%硫酸銨沉淀的酶液在不同的溫度下進行反應,測定酶活,結果如表3所示。
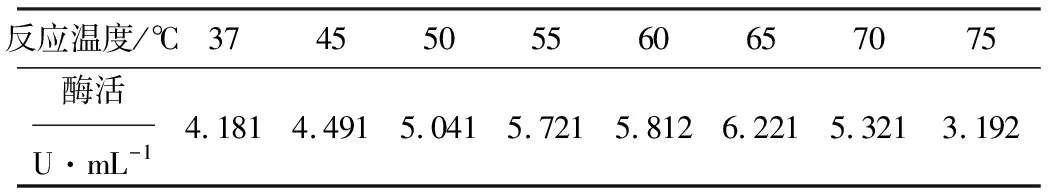
表3 不同反應溫度下的D-海因酶酶活
從表3可以看出,酶活隨著反應溫度的升高逐漸增大,在65℃達到最大值,說明65℃是酶促反應的最佳反應溫度。
2.4.2 pH值
在65℃下,測定pH值對酶活的影響,結果如表4所示。

表4 不同pH值下的D-海因酶酶活
從表4可以看出,酶促反應的最佳pH值為8.0。
2.4.3 底物濃度
以DL-HPH為底物,測定不同底物濃度下D-海因酶的酶活,結果如表5所示。
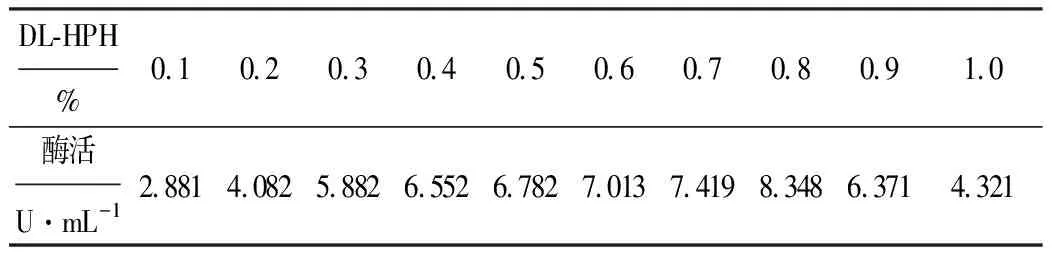
表5 不同DL-HPH濃度下的D-海因酶酶活
由表5可以看出,DL-HPH濃度為0.8%時,D-海因酶酶活最高,達8.348 U·mL-1。
2.5 討論
與微生物來源的D-海因酶相比,紅小豆來源的D-海因酶有以下優點:(1) 不受底物溶解度的影響。海因及其單取代衍生物水溶性很低,需要借助助溶劑以提高底物在培養基中的溶解性[6],吐溫-80、DMSO、CTAB和戊二醛都是有效的助溶劑,可以改善底物的溶解性。但是由于上述試劑同時改變了細胞膜的通透性,降低了細胞對熱和有機溶劑的穩定性,從而降低了酶活,因此必須控制使用的濃度,使得底物溶解度仍然有限,從而限制了對羥基苯甘氨酸的產量,而紅小豆來源的D-海因酶不受活細胞的影響,可以最大限度地提高底物的溶解度,從而提高產率。(2) 紅小豆來源的D-海因酶熱穩定性高。高溫可以增大海因的可溶性并加快其自消旋的速度[7],從而提高產率,本研究表明紅小豆來源的D-海因酶最佳反應溫度為65℃,比一般微生物來源的D-海因酶耐受溫度高出20~30℃,可有效提高產率。
3 結論
本研究對豆類來源的二氫嘧啶酶的提取方法進行了探索,并成功用70%硫酸銨對酶進行了最大量的沉淀和富集,對市面常見幾種豆子進行了D-海因酶活力測定和分析,結果表明紅小豆、花紅小豆、綠豆具有D-海因酶活性,其中紅小豆來源的D-海因酶酶活最高。對影響酶促反應的相關因素進行單因素分析,在以0.8%DL-HPH為底物、pH值為8.0、反應溫度為65℃的最佳酶促反應條件下,D-海因酶活力最高,達8.348 U·mL-1。
參考文獻:
[1] 董妍玲,譚新國,潘學武.海因酶法制備 D-對羥基苯甘氨酸的研究進展[J].氨基酸和生物資源,2009,31(3): 47-52.
[2] Tintemann H, Wasternack C, Helbing D,et al.Pyrimidine degradation in tomato cell suspension cultures and inEuglenagracilislocalization of enzymes[J].Comp Biochem Physiol,1987,88B(3): 943-948.
[3] 嚴希康.生化分離技術[M].上海:華東理工大學出版社,1996:29-38.
[4] Kruger N J.The Bradford Method for Protein Quantitation.The Protein Protocols Handbook (2nd edition)[M].Totowa N J: Humana Press,2002:15-21.
[5] Cheon Y H,Kim H S,Han K H,et al.Crystal structure of D-hydantoinase fromBacillusstearothermophilus: Insight into the stereochemistry of enantioselectivity[J].Biochemistry,2002,41(30):9410-9417.
[6] Yin B D,Chen Y C,Lin S C,et al.Production of D-amino acid precursors with permeabilized recombinantEscherichiacoliwith D-hydantoinase activity[J].Process Biochemistry,2000,35(9):915-921.
[7] Chung J H,Hack J H,Lim J H,et al.Thermostable hydantoinase from a hyperthermophilic archaeon,Methanococcusjannaschii[J].Enzyme and Microbial Technology,2002,30(7):867-874.

