山羊原始生殖細胞分離與培養的影響因素
熊 浩,崔 雯,王杏龍,劉 翔
(揚州大學動物科學與技術學院,江蘇 225009)
哺乳動物原始生殖細胞(primordial germ cells,pGGs)在一定條件下維持未分化狀態,經過體外長期培養可以建立胚胎性干細胞系,稱為EGCs,這也是另一來源的胚胎干細胞(embryonic stem cells,ESCs)。PGCs用于 ESCs的分離與克隆始于1992年,Matsui等[1]對小鼠PGCs長期培養,建立了EGCs系,此后,用PGCs分離與克隆ESCs又在大鼠、豬、牛、山羊等動物上取得重要進展。但是目前只在小鼠上成功建系,而在其他物種上成功建系的卻不多,尤其在國內,從山羊PGCs來源培養出長期穩定增殖的ESCs并且建系成功的報道至今未見。本實驗從本地白山羊的早期胎兒生殖嵴中分離PGCs,將PGCs進行培養和傳代,從而得到ESCs,將其在不同的條件下培養,初步分析了各種不同條件對培養效果的影響。
1 材料與方法
1.1 材料
試劑:高糖DMEM、非必需氨基酸(non-essential amino acid):Gibco 公司;LIF、SCF:Sigam 公司;胎牛血清(FBS):杭州四季青公司;L-谷氨酰胺(L-glutamine)、胰蛋白酶(trypsinase)、牛血清白蛋白(BSA)、膠原酶(collagenase):上海生工生物工程有限公司。
成纖維細胞培養液:DMEM培養液+10%FBS+0.1 mmol/L β-巰基乙醇+2 mmol/L L-谷氨酰胺+1 mmol/L丙酮酸鈉+100 u/mL青鏈霉素。
ESCs培養液:DMEM 培養液+15%FBS+0.1 mmol/L β-巰基乙醇+2 mmol/L L-谷氨酰胺+0.01 mM非必需氨基酸+1 mmol/L丙酮酸鈉+100 u/mL青鏈霉素+不同濃度的各種細胞因子。
細胞凍存液:80%的DMEM培養液+10%的FBS+10%的DMSO,短期4℃低溫保存。
1.2 方法
1.2.1 山羊胎兒成纖維細胞的制作(GEF) 本地白山羊早期胎兒從江蘇省丹陽市珥玲山羊交易市場收集。要求收集到的子宮表面無嚴重污染。如果直接從山羊體內獲取子宮,則迅速投入到4℃含有200 u/mL的青鏈霉素的生理鹽水中;如果從屠宰后的廢棄內臟中獲取子宮,則以碘酊和75%的乙醇先后擦拭凈子宮表面,以除去覆蓋的異物,再以生理鹽水沖洗子宮表面,然后剪開子宮取出胎兒(不能剪破羊膜),迅速投入到4℃的生理鹽水中,收集完后帶回實驗室。參考王國云等[2]制作小鼠胎兒成纖維細胞的方法制作GEF,于38.5℃、5%CO2培養箱中培養。
1.2.2 飼養層的制作 選取剛好鋪滿瓶底,生長良好的2~4代成纖維細胞制備飼養層。
1.2.3 山羊原始生殖細胞的培養 取材方法與上同。在體視顯微鏡下無菌剝離胎兒生殖嵴及其周圍的復合物,充分剪碎,室溫(25℃)下在組織塊中加入消化液,邊消化邊用移液器不停的吹打。以等體積的含10%FBS的DMEM培養液中止消化,搖勻,100目紗網過濾細胞懸液,1 000 r/min離心5 min,去掉上清液,再加入ESCs培養液,調整細胞密度為105個/mL,于38.5℃、5%CO2培養箱中培養。24 h后觀察細胞生長狀況,更換培養液以去除死細胞,以后待發現培養液變黃時便換液。PGCs集落周圍出現分化細胞之前應立即進行傳代,傳代細胞培養的條件同上。
1.2.4 試驗設計
1)參照文獻[3]給山羊胎兒分類的方法,取胎兒冠臀長15~30 mm的胎兒。試驗設計2)~4)均采用冠臀長為15~30 mm的胎兒,室溫(25℃)下消化15 min,在原代培養中使用不同濃度的消化液:0.25%胰酶+0.04%EDTA和0.125%胰酶+0.02%EDTA,比較兩種消化方式對原代集落形成的影響。
2)使用以下兩種方法進行傳代
方法一:將觀察到的典型集落的細胞培養板中的培養液吸去,然后以細玻璃針挑出集落,無菌條件下以細針離散集落塊,移入離心管中,加入適量的0.05%的胰酶,以移液器吹打2~3 min,再加入ESCs培養液,然后再接種于飼養層上繼續培養。
方法二:將觀察到的典型集落與飼養層在0.125%胰酶+0.02%EDTA一起消化,顯微鏡下觀察到集落開始逐漸散開時立即以等體積含10%FBS的DMEM培養液中止消化,將細胞懸液轉移至離心管中,吹打搖勻,1 000 r/min離心5 min,去上清液,加入ESCs培養液,先將細胞懸液置于培養瓶中,放在培養箱中培養45 min,然后小心傾斜培養瓶,倒出培養液于飼養層上,這樣可以除去一部分貼壁的成纖維細胞,再接種于新的飼養層上進行培養。
比較兩種不同傳代方式對細胞傳代的影響。
3)以第一步實驗為結果,選取最好的飼養層培養方式,然后在培養基中添加不同濃度的因子:①LIF:10 ng/mL;②LIF:20 ng/mL;③LIF(10 ng/mL)+SCF(10 ng/mL);④LIF(20 ng/mL)+SCF(20 ng/mL),比較不同培養方式下原代和傳代培養的效果。
4)選取冠臀長小于15 mm胎兒和大于30 mm的胎兒進行培養,比較以這兩種冠臀長的胎兒為材料培養PGCs的效果。
1.2.5 AKP染色鑒定 室溫下,吸去培養液,以PBS溶液清洗3次;以4%多聚甲醛固定10 min(此時配制顯色液:向 1mL超純水中加入一滴 A(NBT)和 B(BCIP)液,混勻后靜置);吸去多聚甲醛,加入適量的顯色液,暗室放置10~30min,期間觀察,以便拍出不同的顯色效果。
2 結果與分析
2.1 PGCs的生長 剛分離的PGCs在體外培養時,開始培養的初期是處于游離期的。24 h以后可見小的集落形成,72 h后就可以見到明顯的集落形成。山羊PGCs呈山苞狀、鳥巢狀和島狀,形態不規則,凸起于成纖維細胞飼養層之上,集落與周圍的成纖維細胞聯系較為緊密,集落內的細胞間隙不明顯。傳代后即EGCs,山羊EGCs在24~48 h內也會形成小的集落,培養到約72 h后可見明顯的集落形成,與ESCs的生長行為類似,培養到5~6 d后在顯微鏡下可見到很典型的克隆突出于飼養層表面,與PGCs具有相似的形狀。
2.2 不同胰酶濃度的消化對原代集落和傳代的影響 以0.25%胰酶+0.04%EDTA和0.125%胰酶+0.02%EDTA兩種濃度消化液進行消化,結果發現,在室溫下消化15 min的時候,前者消化得到的原代集落的形成率較高(120%),而后者的消化的效果不好(25%),傳代數也低于前者,兩者差異顯著(P<0.05)。
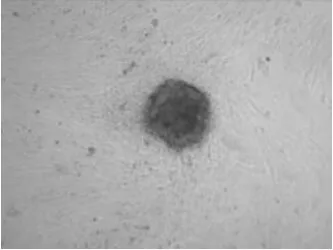
圖1 山羊原始生殖細胞(GEF飼養層)100×
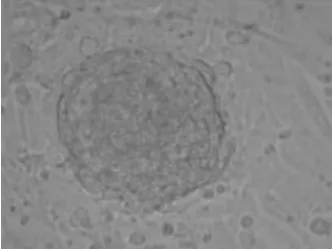
圖2 山羊胚胎生殖細胞(GEF飼養層) 200×

表1 不同胰酶濃度的消化對原代集落和傳代的影響
2.3 不同傳代方式對傳代的影響 以結果2.2中的原代集落為樣本,以兩種方式進行傳代,結果發現無論是挑取集落傳代還是以0.125%胰酶+0.02%EDTA消化傳代,均能將PGCs傳至2代。第1代集落的形成率分別為42.9%和57.1%,第2代集落形成率分別為14.3%和28.6%,結果表明兩者無顯著差異(P>0.05),在本次試驗中兩種傳代方式都適合于PGCs的傳代培養。

表2 不同傳代方式對傳代的影響
2.4 不同種類和濃度的細胞因子對PGCs原代和傳代的影響 在培養液中添加不同種類和濃度的因子,以GEF為飼養層培養,結果如表3所示,統計每組每次形成的集落個數,每個組重復3次。結果顯示,無論使用LIF還是LIF+SCF都可以使PGCs進行傳代培養,而增加兩種細胞因子的濃度似乎與原代和傳代培養的效果無關,兩者差異不顯著(P>0.05),且均能將原代集落培養至第2代。
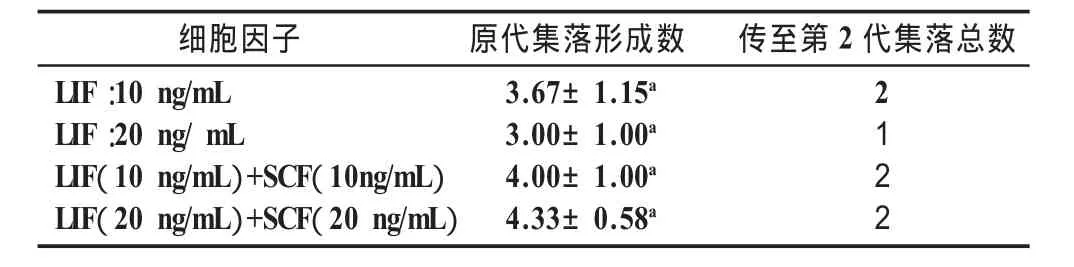
表3 不同種類和濃度的細胞因子對PGCs原代和傳代的影響
2.5 不同胎齡段山羊PGCs培養的效果 本次試驗采用冠臀長小于15 mm和大于30 mm的胎兒進行培養,如表4。采樣4個胎兒為冠臀長小于15 mm,只有1個原代集落形成,且沒有能夠傳代;而采樣的6個冠臀長大于30 mm的胎兒中沒有形成原代集落,試驗結果也證實了只有冠臀長在15~30 mm的胎兒的生殖嵴適合于培養PGCs。

表4 不同胎齡段山羊PGCs培養的效果
2.6 山羊PGCs的鑒定 AKP染色鑒定結果如圖3、圖4。PGCs和EGCs被染成紅棕色,與ESCs染色結果一樣呈陽性。
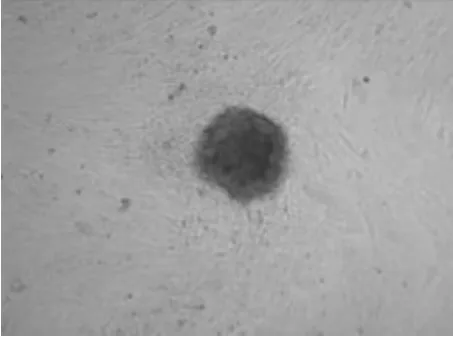
圖3 AKP染色的PGCs(GEF飼養層)100×
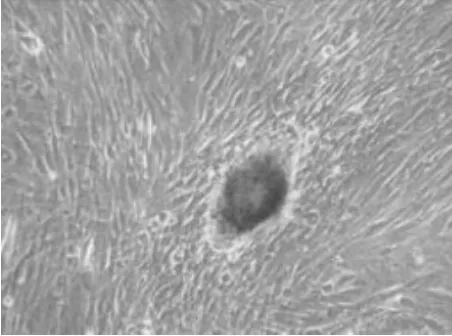
圖4 AKP染色的第2代EGCs 100×
3 討論
3.1 細胞因子的影響 在從PGCs中分離ESCs時,多數學者不但使用了飼養層,同時還在培養液中添加各種細胞因子,細胞因子一方面抑制ESCs的分化(分化抑制因子),另一方面刺激細胞的分裂增殖(生長因子)。李松[4]研究發現,采用牛PGCs與其胎兒成纖維細胞共培養的方式添加細胞因子與否對牛PGCs分離的影響并不顯著,而傳代過程中則最好添加因子,培養基中添加細胞因子與否對PGCs的原代集落形成和傳代有重要影響,可能是飼養層分泌的因子遠遠不能維持PGCs的生存和未分化狀態,必須要添加外源因子。葛秀國等[5]以3個不同質量濃度LIF的培養液培養PGCs,在原代培養時,效果差異不顯著(P>0.05);而在傳代過程中,以含LIF 10 ng/mL組培養效果最好,但與含LIF 5ng/mL組差異不顯著(P>0.05),而LIF 1 ng/mL組培養效果較差(P<0.05)。楊麗芬[6]研究結果為,添加LIF+SCF后EGCs的克隆代數高于單獨添加LIF,培養效果較好。本研究在培養液中添加LIF+SCF,與單獨添加LIF比較,對培養效果也沒有顯著影響(P>0.05),即使增加這兩種因子的濃度,差異也不顯著(P>0.05),這可能是LIF是PGCs生長和維持未分化狀態最重要的細胞因子,并不是因子種類越多,濃度越大就會使得PGCs的原代集落增多和傳代次數增加。
3.2 不同消化方式對PGCs分離培養的影響 現在大多數采用的是胰酶+EDTA消化再以輔助吹打分離得到PGCs。許新[7]在37℃下,使用0.02%EDTA消化包含PGCs的組織15 min,然后再用吸管輕輕吹打來獲得PGCs。李松[4]以0.2%胰酶+0.04%EDTA的消化液綜合作用,對分離牛PGCs的效果好。本試驗在室溫下,以0.125%胰酶+0.02%EDTA消化效果遠遠好于0.25%胰酶+0.04%EDTA,以0.25%胰酶+0.04%EDTA消化方式消化組織,細胞活率較低,這種消化方式下細胞死亡較多,培養時形成的集落會少,且無法得到傳代的集落。以0.125%胰酶+0.02%EDTA來消化組織,再輔以機械吹打便可得到較多的原代集落,細胞活率較高。
3.3 傳代方式對集落形成的影響 楊煒峰[3]研究表明,機械法(輔助酶消化法)可以獲得較高的山羊PGCs的傳代數。本試驗采用挑取集落法和胰酶消化法兩種方法,結果顯示兩種傳代方法對傳代數和新集落形成率沒有顯著差異(P>0.05),第一種方法能較好分散開細胞塊;第二種方法只要掌握好胰酶的作用濃度和作用的時間,也有利于新集落的形成和傳代。在實際操作中,要根據不同的集落生長狀況以及各個實驗室的條件選擇適應的傳代方法,或者同時使用幾種方法,才能提高傳代效率和得到較好的新集落。
3.4 胎齡的影響 用于分離培養PGCs的胎兒的胎齡是有一定限制的,不同胎齡段的胎兒分離培養PGCs的效果也不同。Lee等[8]從25 d山羊胎兒分離得到PGCs,Kuhholzer等[9]用32 d山羊胎兒分離建立了 PGCs系。韓建永等[10]從44 d山羊胎兒生殖嵴中分離得到PGCs。楊煒峰[3]研究結果顯示胎兒胎齡大于45 d(冠臀長大于30 mm)的胎兒也可以得到PGCs。本試驗由于胎兒全部取自屠宰場,沒有系統的白山羊資料記載,所以只能以胎兒冠臀長來進行分類。臀長小于15 mm的胎兒,僅得到1個原代集落,這可能是由于胎齡過小,雖然PGCs分化程度低,越具有多能性,但是其中PGCs含量過少,或者PGCs還未完全遷移至生殖嵴中;冠臀長大于30 mm的胎兒,沒有得到原代的克隆集落,這可能是由于胎齡過大,此時生殖嵴已經發育成為性腺,大部分的PGCs轉化為性原細胞,從而無法獲得集落,在試驗過程中還觀察到此胎齡段的胎兒組織塊不易消化,消化時間太短無法離散組織,消化時間太長又對細胞造成傷害,影響細胞活力。
3.5 其它因素的影響 本試驗中PGCs傳至第2代后大多數凋亡或者發生分化,無法繼續傳代。原因可能有以下幾個方面:
采集的胎兒全部來自于屠宰場,從屠宰地點收集胎兒運輸到實驗室耗費的時間比較長,基本上需要8 h,而且在收集樣品時,大多數胎兒脫離母體的時間已經較長了,雖然在運輸過程中采用低溫保存,盡可能地抑制細胞的代謝活動,但到達實驗室時胎兒死亡的時間已經較長了,所以部分細胞可能在運輸過程中發生死亡,從而導致PGCs形成原代集落較少。
培養基中添加成分的影響。培養基中的血清質量好壞最直接影響到ESCs的培養效果。血清促進細胞增殖的主要原因是:血清中含有大量的營養物質及促進細胞增殖的生長因子。但是血清也含有很多不確定成分,這些成分有可能誘導ESCs分化。在ESCs培養過程中還要選擇適宜的血清濃度,過高或者過低都不利于ESCs的克隆和增殖,而且在細胞培養過程中應該一直采用同一廠家和同一批次的血清。近年來有實驗室使用KSR培養ESCs,取得了良好的效果。一般培養ESCs細胞在培養基中還需添加L-谷氨酰胺、β-巰基乙醇、丙酮酸鈉、非必需氨基酸、細胞因子、抗生素等成分,由于這些成分和血清一樣來自不同的廠家和不同的批次,其純度也不盡相同,其中也有可能含有對ESCs促進分化的因子,所以這些因素也會對PGCs集落形成和傳代造成影響。
4 結論
本試驗采用本地白山羊胎兒生殖嵴為材料,以GEF為培養層,在培養液中添加細胞因子,使用0.125%胰酶+0.02%EDTA傳代,無論以挑取集落傳代還是以胰酶消化傳代均能將PGCs傳至第2代。
[1]Matsai Y,Zsebo K,Hogan B.Derivation of pluripotential embryonic stem cells from murine primordial germ cells in culture cell[J].Cell,1992,70(5):841-847.
[2]王國云,李棟,張輝,等.小鼠胚胎成纖維細胞飼養層制備條件的研究[J].山東大學學報:醫學版,2005,43(5):396-400.
[3]楊煒峰.山羊胚胎干細胞和胚胎生殖細胞的分離培養與鑒定[D].陜西楊凌:西北農林科技大學,2006.
[4]李松.從原始生殖細胞中分離克隆牛胚胎干細胞[D].陜西楊凌:西北農林科技大學,2001.
[5]葛秀國,華進聯,楊繼建.山羊原始生殖細胞的分離與培養[J].西北農林科技大學:自然科學版,2005,33(2):27-31.
[6]楊麗芬,王清華,項智鋒,等.不同因素對山羊原始生殖嵴細胞體外分離培養與克隆的影響[J].中國畜牧雜志,2007,43(19):20-23.
[7]許新,叢笑倩.小鼠原生殖細胞建系過程及其分化特性的研究[J].實驗生物學報,1999,32(3):251-263.
[8]Lee S L,Tourtelltte L C,Wesselschmidt R L,et al.Growth and differentiation proceeds normally in cells deficient in the immediate early gene NGF1-A[J].J Boil Chem,1995,270:9971-9977.
[9]Kuhholzer B,Baguisi A,Overstrom E W.Long-term culture and characterization of goat primordial germ cells[J].Theriogenology,2000,53(5):1071-1079.
[10]韓建永,桑潤滋,孫國杰,等.山羊PGCs用于分離與克隆類ES細胞[J].中國獸醫學報,2002,22(4):344-347.

