堿錳電池在不同荷電態下的阻抗特征
吳 軍,徐艷輝,李德成,鄭軍偉
(蘇州大學化學電源研究所,江蘇蘇州 215006)
電池以及與電池相關產品的鑒別、荷電態(SOC)預測,對于電池及電池組的安全生產、運輸、質量檢測和假冒偽劣產品的識別十分重要[1-2]。
研究各種干電池的快速檢測,可有效識別仿冒產品,有效打擊假冒偽劣產品,識別過期電池產品,特別是電池組。在與生產工藝及原材料理化特性數據對比的基礎上,可對電池性能的改進提出參考數據。電化學交流阻抗(EIS)技術在電極材料、電池性能的評價及電池健康狀態的信息判斷上應用廣泛[3-5]。史美倫[1]提到采用阻抗方法確定電池的健康狀態。
本文作者研究了LR6型商品堿錳電池不同SOC時的阻抗譜特征,以期為尋找電池快速檢測手段、識別假冒產品及改進電池工藝提供參考。
1 實驗
實驗電池為市場上購買的商品環保 LR6電池(廈門產),測試時距離生產時間為1 a。
電池連續放電測試的溫度為20℃,放電電流和截止電位分別為100 mA、0.8 V。電池在室溫下以100 mA放電2 h,再在30℃下恒溫放置14 h并進行阻抗測試,如此循環至放電電壓降為0.8 V。未放電的電池SOC為100%,放電1次后SOC為91.0%,放電2次后為 83.4%,依次類推,總計放電14次。
實驗儀器為CHI660C電化學工作站(上海產),施加的交流信號幅值為10 mV,測量頻率為 1 mHz~100 kHz,在開路電位下測量阻抗,用ZSimpWin軟件進行阻抗數據的解析。
2 結果與討論
2.1 放電特征
LR6電池的連放時間達25.63 h,表明性能較好。電池間歇放電的放電曲線見圖1,總計放電容量為2 602 mAh。
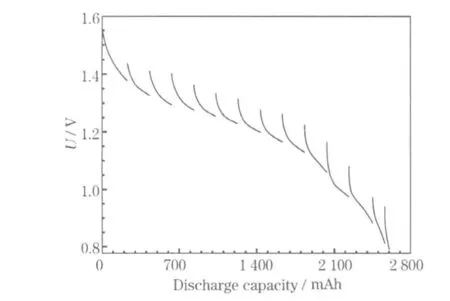
圖1 LR6電池的間歇放電曲線Fig.1 The intermittent discharge curves of LR6 battery
2.2 阻抗基本特征
LR6電池在不同荷電態下的阻抗譜見圖2。
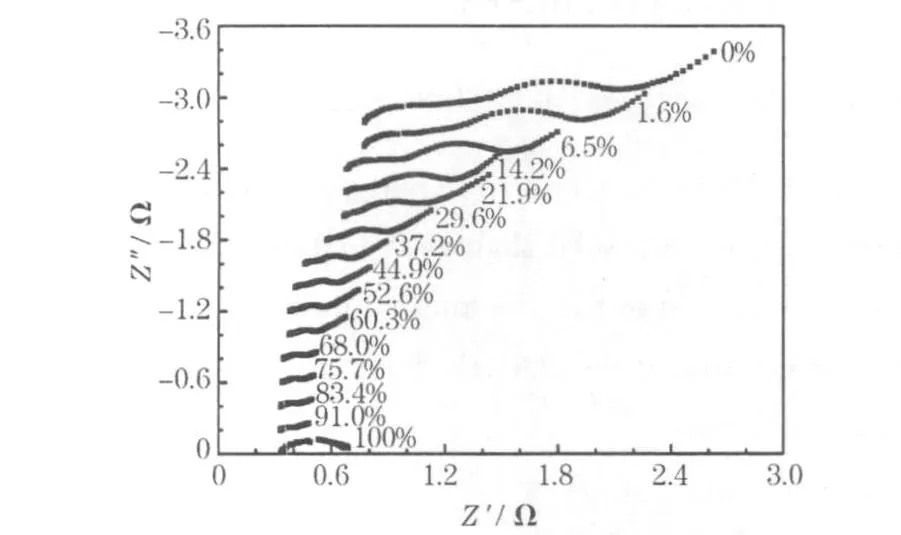
圖2 LR6電池在不同SOC下的阻抗譜Fig.2 The impedance spectroscopy of LR6 battery at different SOC
在100%SOC下,電池處于未激活狀態,類似于一個漏電的電容器,對于阻抗測試來講,沒有產物,且反應自身的可逆性不好,因此電荷轉移阻抗很大,電池的內阻也較大。從圖2可知,經過首次間歇放電200 mAh后,電池的各個部分被激活,電荷轉移阻抗和內阻均有所降低。文獻[3]認為:Zn/MnO2干電池的阻抗譜由1個亞扁半圓和1個Warburg阻抗構成,在100%SOC時,低頻區的直線斜率是45°,但在40%SOC時減小到約π/8。低頻區的 Warburg阻抗對應M nO2中的擴散過程。
LR6電池在100%、91.0%和14.2%SOC下的阻抗譜見圖3。
實驗中,在100%SOC下未測量到 Warburg阻抗,僅有1個半圓(圖3a),與文獻[3]報道的不同。首次間歇放電后,在91.0%SOC時,與擴散過程對應的阻抗譜開始出現,但斜率不是理想的45°,而是約為π/8。在文獻[3]的阻抗譜上,與擴散過程有關的直線的斜率隨著SOC降低,從45°逐漸減小到π/8極限值;但本實驗的結果恰好相反,斜率從91.0%SOC的大約π/8逐漸增加到完全放電態的45°。出現這樣的差異,可能是因為文獻[3]分析的電池是商品Leclanche電池,是含汞的早期電池。
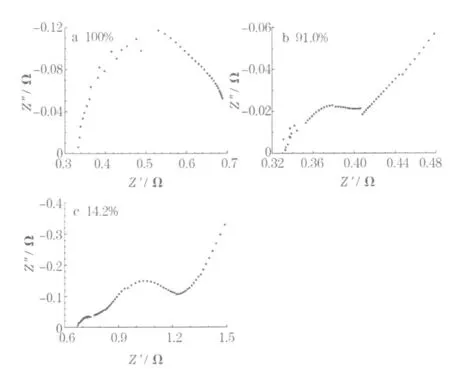
圖3 LR6電池在100%、91.0%和14.2%SOC下的阻抗譜Fig.3 The impedance spectroscopy of LR6 battery at 100%,91.0%and 14.2%SOC
從圖2還可看出,隨著SOC的降低,電池內阻(即阻抗高頻區在實軸上的截距)從第2次測量開始逐漸增加;首次測量的內阻略微大于第2次,主要是因為電池的活化。電池內阻隨著循環的進行而增加的基本原因,主要是正極水合三價錳、負極ZnO的形成,以及水的消耗。
在100%SOC,阻抗譜只有 1個半圓;當SOC為91.0%時,阻抗譜可看做由2個半圓和1條斜率是π/8的直線組成(圖3b);在SOC為14.2%時(圖3c),高頻區的2個半圓變得清晰,阻抗譜上和擴散過程對應的低頻區的直線部分,斜率也增加到45°,可推測45°斜率的形成和2個半圓變得清晰之間有一定的對應關系,暗示著某個電化學過程變得更明顯。本文作者認為,由于電池設計中正極容量小于負極,那么放電后期負極的金屬鋅還有富余,而正極活性物質剩余很少,大量的水合三價錳的生成,使電池的電化學過程逐漸受到正極的過程控制,或者至少是正極的電化學過程占據主導地位,正極中的擴散過程對外加的交流信號開始變得敏感。此時的阻抗譜擴散過程主要反映的是正極中的擴散。同樣,由于負極活性材料與正極相比對要多些,且電池的設計是正極位于電池的外部,中心是負極鋅粉,根據阻抗譜半圓最高點滿足的條件式(1),正極反應電阻相對更大,電容也相對更大,與正極中的電化學過程對應的半圓應該在相對低的頻率下被檢測到,推測圖3c中的低頻半圓對應堿錳電池中正極的電化學過程,高頻區域的小的半圓對應負極金屬鋅氧化成ZnO的電化學過程。本文作者認為,高于此荷電態時的阻抗譜反映的主要也是正極的特征。

式(1)中,ω為角頻率,R為反應電阻,C為電容。
2.3 參數分析
內阻、高頻區實軸截點頻率、半圓最高點頻率及阻抗譜確定的線性極化電阻(Rp)與 SOC的關系見圖 4。
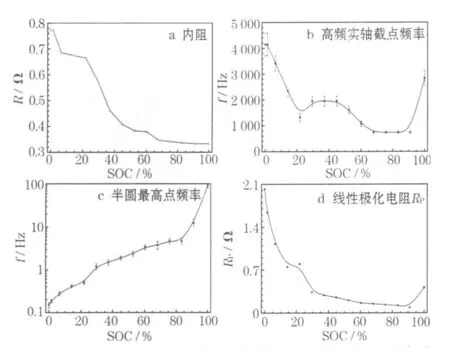
圖4 不同SOC下的內阻、高頻實軸截點頻率、半圓最高點頻率和RpFig.4 The internal resistance,frequency at the intercept at real axisin high-frequency domain,the frequency at the apex of semicircle and Rpat different SOC
電池的內阻隨著 SOC的降低而緩慢增加,在SOC為29.6%~44.9%時出現突躍式增加。高頻實軸截點的頻率在60.3%~91.0%SOC時大約為1 000 Hz。在電池質量檢測中,常用1 000 Hz頻率下的交流電阻來評價電池的性能。隨著SOC降低,對應的頻率開始升高,在完全放電態升至4 000 Hz。這表明,此時的電池如果仍然使用1 000 Hz頻率來評價電阻,已經不合適,因為此時存在電容阻抗的干擾。
半圓最高點頻率隨著SOC的降低而降低;Rp隨著SOC從91.0%降低到0.0%而增加。Rp最初的降低源于電池的激活特性。在21.9%SOC附近,Rp的突然增加主要與正極材料有關。文獻[5]研究了MnO2在不同SOC下的法拉第阻抗變化,發現電荷傳輸過程的法拉第阻抗隨著SOC的降低而增加,并在29.6%~44.9%SOC時發生突變。雖然與報道的出現突躍的SOC有所差別,但本文作者仍認為正極電化學過程中法拉第阻抗的突變,是 Rp突變的主要原因。M nO2中的質子擴散系數只有10-16cm2/s,與Ni(OH)2的質子擴散系數(約10-8cm2/s)相比很小[4],從側面證明了堿錳電池的阻抗譜主要反映的是正極的特征。文獻[6]指出,M nO2的質子擴散系數在60%~30%SOC時最小。
不同SOC下的電容見圖5。

圖5 不同SOC下的電容Fig.5 The capacitance at different SOC
對于低SOC時的兩個半圓的情形,分析的是低頻段半圓對應的電容。采用Equivcrt軟件對低頻段的半圓進行擬合處理,采用的等效電路是 R1(R2Q),其中 R1代表串聯溶液電阻,R2對應低頻半圓的反應電阻,Q與半圓的變形程度有關。利用擬合的參數 Y0,并通過式(2)計算電容 C。

式(2)中,n代表半圓的變形程度。隨著SOC降低,電容逐漸增大。這可用反應物和產物的相對含量的變化及反應界面在電池內部的擴散來解釋。
由于負極過量,推測認為負極電容的變化主要發生在SOC較高時;在SOC較低時,負極的電容隨著SOC的變化程度不如正極。從理論角度分析,如果只考慮正極活性物質量對電容變化的貢獻,應出現低SOC下電容減小的現象,與實驗的測量并不一致。這種不一致,反映了電池內部結構隨著反應的進行而發生的變化,也就是說,這是與電池的制備工藝相關的。這給電池生產廠家識別仿制電池提供了可能。
3 結論
研究了LR6型商品堿錳電池在不同SOC下的電化學交流阻抗特性。
隨著SOC的降低,電池內阻最初緩慢地增加,在29.6%~44.9%SOC時出現飛躍式增加;高頻實軸截點頻率在高SOC在1 000 Hz附近,但在低SOC時升高,說明目前的電池檢測標準使用的1 000 Hz不適合低SOC的電池;半圓最高點的頻率降低,暗示著電池電容的增加,對阻抗數據的擬合處理計算的電容數值也與此相符。Rp隨著SOC的降低而增加,并在21.9%SOC附近出現突躍式增加。
[1]SHI Mei-lun(史美倫).交流阻抗譜原理及應用[M].Beijing(北京):National Defense Industry Press(國防工業出版社),2001.
[2]GU Hao-fei(顧浩飛),LIU Yi(劉怡),XU Rong(徐嶸).電池危險品鑒別的方法綜述[J].Battery Bimonthly(電池),2009,39(2):104-105.
[3]Shalini R,Munichandraiah N,Shukla A K.A review of state-ofcharge indication of batteries by means of A.C.impedance measurements[J].J Power Sources,2000,87(1-2):12-20.
[4]XU Yan-hui(徐艷輝),CHEN Meng(陳猛),LIN Xiu-feng(林秀峰),et al.不同荷電狀態下α-Ni(OH)2的質子擴散系數[J].The Chinese Journal of Nonferrous Metals(中國有色金屬學報),2000,10(5):656-658.
[5]Xu Y H.The electrochemical behavior of Ni-MH battery,Ni(OH)2electrode and metal hydride electrode[J].Int J Hydrogen Energy,2004,29(7):749-757.
[6]Qu D Y.Application of A.C.impedance technique to the study of the proton diffusion process in the porous M nO2electrode[J].Electrochim Acta,2003,48(12):1 675-1 684.

