豬血中抗菌肽的提取
王延卓,董曉慶,曲桂娟,白永平
(1.烏蘭察布職業學院生物技術系,內蒙古烏蘭察布012000;2.吉林農業大學動物科技學院,吉林長春130118)
抗菌肽是生物體內誘導表達具有廣譜抗菌活性的小分子多肽[1-2]。這些多肽是生物體非專一性的免疫應答產物,是生物體內免疫系統的重要成分[3]。
國內外關于豬源抗菌肽的研究,主要針對豬小腸中的抗菌肽,而血中抗菌肽的提取及抗菌活性研究在國內外卻很少有報道[4-6]。基于豬血液中白細胞是免疫系統中起主要作用的免疫細胞,其中性粒細胞約占白細胞總量的70%,所以本試驗試圖從豬血中性粒細胞中提取抗菌肽,優化提取工藝,提高抗菌肽的回收率和純度。
1 材料與方法
1.1 材料 從長春市凈月屠宰場采取新鮮豬血2~3 L,使用5%檸檬酸鈉抗凝。
1.2 方法
1.2.1 萃取 將新鮮豬血放置37℃溫箱靜置1~2 h,取上清按照1∶4(V∶V)的比例加入0.84%氯化銨溶液,混勻靜置 3 min,常溫400 r/min離心 10 min,棄上清按比例加入氯化銨溶液混勻靜置 3 min,再次500 r/min離心 10 min。棄上清,使沉淀與少量冷的生理鹽水(4℃)短時間混合,再用200 mL冷的10%冰醋酸(4℃)使沉淀懸浮,充分混勻,倒入50 mL燒杯,超聲波處理50次,然后溶液使用磁力攪拌器混勻攪動于4℃下萃取一夜。次日,將萃取的溶液取出15 000 r/min離心30 min,取上清4℃下保存,沉淀再次混懸于冷的10%醋酸中,充分混勻,混勻攪動于4℃下萃取一夜。第3天,將萃取的溶液取出15 000 r/min離心30 min,取上清用紫外分光光度計分別測其在260 nm和280 nm處的吸收值,記錄結果,最后將溶液4℃下保存。
1.2.2 除酸、濃縮 合并所保存的溶液,將溶液注入透析袋,扎緊袋口,然后將其放入燒杯,再向燒杯中倒入蒸餾水,蒸餾水液面要超過透析袋,4℃下透析除酸,每12 h換水一次,直至透析袋外蒸餾水pH大于6,此時,將透析袋放入瓷盤中,撒上聚乙二醇-6000,透析濃縮約3~4 h后即可將透析袋取出,將濃縮的溶液取出低溫凍干,轉移至青霉素小瓶中,密封-20℃保存。
1.2.3 抗菌肽的分離 將凍干樣品用0.5%甲醇溶解,再上樣于層析柱葡聚糖凝膠Sephadex G25,同時打開柱的下端出口,注意控制流速為1 mL/min,5 mL/管。用部分收集器收集洗脫液,5 mL/管,收集的溶液用紫外分光光度計測其在280 nm處的吸收值,再測其在260 nm處的吸收值,記錄結果,將在280 nm處有吸收的溶液分裝于青霉素瓶中,再在低溫凍干機中凍干,-80℃保存。取各瓶凍干保存的樣品各20 mg,分別溶于滅菌雙蒸水中,無菌條件下用微孔濾膜過濾樣品,將藥敏紙片浸泡于過濾后的樣品中,浸泡過夜后,用平皿紙片法初篩,測定各峰收集組分的抗菌活性,收集具有抗菌活性的組分,置于 5℃保存,用來進一步做 Sephadex G100層析、分離。仍使用層析柱(1.8 cm×100 cm),將部分收集的有抗菌活性的組分溶液以0.5%甲醇溶液作為洗脫液,以部分收集器收集,將在280 nm處有吸收的溶液分裝于青霉素瓶中,再在低溫凍干機中凍干,-80℃保存。用平皿紙片法測定各峰收集組分的抗菌活性,收集具有抗菌活性的組分,置于5℃保存。
1.2.4 抗菌肽的純化與濃縮 使用超濾裝置進行超濾,膜包選用截流分子量為20 kD。洗脫液選用0.5%甲醇溶液,濾出液既為所要獲得的溶液,置于5℃保存。從而進一步純化。然后將溶液注入透析袋,扎緊袋口,4℃下透析除酸,每12 h換水1次,換水3次后,將透析袋放入瓷盤中,撒上聚乙二醇-6000,透析濃縮約3~4 h后即可將透析袋取出,將濃縮的溶液取出低溫凍干,轉移至青霉素小瓶中,-20℃密封保存。
1.2.5 抗菌肽的Tricine SDS-PAGE電泳 將純化的豬中性粒細胞肽,低分子量標準蛋白進行T ricine SDS-PAGE電泳,分離膠濃度15%,積層膠濃度5%,凝膠厚度0.75 mm,陽極緩沖液為0.2 mol/L Tris溶液(pH 8.9),陰極緩沖液為0.1 mol/L T ris溶液(pH 8.3),每孔上樣量為15 μ L。染色、脫色,回收。
1.2.6 酸性尿素聚丙烯酰胺凝膠電泳法測定抗菌肽抗菌活性 取大腸桿菌ATCC25922接種于大豆培養基中,37℃振搖培養8 h,此時的菌液為幼齡菌液,立即取幼齡菌0.1 mL,將取出的0.1 mL菌液加入已經滅菌的0.9 mL的生理鹽水中,稀釋,混勻,取1 mL加入2號試管中,再混勻,再取0.1 mL依次進行10×稀釋,共計8只試管,依次的濃度為10-1、10-2………10-7。10倍稀釋之后,接種于已經制備好的瓊脂平板中,37℃培養24 h,進行菌落計數,通過稀釋得到5×106-107個/mL范圍內的這個濃度的菌,將該濃度的菌液40 μ L加入50℃~60℃熔化狀態的底層培養基中使菌液濃度為5×104-105個/mL,混勻后,均勻鋪于培養皿中,待凝固后,再將PBS洗滌后的AU-PAGE凝膠鋪于底層培養基上,置于37℃溫箱孵育3~4 h,從而使凝膠中的蛋白質彌散進入底層培養基,之后取出凝膠,倒入頂層培養基37℃培養18 h,使細菌生長,第2天,使用0.001%考馬斯亮藍對瓊脂糖平板染色10 h,亮區無菌生長。
2 結果
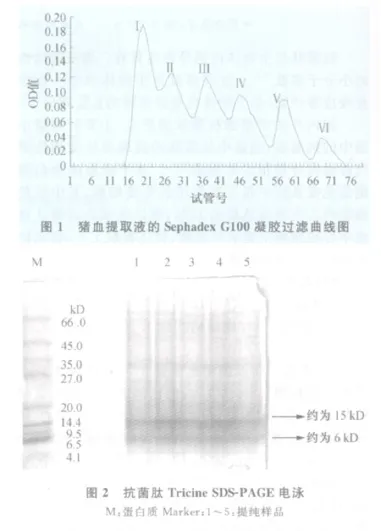
2.1 凝膠過濾分離、純化 粗提液經Sephadex G25柱層析分離后,出現2個峰,前峰為大分子蛋白質,后峰為小分子蛋白質及多肽。將收集的各管溶液各取15 μ L進行抗菌活性測定,結果從第46管開始有抑菌圈出現,第49管抑菌圈最大(直徑2.1 cm),至第54管抑菌圈消失,合并45~54管溶液,使用Sephadex G100再次層析分離,出現6個峰(見圖1),抗菌活性測定,結果從第35管開始有抑菌圈出現,第38管抑菌圈最大(直徑2.2 cm),至第44管抑菌圈消失,說明抗菌肽位于第3洗脫峰內。
2.2 純化物的T ricine SDS-PAGE電泳 純化物經Tricine SDS-PAGE電泳出現兩條主帶(見圖2),其中左數第1條帶為低分子量蛋白質Maker,其他條帶為樣品純化物。樣品電泳顯示為含兩條主帶,其中位于電泳圖譜最下端的一條主帶分子量約為6 kD,其上一條帶約為15 kD。
2.3 抗菌肽抗菌活性測定 經考馬斯亮藍染色的瓊脂糖平板,結果發現,只有分子量約為6 kD的多肽帶發亮,回收該條帶的多肽進行抗菌活性測定,結果見圖3、4、5、6。證明此條帶上無菌生長,該條帶的多肽具有抗菌活性,應含有抗菌肽。

圖3 純化物對鏈球菌ATCC55121抑菌試驗結果

3 分析與討論
分離抗菌肽,國內外最廣泛使用的方法,是化學試劑提取法[7-8],本研究首先使用氯化銨溶液溶解紅細胞,白細胞(70%~75%PMNs,5%~10%嗜酸性細胞,15%~25%淋巴細胞和單核細胞)在4℃生理鹽水可恢復其活性,然后超聲波破碎細胞,內部物質釋放出來,在4℃下用10%冰醋酸混懸該溶液,進一步破碎細胞,高速離心即獲得低分子量的蛋白質和多肽,再使用葡聚糖凝膠Sephadex G25過濾分離鹽離子和大分子蛋白質,使用葡聚糖凝膠Sephadex G100細分出有活性的小分子多肽,最后使用超濾法純化所提取的小分子多肽。
Sephadex G型葡聚糖凝膠雖然價位很高,但性能頗佳,又可再生利用,此外上柱樣品損失很少,對處理小分子樣品效果較好,因此本試驗使用了Sephadex G型葡聚糖凝膠。又因為Sephadex G型葡聚糖凝膠只適合在水中使用,所以本試驗所使用的緩沖液為0.5%甲醇水溶液。抗菌肽為小分子多肽,因此本試驗超濾裝置中所使用的膜包截留分子量為20 kD。
Tricine SDS-PAGE電泳在分離、鑒定和純化蛋白質、多肽方面有著廣泛的應用,該方法操作方便,所需儀器簡單,重現性好,時間短,只需微克量的多肽便可顯帶且能迅速估測出其相對分子量,因此,本試驗應用 Tricine SDS-PAGE電泳分離純化物,從而更簡單、快捷地分離小分子多肽,結果有較好的顯帶,分出兩條主帶,分子量分別約為6 kD和15 kD。
應用AU-PAGE電泳分離小分子多肽,使多肽保持了活性,結合前面所講的凝膠覆蓋測定法,最終鑒定出分子量在6 kD左右的帶具有抗菌活性,而我們已知抗菌肽分子量大多在4 kDa左右,由此推測該條帶應含有抗菌肽。當然,經 Tricine SDSPAGE電泳鑒定為的單一區帶不能證明為一純的多肽帶,如果在以后的試驗中采用其他方法如:高效液相色譜法(HPLC),氮端氨基酸序列測定,肽質譜分析法等,對于該條帶的鑒定將更加具有說服力。
[1]Boman H G,Hultmark D.Cell free immunity in insects[J].Ann Rev Microbiol,1987,41:103-126.
[2]羅剛,魏泓.豬防御素基因(PBD-I、PBD-Ⅱ)在大腸桿菌中的重組和融合表達[J].第三軍醫大學學報,2003,14(25):1300-1302.
[3]孫學軍,閻虎生.蜂毒肽片段類似物的合成及其生物活性研究[D].天津:南開大學,2003.
[4]Piers K L,Brown M H,Hancock R W.Recombinant DNA procedures for producing small antimicrobial cationic peptide in bacteria[J].Gene,1993,134:7-11.
[5]Dmy tro P,Yevtushenko,Rafael Romero,et al.Santosh Misra Pathogen-induced expression of a cecropin A-melittin antimicrobial peptide gene confers antifungal resistance in transgenic tobacco[J].J Exp Bot,2005,56:1685-1695.
[6]張艷艷.豬血中抗菌肽類物質的分離純化和抗菌活性研究[J].科技導報,2008,26(2):33-37.
[7]Yarus S,Rosen J M,Cole A M,et al.Production of active bovine tracheal antimicrobial peptide in milk of transgenic mice[J].PNAS,1996,93:14-18.
[8]韓新燕,許梓榮.抗菌肽在哺乳動物防御系統中的作用[J].中國預防獸醫學報,2003,25(6):499-502.

