化療聯合過繼免疫細胞治療晚期非小細胞肺癌的臨床研究
徐永茂 徐冬云 張南征 陳復興 劉軍權
肺癌是目前在全球范圍內發病率及死亡率均居于首位的惡性腫瘤,并有逐年上升的趨勢。由于我國仍處于發展中國家,大多數患者就診時往往已是中晚期,失去手術機會,隨著分子生物學及腫瘤免疫研究進展,除了傳統的手術、放射治療、化療,近年來隨著分子生物學和免疫學理論及科研技術的發展,免疫治療再次引起了關注,并逐漸成為腫瘤綜合治療的 1個重要組成部分。為了提高晚期非小細胞肺癌患者的臨床療效,延長生存期,改善患者的生活質量,自 2004年 1月~2009年 7月,我科采用 NP方案聯合自體外周血單核細胞培養的 CIK(cytokine-induced killers)細胞與樹突狀細胞(dendritic cells,DC)過繼免疫治療 38例晚期非小細胞肺癌患者,現報告如下。
1 資料與方法
1.1 入組標準
經病理學或細胞學檢查證實的(國際抗癌聯盟1997年分期標準)Ⅲ、Ⅳ期 NSCLC患者,卡氏評分≥70分,之前未行抗癌治療,血常規及肝腎功能均正常,無嚴重心肝腎疾病。根據患者臨床表現與體格檢查、胸部和腦部 CT或 MRI檢查、腹盆腔彩超或 CT或 MRI檢查、骨 ECT檢查結果進行臨床分期。
1.2 一般資料
可評價的 78例中男性 57例,女性 21例,年齡 47~75歲,平均 59.6歲,鱗癌 34例 、腺癌 38例,大細胞癌 6例。其中Ⅲ期 24例,Ⅳ期 54例,隨機分為研究組38例與對照組 40例,治療前常規行胸部 CT、心電圖、血常規及肝腎功能檢查。所有接受過繼免疫治療患者,治療前均明確告知過繼免疫細胞治療的優點和不足,患者或家屬簽署知情者同意書,并報醫院倫理委員會批準。
1.3 主要儀器與主要試劑、CIK細胞與 DC的制備
Foma311二氧化碳培養箱,Foma1205生物安全柜,COULTER公司 XL流式細胞儀,CS-3000PLUS血細胞分離儀;HumanTH 1/TH2 cytokine Kit由 BD公司提供。
1.3.1 CIK細胞制備方法 抽患者晨起后外周血 200 m l,分離血漿備用,再吸出富含白細胞層的細胞約 10 m l,懸浮于等量患者自身的血漿中,淋巴細胞分離液分離收集單個核細胞。剩余紅細胞用生理鹽水補充至原體積后回輸給患者。PBS洗滌,將細胞按 2×109個/L數量懸浮于 RPMI 1640完全培養中,加至經抗 CD3單抗包被的 6孔細胞培養板,每孔 6 ml,加入終含量為50 kU/L rIL-2和 50 kU/L IFN-γ,置于 37℃ 50ml/L的 CO2條件下培養,培養 7天后,經細菌和霉菌培養陰性后再收集細胞,無菌生理鹽水洗 3次,將細胞懸浮于自身的血漿中,加入 2×104U rIL-2,終細胞數為(1.3×109~1.6×109)個。靜脈回輸時配制成 150ml的細胞懸液,用輸血器 1 h內輸入。
1.3.2 DC的體外培養方法 抽患者晨起后外周血200m l,先離心分離出血漿備用,再吸出富含白細胞層的細胞約5 ml,懸浮于等量患者自身血漿中,用淋巴細胞分離液分離收集單個核細胞。剩余紅細胞用生理鹽水補充至原體積后回輸給患者。單個核細胞用無菌生理鹽水洗滌 3次,用 RPMI 1640完全培養基將細胞配成 2×109/L,加入 6孔板細胞培養板中,每孔 5 ml,置37℃、5%CO2培養箱中孵育 2 h。再用預熱的培養基輕洗培養板 2次,即獲貼壁的單個核細胞,每孔加入完全培養液(含 200μg/L rhGM-CSF和 50μg/L rhIL-4)3m l。每 2天半量換培養液(含 200μg/L rhGM-CSF和50μg/L rhIL-4),在培養第 9d的樹突狀細胞中加入rhTNF-α至 10μg/L,15 h后收集 DC細胞進行臨床腋窩淋巴結附近皮下注射。
1.4 方法
研究組:采用 NP方案,NVB(國產長春瑞賓)25 mg/m2,靜脈推注,第 1、8天 ;DDP每天 25 mg/m2,靜脈點滴,第 1~3天,每 3~4周為 1個周期,第 2個周期化療結束 2周血像恢復正常后,抽外周血,分離單核細胞行 CIK細胞與 DC培養,1周后回輸,每周 2次,共4~5周為 1個周期。2個周期化療與 1個周期的過繼免疫治療為 1個療程,治療 2個療程后開始評價療效。化療期間及時復查血常規,酌情應用重組人粒細胞刺激因子升白細胞。
對照組:化療方法同研究組。
1.5 療效及毒性的評價
按 RECIST實體瘤的近期療效標準[1]分為完全緩解(CR)、部分緩解 (PR)、穩定(SD)、進展(PD)4級,治療結束 1個月后進行療效評價。疾病進展時間(TTP)是指從治療開始至病灶出現進展的時間。療效為 CR和 PR的病例需繼續進行治療,PD的病例停止研究。按照 WHO統一標準評價毒性[2]。
1.6 觀察指標
生活質量變化;記錄患者癥狀及體征的變化,采用kamofsky計分方法判斷治療前及治療后的變化。
對治療前后的 T細胞亞群進行檢測。
1.7 統計學方法
療效采用非參數的秩和檢驗,研究組與對照組治療的生活質量對比采用非參數的 χ2檢驗,計量資料以均數 ±標準差表示±s,組間差異采用 t檢驗。
2 結果
2.1 臨床療效
兩組均無 CR病例,研究組中 PR 25例、SD 9例、PD 4例 ,有效率(RR=CR+PR)為 65.7%;對照組中PR 16例 、SD 15例、PD 9例 ,有效率為 40.0%,兩組有效率比較差異有統計學意義(P<0.05,χ2=4.22)。兩組患者均獲得隨訪,研究組 TTP為 5.3個月、中位生存期 (MST)為 11.9個月(95%CI 6.5~15.6個月);對照組 TTP為 4.6個月、MST為 10.4個月(95%CI4.5~12.1個月),見表 1。
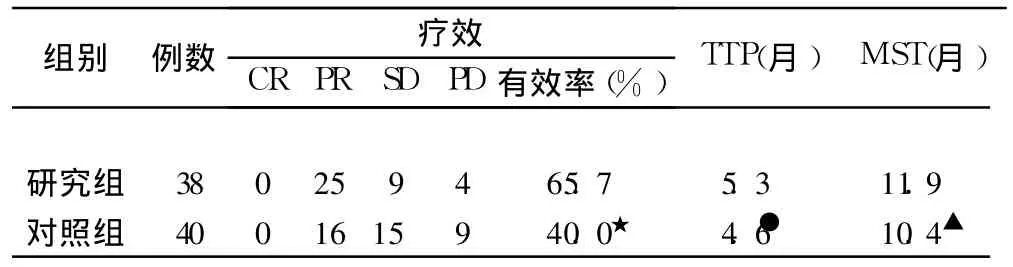
表1 兩組患者療效及生存率比較(例)
研究組與對照組 1、2年生存率分別為 39.4%、14.2%和 35.3%、12.6%,兩組比較無顯著性差異(P=0.65)。
2.2 不良反應
骨髓抑制和胃腸道反應是主要的不良反應,兩組白細胞下降發生率分別為 81.5%(31/38)和 80.0%(32/40),以Ⅰ ~Ⅱ度白細胞減少為主,應用瑞血新(G-CSF)后均能完成治療。雖然預先應用了止吐藥物,消化道反應的發生率仍較高,主要為食欲下降、惡心,少數有一過性嘔吐,兩組胃腸道反應發生率分別為76.3%(29/38)和 75.0%(30/40),以Ⅰ ~Ⅱ度胃腸道反應,主要表現為惡心、嘔吐(可控制)。
2.3 生活質量變化
生活質量以 kamofsky評分標準計算,凡在治療后kamofsky評分提高超過 10分者為改善,而下降超過10分者為惡化,提高或下降少于 10分者為穩定。kamofsky評分總提高率為改善 +穩定。研究組中改善24例,穩定 10例,進展 4例。對照組中改善 15例,穩定 13例,進展 12例。研究組與對照組治療后 kamofsky評分總提高率分別為 89.4%與 70.0%,2組比較有顯著性差異(χ2=4.56,P<0.05)。
2.4 T細胞亞群變化
兩組治療前后 T細胞亞群檢測結果見表 2。
表2 2組治療前后T細胞亞群的比較±s,%)
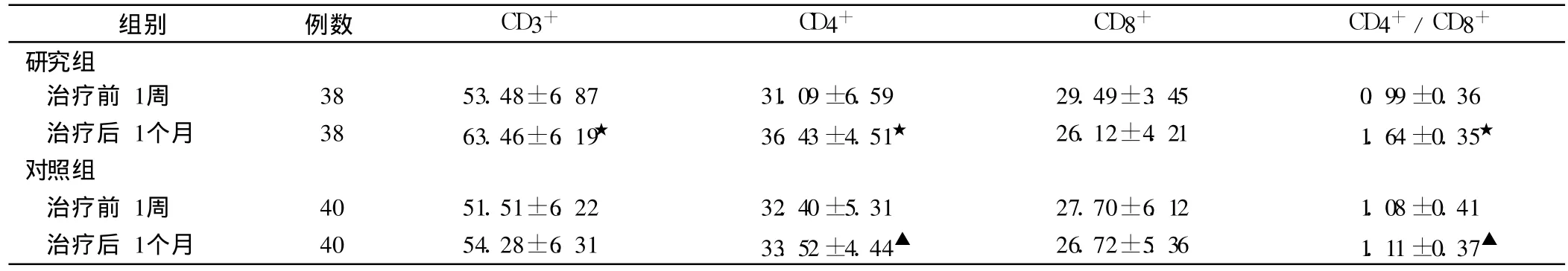
表2 2組治療前后T細胞亞群的比較±s,%)
★為與研究組治療前比較,P<0.05;▲為與對照組治療前比較,P<0.05
組別 例數 CD 3+ CD 4+ CD 8+ CD 4+/CD 8+研究組治療前 1周 38 53.48±6.87 31.09±6.59 29.49±3.45 0.99±0.36治療后 1個月 38 63.46±6.19★ 36.43±4.51★ 26.12±4.21 1.64±0.35★對照組治療前 1周 40 51.51±6.22 32.40±5.31 27.70±6.12 1.08±0.41治療后 1個月 40 54.28±6.31 33.52±4.44▲ 26.72±5.36 1.11±0.37▲
3 討論
過去肺癌的化療治療效果一直不理想,晚期非小細胞肺癌的中位生存期僅 4~6個月,近年來隨著長春瑞濱等新藥進入臨床使用,使晚期非小細胞肺癌的療效有較大的提高。長春瑞濱是第 3代半合成的長春生物堿,其作用機制是通過阻止微管蛋白聚合形成微管和誘導微管解聚,使紡鍾體不能形成,細胞停止于有絲分裂中期,從而抑制腫瘤的增殖[3],藥代動力學研究顯示長春瑞濱血漿清除率高,分布容積大,半衰期長,故廣泛分布全身,該藥在肝臟濃度最高,其次為肺,與順鉑有協同作用[4,5]。
肺癌的患者常呈現免疫功能抑制,免疫功能愈低者,還發生“免疫漂移”(immune shift)改變[6,7],即細胞免疫功能下降,體液免疫功能增強,機體的抗腫瘤免疫受到嚴重干擾[8];T細胞亞群是構成機體免疫防御的重要因素,兩個主要亞群,即輔助性 T細胞(Th)CD4+和抑制性細胞(Ts)CD8+。機體內的免疫平衡主要由這兩類細胞相互間影響來維持。CD 4+T細胞具有調節免疫反應的活性,輔助 B細胞產生抗體,分泌細胞因子的作用,而 CD8+則有免疫抑制和細胞毒性作用[7]。CD4+下降或 CD8+升高均可使兩者比例失調,導致機體免疫功能缺陷。國內外很多研究結果表明,多種腫瘤患者有 T細胞亞群狀態異常和比例失調,其CD4+/CD8+比值的降低與病變程度相關,往往提示患者的細胞免疫功能處于抑制狀態,對識別和殺傷突變細胞的能力下降,從而有利于腫瘤的生長和轉移。
CIK細胞兼有 T淋巴細胞強大的抗瘤活性與 NK細胞的非主要組織相容性復合物(MHC)限制性殺瘤特點,對某些腫瘤細胞殺傷活性可以達到 84.7%[9],DC是人體內最有效的專職的抗原提呈細胞。成熟的DC可通過 MHC-I、MHC-II類及 CD1分子途徑提呈腫瘤抗原,有效的啟動抗腫瘤細胞免疫,并能分泌 Th1型細胞因子 IL-2和 TI-12,起到激活 T細胞應答的作用。DC與 CIK細胞是腫瘤免疫治療的兩個重要部分,前者識別病原、激活適應性免疫系統,后者通過 MHC非限制性方式殺傷腫瘤細胞,兩者聯合形成了抗腫瘤免疫反應體系了 1個高效的免疫反應完成。培養的 CIK細胞發揮殺傷作用的機制主要有:釋放具有細胞毒性的細胞質顆粒物殺傷靶細胞;產生大量的炎性細胞因子直接或間接殺傷腫瘤細胞;表達 Fasl,誘導腫瘤細胞凋亡。培養的DC能夠通過共刺激分子與細胞因子,促進CIK細胞的殺傷活性;還能通過刺激抗原特異性 T細胞增殖,增加抗腫瘤效應。從兩組的治療前后的 T細胞亞群的檢測結果,研究組的治療后的 CD3+、CD4+、CD4+/CD8+均明顯高于治療前,研究組治療后的CD4+、CD4+/CD8+也明顯高于對照組的治療后。
單純的化療雖能有效地使腫瘤縮小,并能改善癥狀,延長生存期,但隨著抗腫瘤藥物的廣泛使用,耐藥性成為臨床腫瘤化療失敗最常見和最難克服的問題之一,而且化療實際上并不能完全殺傷所有的腫瘤細胞,尤其是腫瘤干細胞,化療對腫瘤細胞的殺傷呈一級殺傷,而免疫細胞對腫瘤細胞呈 0級殺傷,因此被化療殺傷后殘存的癌細胞需要患者自身的免疫細胞來清除,但對于晚期肺癌患者,本身的免疫功能低下,而經過化療后患者的細胞免疫功能進一步低下,此時每周 2次回輸的 CIK細胞與 DC,使患者細胞免疫功能得以回復與提高,從而進一步殺傷或清除化療后那些殘存的癌細胞,來鞏固并提高效果。
本研究組近期有效率(65.7%)明顯高于對照組(40.0%),雖然研究組的 TTP(5.3個月)、MST(11.9個月)高于對照組的 4.6個月和 10.4個月,以及研究組 1、2年生存率(39.4%和 14.2%)分別高于對照組(35.3%和 12.6%),但兩組比較均無顯著性差異。而研究組的治療后患者的細胞免疫功能改善明顯高于對照組,研究組生存質量的提高也明顯高于對照組,患者的生活質量提高,可以增強患者抗癌的信心,激發性自身的免疫功能,從而使患者有更好的依從性。
通過以上本研究結果分析提示,對于中晚期的非小細胞肺癌,采用化療聯合培養的 CIK細胞與樹突狀細胞過繼免疫抗癌治療,可以取得較好的臨床療效,提高患者免疫功能,改善患者的生存質量,可以延緩患者的生存期,是 1個值得推廣的治療方法。
[1] 孫 燕,周際昌.臨床腫瘤內科手冊〔M〕.北京:人民衛生出版社,2006:106~112.
[2] 孫 燕.內科腫瘤學〔M〕.北京:人民衛生出版社,2001:994~997.
[3] 潘啟超.長春堿類的新進展-失碳長春堿〔J〕.癌癥,1996,15(3):228.
[4] 朱 凡.蓋諾聯合順鉑治療中晚期非小細胞肺癌 32例分析〔J〕.蘇州大學學報(醫學報),2004,24(1):89.
[5] 管忠震.腫瘤臨床化療的進展〔J〕.實用腫瘤雜志,2001,16(5):292.
[6] 李 振,許德順,王化洲,等.惡性腫瘤的化學治療與免疫治療[M].北京:人民衛生出版社,1993:176.
[7] Htabata T,Hazama S,Yoshno S,et al.TH 2 subest dominance among peripheral blood T lymphocytes in patientswith digestive cancers〔J〕.Am JSurg,1999,177(3):203.
[8] Trnchieri G.Immunobiology of interleukin– 12〔J〕.Immunol Res,1998,17(12):269.
[9] Wan FS,Liu MX,Zhang B,et al.Antitumor activities of human autologous cytoine-induced killer(CIK)cells against hepatocellular carcinoma cells in vitroand in vivo〔J〕.Word J Gastroenterol,2002,8(3):464.

