輝鉬礦分解工藝的最新進展
廖利波
(自貢硬質合金有限責任公司,四川 自貢 643011)
0 前言
鉬是一種難熔金屬,具有許多優良的物理化學性質和機械性能,鉬及其合金在冶金、農業、電氣、化工、環保和宇航等重要部門有著廣泛的應用和良好的前景,成為國民經濟中一種重要原料和不可替代的戰略物資。鉬冶煉的原料即輝鉬精礦,其主要成分為二硫化鉬,標準的輝鉬精礦要求其鉬含量不低于 45%[9]。輝鉬精礦是生產鉬酸鈉、鉬酸銨等鉬化合物的主要原料,其下游產品主要有三氧化鉬、鉬鐵、鉬粉、鉬條、鉬絲等。
輝鉬精礦的分解作為鉬冶煉的第一步,無疑是極其重要的。希望通過本文,使廣大鉬冶煉工作者對其最新進展有所了解與啟迪,并在自己的工作中有選擇的加以運用。
1 輝鉬礦的性質
2.1 輝鉬精礦性質[1]
輝鉬精礦的主要成分為M oS2,含 60%Mo和40%S,為灰黑色的粉末,六方晶系結晶,相對密度4.80,熔點 1 185℃,在 450℃開始升華,莫氏硬度為 1~1.5。一般情況下,摩擦系數為 0.05~0.09。在大氣中,溫度 350℃左右開始逐漸氧化,氧化物為M oO3,在隔絕空氣的條件下加熱到 1 300~1 350℃,輝鉬精礦開始離解,到 1 650~1 700℃開始融化分解。化學穩定性和熱穩定性良好。不溶于水、稀酸和濃硫酸,但溶于熱硫酸或強氧化性酸(硝酸、王水)。在其他酸、堿、溶劑、石油、合成潤滑劑中不溶解。與一般金屬不產生化學反應,不侵蝕橡膠材料,不導電。外觀與石墨相似,呈鱗片狀或薄板狀的晶體,具有層狀六角型晶格,這是輝鉬精礦能作為優良的固體潤滑劑的根本原因。
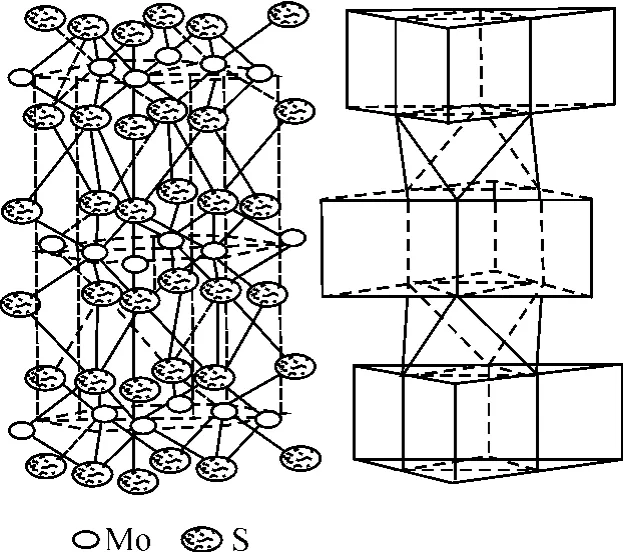
圖 1 輝鉬精礦結構圖
2.2 M o-S-H2O系ε-pH圖
ε-pH圖是輝鉬精礦分解的理論基礎,從圖 2可以看出,HNO3、C l2、次氯酸、O2均可將輝鉬礦氧化。需要注意的是在輝鉬礦的濕法氧化時需要考慮單質硫的穩定性造成的能量壁壘。
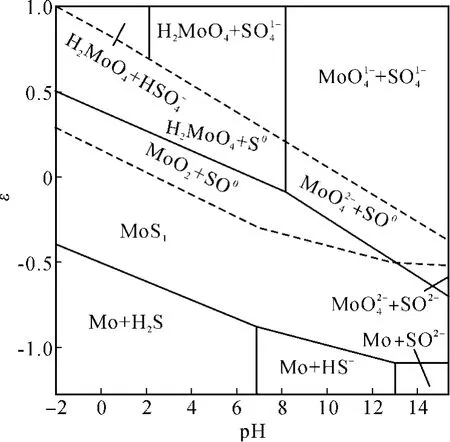
圖2 M o-S-H2O系ε-pH圖(25℃,考慮 S0氧化能壘)
2.3 常用的氧化劑
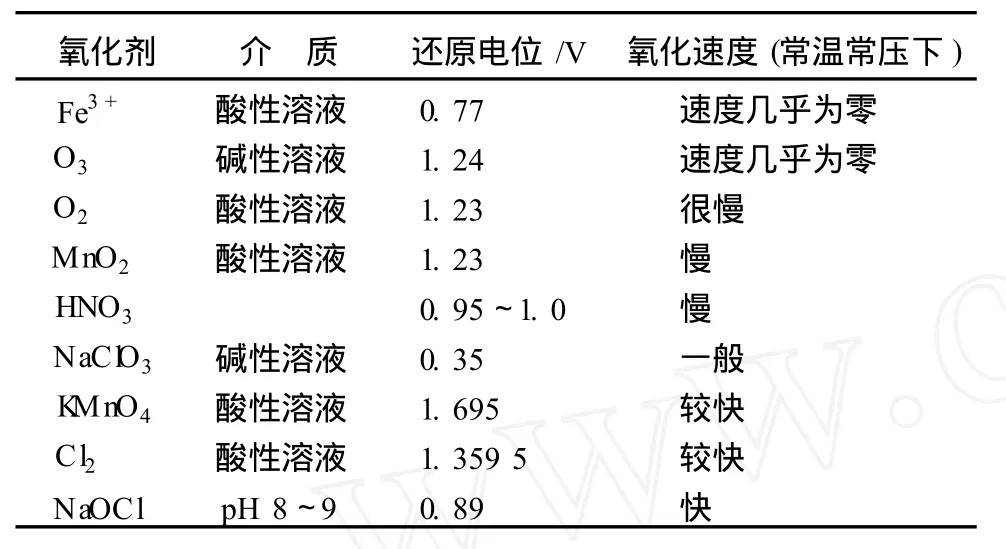
表1 常用的氧化劑的標準電位及對輝鉬精礦的氧化速度
3 輝鉬精礦分解的最新進展
由于鉬的中間產品無論是鉬酸銨還是鉬酸鈉,其分子結構中均沒有 S的存在,所以輝鉬精礦分解的主要目的是脫硫,主要的化學反應是氧化。由于輝鉬精礦氧化時,正常情況下,不僅硫要氧化為硫酸根或單質硫,鉬一般也需要從四價氧化為六價的鉬酸根或鉬酸,因此在理論上氧化劑消耗很大。加之氧化過程受限于擴散過程控制,在動力學上常常難以達到理想的氧化速度,從表 1也可以看出,即使具有很高的氧化電極電位,也不一定具有相應的氧化速度。所以輝鉬精礦的分解進展主要集中在尋找新的氧化劑、強化分解過程,具有很強的針對性,目的是達到工業生產所需的分解率和分解速率的同時兼顧成本、環保因素。影響氧化的主要因素有氧化劑的氧化能力、溫度、擴散速度等。此外,需要注意的是,輝鉬精礦分解只是整個鉬冶煉工藝的一個組成部分,在分解工藝的選擇上需要綜合考慮其與系統的配套問題,如分解過程帶入雜質引起的凈化問題、能耗問題,本文不作深入探討。
3.1 傳統的輝鉬精礦分解工藝[2]
傳統的輝鉬精礦分解工藝可以分為火法氧化與濕法氧化兩類。火法工藝包括鉬精礦焙燒工藝及其改進,即通過空氣中的氧作為氧化劑在高溫下將硫化鉬氧化為氧化鉬;濕法工藝即采用 HNO3、C l2、次氯酸、O2等氧化劑在溶液環境中氧化硫化鉬為鉬酸或鉬酸根,包括酸性條件高壓氧分解與硝酸分解法,堿性高壓氧化法,次氯酸鈉氧化法以及電化學氧化法等工藝。
化學反應方程式分別為:
M oS2+3.5O2=M oO3+2SO2
M oS2+6HNO3=H2M oO4+2H2SO4+6NO
M oS2+4.5O2+3H2O=H2M oO4+2H2SO4
MoS2+4.5O2+6OH-=6MoO42-+2S O42-+3H2O
M oS2+NaC lO+6NaOH-=Na2M oO4+2Na2SO4
氧化電解法實質是氯化鈉電解生成次氯酸鈉作為氧化劑的次氯酸鈉氧化法。
3.2 輝鉬精礦分解工藝的最新進展
3.2.1 二氧化錳與輝鉬精礦共同焙燒[3]
將輝鉬精礦和二氧化錳按摩爾比 1∶3的比例均勻混合,管式爐中在溫度 450℃和 550℃下分別煅燒 2 h,輝鉬精礦的分解率可以達到 99.5%以上,固硫率可達 92%。得到的焙砂M o、M n浸出率分別達到99%和98%。
M oS2+9M nO2=M nM oO4+6M nO+2M nSO4
此工藝的基本原理是利用軟錳礦的氧化性氧化輝鉬精礦,達到氧化與固硫的目的,優點是在不改變現有焙燒設備的情況下,降低了能耗,較好地解決了含硫煙氣污染、金屬綜合回收率偏低等問題。
缺點是軟錳礦消耗較大,需要回收轉化以達到循環使用的目的,火法固有的收塵問題依然存在。
此外,還可以添加氧化鎂,達到固硫與實現焙燒粉疏松,解決焙燒結瘤的問題。
3.2.2 二氧化錳酸性體系氧化輝鉬精礦[4]
在二氧化錳為理論量的 1.2~1.4倍,輝鉬精礦粒度為 -150目,硫酸濃度為 8 mol/L,催化劑硝酸濃度為 0.4 mo l/L,分解時間為 4~6 h,溫度為95℃,固液比 1∶3的條件下,輝鉬精礦的分解率可達到95%以上。
M oS2+9M nO2+15H+=HM oO4-+6H2O+ 2HSO4-+9M n2+
【M n】=1.0 M
此工藝的關鍵點在于加入適量的硝酸為催化劑加快了溶液體系下二氧化錳對輝鉬精礦的氧化速度。如果沒有催化劑,在硫酸濃度為 5 mo l/L,浸出時間 23 h,M nO2/(M oO2+M oS2)=0.8的條件下,溶解量不大于 0.2 gM oS2/L。
3.2.3 超聲波電氧化分解輝鉬精礦[5,6]
在超聲波作用方式為每隔 15 m in發射 3 m in、電解質NaC l濃度為 20%、礦漿初始 pH為 10、電解電壓為 3.5 V、電解溫度為 25℃、固液比為 1∶50的條件下,M o的浸出率和電解效率分別為 91.9%和91.8%。
超聲波浸出輝鉬礦的途徑有以下幾個方面:
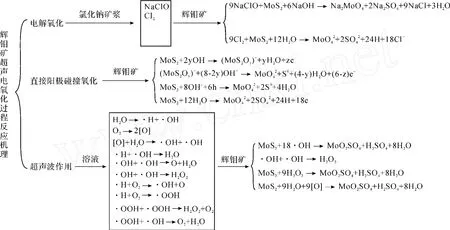
圖4 超聲波電氧化分解輝鉬精礦的反應機理示意圖
(1)礦漿體系中的礦物懸浮粒子與陽極發生碰撞接觸,直接被氧化分解;
(2)電化學反應生成的產物NaC lO氧化分解輝鉬礦;
(3)陽極產物 C l2氧化分解輝鉬礦;
(4)其他陰極產物直接氧化輝鉬礦,如 H2O2;
(5)超聲空化作用形成的具有強氧化性的·OH直接參與輝鉬礦的氧化分解。
此工藝的關鍵機理在于超聲波強化食鹽電解氧化輝鉬精礦的同時,超聲波空化作用形成的具有強氧化性的·OH直接參與輝鉬精礦的氧化分解,解決了單純電氧化浸出率和電流效率低的問題。目前主要需要解決的問題是如何實現工業化。
3.2.4 M n3+/M n2+間接電氧化法分解輝鉬精礦[7]
在硫酸濃度為 7 mo l/L,硫酸錳濃度為0.5 mo l/L,電解電量為 20 A·h·g-1,電極距離為15 mm,陽極電流密度為 800 A/m2,溫度為 55℃,固液比為 1∶40的條件下,輝鉬精礦的分解率可以達到88.5%,采用超聲波強化后,浸出率可提高到92.3%。
此工藝實際上是酸性體系高價錳氧化與超聲波強化擴散過程的結合。
3.2.5 輝鉬精礦真空分解[8]
通過 2步法制備高純M oO3,第 1步先制備有色金屬雜質和 S含量極低的鉬粉,第 2步通過氧化法將鉬粉氧化成高純M oO3;可以生產出高純M oO3粉,同時無 SO2廢氣排放和回收問題;既解決了環保問題又提高了資源綜合效率。
將輝鉬精礦粉制粒、干燥,粒度為 5~15 mm,在溫度 1 300~2 000℃下,真空度控制為 0.01~100 Pa,恒溫時間為 80~240 m in下,輝鉬精礦分解為硫磺和含雜質與硫低的金屬鉬。通過先冷凝液化再固化的方式回收過程產生的硫蒸氣。
反應方程式為:
4M oS2=2M o2S3+2S2
2M o2S3=4M o+3S2
金屬鉬粉碎至粒度 <0.5 mm后進行焙燒氧化,溫度控制在 750~1 300℃,恒溫時間保持在15~25 m in內,冷凝可以得到純度 >99.9%的固態高純M oO3粉末。
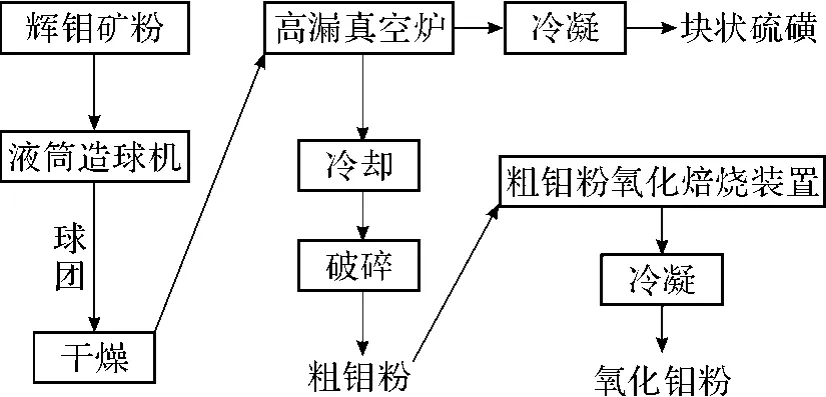
圖5 輝鉬礦真空分解制備高純氧化鉬工藝示意圖
此工藝簡潔明了,反應機理另辟蹊徑,可以以硫磺的形式回收 S,分解效果十分理想,但是需要真空設備與較高的溫度,在解決設備問題后,應用前景廣闊。
4 結論
從上述輝鉬精礦的分解工藝最新進展可以看出,輝鉬精礦分解工藝的進展主要表現在尋找新的氧化劑、強化分解過程以及簡化工藝過程上,目的集中在減少和避免污染,提高揮鉬精礦的分解率。由于輝鉬精礦的分解理論已經非常完善,任何一個改進都將產生很大的影響,特別是隨著環保壓力的增大以及優質資源的逐漸匱乏,輝鉬精礦的分解工藝將引起越來越高的重視。
[1]張啟修.鎢鉬冶金[M].北京:冶金工業出版社,2005.
[2]李洪桂.稀有金屬及高熔點金屬提取手冊[M].長沙:中南工大出版社,1998.
[3]吳江麗.輝鉬礦和二氧化錳共同焙燒新工藝的研究[D].中南大學碩士論文,2005.
[4]顧珩,李洪桂,劉茂盛.輝鉬礦濕法浸出新工藝研究[J].中國鉬業,1997,21(5):29-32.
[5]賈麗娟 .輝鉬礦超聲電氧化分解新工藝的研究[D].中南大學碩士論文,2008.
[6]符劍剛 ,鐘宏,彭斌,等.超聲強化電氧化法濕法分解輝鉬礦[J].過程工程學報,2005,5(04):6.
[7]符劍剛,鐘宏,黃永平,等.M n3+/M n2+間接電氧化法分解輝鉬礦[J].中南大學學報(自然科學版),2004, 35(05):20.
[8]趙維保.輝鉬礦真空分解制備高純氧化鉬的方法[P].中國專利:CN 101254949A,2008.
[9]鉬精礦技術條件 GB 3200-89.中華人民共和國國家標準[S].1989.

