骨橋蛋白與VEGF在增生性糖尿病視網膜病變玻璃體液中的表達
馬艷萍,朱承華
(1.上海梅山醫院眼科,江蘇南京 210039;2.南京醫科大學第一附屬醫院眼科,江蘇南京 210029)
糖尿病視網膜病變(diabetic retinopathy,DR)是糖尿病最常見和最為嚴重的微血管并發癥,特別是增生性糖尿病視網膜病變(proliferative diabetic retinopathy,PDR)可引起糖尿病患者嚴重的視力喪失。據統計,2型糖尿病患者致盲原因中DR的致盲率為33%,1型糖尿病患者則高達86%[1]。玻璃體液是高惰性的,并且受血—視網膜屏障保護,能間接反映視網膜分泌的細胞因子水平。玻璃體切割手術時獲得的玻璃體液使對人眼中細胞分子水平的研究成為可能。骨橋蛋白(steopontin,OPN)與血管內皮生長因子(vascular endothelial growth factor,VEGF)是目前增生性視網膜疾病研究的熱點,本實驗采用酶聯免疫吸附試驗(ELISA)定量測定OPN和VEGF含量,通過對PDR與非DR患者玻璃體液中OPN與VEGF含量的比較及分析,初步了解OPN和VEGF之間的關系,以及兩者與PDR發生、發展之間的關系。
1 資料和方法
1.1 一般資料
收集南京醫科大學第一附屬醫院眼科2008年3月至2008年12月28例(11男,17女)PDR患者(PDR組)的玻璃體液,年齡30~75歲;選取特發性黃斑裂孔(IMH)患者玻璃體液樣本24例(7男,17女)作對照組(IMH組),年齡52~77歲。兩組間年齡、性別差異均無統計意義。診斷標準參照DR國際分類法(1983年),直接、間接眼底鏡檢查及眼B超和眼底熒光造影(FFA)檢查結果。兩組均行現代閉合式玻璃體切割手術,排除眼外傷、高度近視以及眼底靜脈阻塞等引起的玻璃體視網膜病變等病例。
1.2 標本采集
玻璃體液取樣:開瞼后以0.5 g?L-1碘伏稀釋液消毒結膜囊,無菌生理鹽水反復沖洗,無菌紗布吸盡結膜囊中殘液,在玻璃體腔灌注前由睫狀體平坦部抽取玻璃體液樣本,約0.2 ml,標本移至已消毒并硅化的0.5 ml Eppendorf管,存放于-70℃冰箱備用。
1.3 實驗材料
人OPN試劑盒(human osteopontin immunoassay,catalog number DOST00,美國R&D公司產品),∑550型酶標儀(美國),Taq酶(5 U?μl-1,美國Invitrogen公司),IQ5熒光定量儀(BIO-rad公司)。
1.3.1 玻璃體液OPN與VEGF濃度測定 從冰箱中取出標本,置于室溫下10 min待測。根據ELISA試劑盒的說明,將標準品用稀釋液定比稀釋,充分混勻。將酶標板各孔依次編號,每孔加RD1-6 100μl,并加入50μl標準液或樣品,混勻封口。室溫下孵化2 h,棄液,沖洗液清洗4次。每孔加入200μl OPN Conjugate,封口室溫下孵化2 h。棄液,沖洗液清洗4次。避光情況下每孔加入200μl底物顯色溶液,混勻,孵化30 min。再每孔加50μl反應終止液,混勻。酶標儀550 nm處讀數,30 min內測定各孔吸光度值(A值)。VEGF測定方法類似。根據定比稀釋標準品的A值繪制標準曲線,以樣品的A值和標準曲線算出樣品中OPN與VEGF的含量。
1.4 統計學處理
2 結 果
見表1。
表1 PDR與IMH組玻璃體液中OPN與VEGF水平(±s)
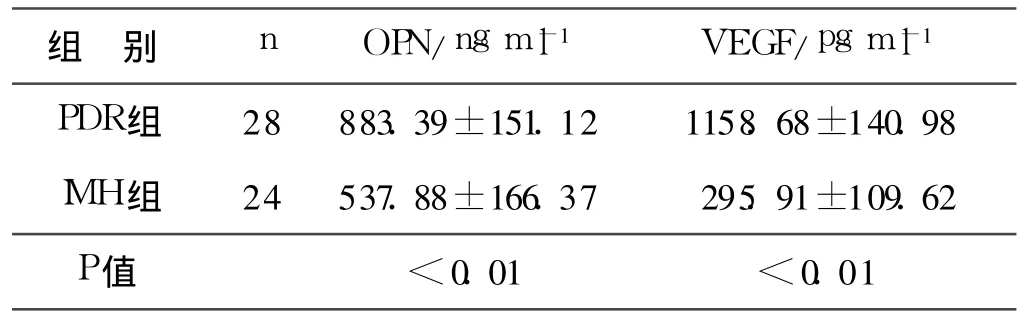
表1 PDR與IMH組玻璃體液中OPN與VEGF水平(±s)
組 別n OPN/ng?ml-1 VEGF/pg?ml-1 PDR組28 883.39±151.12 1158.68±140.98 IMH組24 537.88±166.37 295.91±109.62 P值 <0.01<0.01
由表1可見PDR組OPN及VEGF表達均較IMH組增高(P<0.01)。經分析PDR組OPN與VEGF相關性回歸方程為Y=549+0.690X,見圖1。
3 討 論
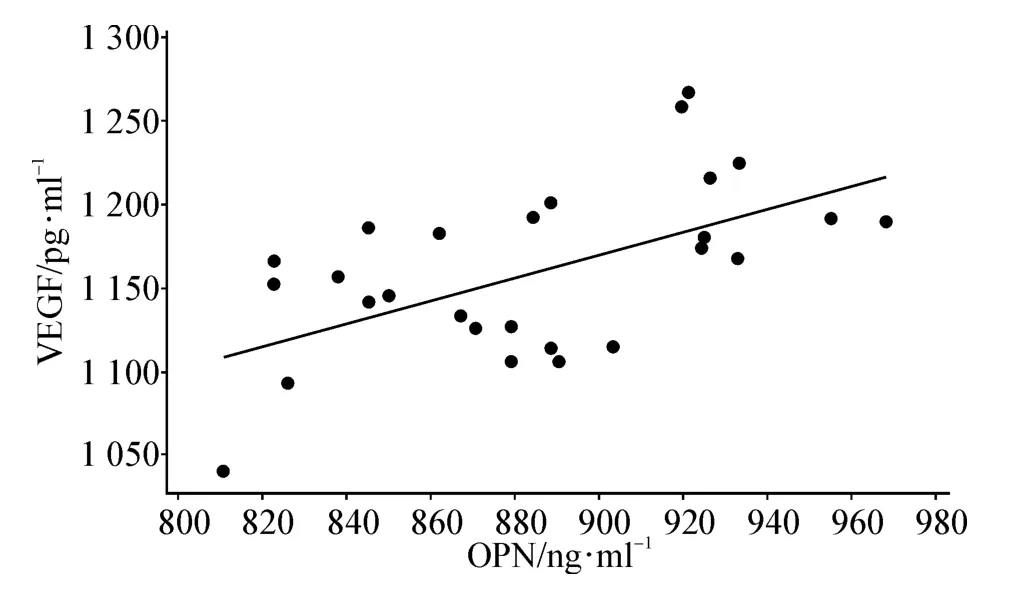
圖1 PDR患者玻璃體中OPN與VEGF水平的相關散點圖(r=0.69,P<0.01)
PDR的病理機制是血—視網膜屏障的破壞及視網膜新生血管形成造成的玻璃體視網膜增生性改變。OPN是一種帶負電荷的分泌性磷酸化糖蛋白,它具有鈣結合域、凝血酶裂解位點、整合素以及RGD結合序列等多個功能結合區,可由多種組織細胞合成與分泌,其在許多系統疾病中被發現。OPN參與多種組織細胞損傷的修復過程,有促細胞移動、黏附和增生分化等功能,是一種增生相關蛋白[2]。在基因水平的研究[3]已經證實,OPN在增生相關性疾病中顯著高表達,但在PDR中對OPN的臨床研究目前還較少。動物研究[4]證實:OPN多存在于視網膜神經節細胞層,在其他視網膜層分布較弱。本研究測得PDR病例玻璃體液中OPN濃度為(883.39±151.12)ng?ml-1,較IMH組(非糖尿病)[(537.88±166.37)ng?ml-1]明顯升高。另有研究[5]對PDR病例玻璃體液中OPN與血漿中OPN水平進行了比較,發現其濃度明顯高于血漿,故非血眼屏障破壞等因素可以解釋玻璃體液中OPN濃度高于血漿中OPN濃度,說明PDR病例玻璃體中的OPN可能由眼內產生,提示了OPN水平升高可能在增生性糖尿病視網膜病變的病理過程中起了一定的作用。Chidlow等[4]以興奮性中毒和局部缺血損傷后的小鼠模型視網膜進行了OPN表達的時間和定位檢測,通過mRNA分析和免疫組織化學的方法發現,在模型眼中出現了OPN mRNA上調,具體產生的細胞尚不明確,增高的OPN通過RGD序列和與視網膜血管內皮細胞的整合素受體結合后引起聚集黏附激酶(FAK)磷酸化,通過Grb2/SOS或FAK/Src激活Ras、MAPK途徑,調節細胞骨架蛋白組裝,細胞的聚集、黏附,血管內皮細胞增生和視網膜新生血管的生成。
血管源性因子是導致糖尿病視網膜細胞異常增生和新生血管生成的主要原因。前期研究[6]揭示,VEGF及其受體在正常角膜各層均有表達,但表達量很低,而在眼部一些疾病中則高表達,能促使內皮細胞的增生、遷移,蛋白水解和病理性血管生成。VEGF能特異性作用于視網膜血管內皮細胞,是最直接的眼內新生血管形成因子。大量臨床研究[7]顯示,DR患者玻璃體和視網膜VEGF水平升高,且隨著DR嚴重程度的增加,VEGF相應增多,其受體水平也隨之升高。缺氧可誘導視網膜細胞內缺氧誘導因子-1(hypoxia inducible factor-l,HIF-1)的活性增強,上調VEGF等血管形成因子的表達,產生的VEGF通過與其特異性受體結合激活其下游的一系列蛋白,如激活磷脂酶C,水解磷脂酰肌醇二磷酸,產生二脂酰甘油DAG和肌醇三磷酸IP3,DAG可激活胞漿內蛋白激酶C,進而啟動細胞內系統,主要對毛細血管后靜脈和小靜脈施加影響,增加其通透性,可使血液中的大分子物質進入細胞外基質中,形成纖維蛋白凝膠等,有利于新生血管和基質細胞生長[8]。同時VEGF還可以誘導蛋白水解酶、組織因子、基質膠原酶等在內皮細胞的表達,激活第Ⅶ因子從內皮細胞釋放,改變細胞外基質(ECM),介導內皮細胞遷移和浸潤,以利于血管生成[9]。反面證據是向鼠眼內注入VEGF受體Flt或Flk拮抗劑,可分別使視網膜新生血管形成減少100%和95%[10]。在本研究中,PDR患者玻璃體VEGF的平均含量[(1 158.68±140.98)pg?ml-1]明顯高于對照組(IMH組)的[(295.91±109.62)pg?ml-1],與國外報道一致。通過VEGF平均濃度的比較更直接地反映了新生血管活動性的水平,驗證了VEGF在PDR的發生、發展中起著重要作用。
本實驗統計分析表明,玻璃體液的OPN與VEGF含量呈顯著正相關(r=0.69,P<0.01)。Shijubo等[11]研究證實,在腫瘤生成的病理機制中VEGF能誘導OPN水平升高,進一步導致上皮細胞遷移,使新生血管生成促進腫瘤生長和轉移,但具體機制尚不清楚。因此,我們推測,在PDR患者由視網膜微循環缺氧作為始動因素,導致OPN和VEGF水平上調,兩者作用于視網膜血管內皮細胞不同的受體,通過不同的途徑共同促進病理性視網膜新生血管的形成。
綜上所述,我們的研究結果提示,OPN和VEGF共同參與PDR患者病理性新生血管的形成過程。但由于PDR形成涉及多種因子,可能存在多條影響途徑,故其具體增生機制仍是困擾人們的一個難題。病理情況下OPN的分布,何種視網膜細胞分泌來源,OPN分泌與病程時間、相關細胞因子之間的關系以及OPN發揮生理功能的具體通路,何種藥物能夠減少OPN的生成等仍不清楚,需要我們今后進一步的研究來明確,為PDR的預防和治療引入新的有效思路和方法。
[1]陳萍,趙煒,王楠,等.糖尿病視網膜病變熒光造影臨床分析[J].國際眼科雜志,2007,7(3):863-864.
[2]DENHARDT D T,GUO X J.Osteopontin:a protein with diverse functions[J].FASEB,1993,7(12):1475-1482.
[3]TAKAGI H,SUZUMA K,OTANI A,et al.Role of vitronectin receptor type integrins and osteopontin in ischemia-induced retinal neovascularization[J].Jpn Ophthalmol,2002,46:270-278.
[4]CHIDLOW G,WOOD J P,MANAVIS J,et al.Expression of osteopontin in the rat retina:effects of excitotoxic and ischemic injuries[J].Invest Ophthalmol Vis Sci,2008,49(2):762-771.
[5]KASE S,YOKOI M,SAITO W,et al.Increased osteopontin levels in the vitreous of patients with diabetic retinopathy[J].Ophthalmic Res.2007,39:143-147.
[6]SAISHIN Y,SAISHIN Y,TAKAHASHI K,et al.VEGF-TRAP(R1R2)suppresses choroidal neovascularization and VEGF-induced breakdown of the blood-retinal barrier[J].Cell Physiol,2003,195(2):241-248.
[7]SHAMS N,IANCHULEV T.Role of vascular endothelial growth factor in ocular angio genesis[J].Ophthalmol Clin North Am,2006,19(3):335-344.
[8]ARJAMAA O,NIKINMAA M.Oxygen-dependent diseases in the retina:roleof hypoxia-inducible factors[J].Exp Eye Res.2006,83(3):473-483.
[9]胡建斌,陳大年.增生性玻璃體視網膜病變玻璃體血管內皮生長因子的表達[J].中華眼科雜志,2000,36(5):388-389.
[10]AIELLO L P,PIERCE E A,FOLEY E D,et al.Suppression of retinal neovascularization in vivo by inhibition of vascular endothelial growth factor(VEGF)using soluble VEGF-receptor chimeric proteins[J].Proc Natl Acad Sci USA,1995,92(23):10457-10461.
[11]SHIJUBO N,UEDE T,KON S,et al.Vascular endothelial growth factor and osteopontin in tumor biology[J].Crit Rev Oncog,2000,11:135-146.

