基質金屬蛋白酶在冠狀動脈內膜增厚中的作用研究
李 化 王春生 陳志強 丁文軍 趙 東 洪 濤 陳 昊
(復旦大學附屬中山醫院心外科,上海市心血管病研究所,上海 200032)
基質金屬蛋白酶家族(matrix metalloproteinases,MMPs)是一組擁有超過20種降解細胞外基質成分的含2價鋅離子的水解酶,各種MMPs之間有相互交叉的底物,但每種MMP至少能降解1種細胞外基質(extracellular matrix,ECM)蛋白。在血管壁中,MMPs由各種細胞合成并分泌或表達在細胞膜表面,有促ECM新陳代謝和血管壁重構的作用。MMPs的轉錄、合成和活性在冠脈粥樣硬化斑塊的纖維帽中明顯上調,促進斑塊破裂[1]。MMPs的表達異常能造成血管壁的結構改變[2-3]。
由于正常人冠狀動脈存在的一定程度的內膜增厚[4]構成了各種病理性冠脈內膜增厚的基礎,而冠狀動脈內膜增厚所致管腔狹窄是許多心臟疾病的基礎病理學改變。我們猜想MMPs降解ECM的作用異常可能會導致冠脈內膜的增厚。以往關于MMPs在冠脈中的作用研究多局限于動物實驗[2,5-6]或人體頸動脈或冠狀動脈內膜切除術中取出的部分內膜組織[1,3]。本研究利用擴張性心肌病(dilated cardiomyopathy,DCM)心臟移植術中獲取的完整冠狀動脈組織,用Western blot半定量法檢測MMPs蛋白在冠脈壁中的表達,探討MMPs與冠脈內膜增厚的關系。
1 資料與方法
1.1 一般資料 在2004年10月—2007年5月行心臟移植術的患者中選擇20例無心肌缺血的臨床表現、病理檢查顯示冠脈無粥樣硬化病變的DCM患者。提取術中取出的受體心臟的左前降支冠狀動脈,取一小段用10%福爾馬林固定,將余下冠脈的外膜仔細從中層分離,使所取的冠脈中層和內膜層組織量達到0.3 g。
1.2 MMPs的檢測 用Western blot半定量法檢測冠狀動脈壁內MMPs的蛋白表達。將冠脈的中層和內膜組織作成勻漿,加RIPA裂解液,復合蛋白酶抑制劑(Roche公司),13 000 g離心30 min,取上清液。用Lowry法(Pierce Biotech公司)測蛋白濃度,還原型上樣緩沖液,10%SDS膠,每孔上樣量50 μg。硝酸纖維素膜轉膜。第 1抗體:小鼠抗人MMP-1、2、3、9、13、14單克隆抗體(EMD Chemicals公司),4℃孵育過夜。辣根過氧化物酶(H RP)標記羊抗小鼠IgG(KPL公司)作為第2抗體25℃孵育1 h。底物為ECL發光試劑(Pierce公司),用小鼠IgG(Abcam公司)代替一抗作為陰性對照。小鼠抗人甘油醛-3-磷酸脫氫酶(GAPDH)(Santa Cruz公司)作為內參。掃描顯影后的條帶,用軟件ImageJ 1.37V計算每條條帶的總象素值。以每個標本目標條帶與相應的GAPDH條帶的總象素值比值作為該蛋白的檢測結果。
1.3 組織形態觀察 將10%甲醛固定的冠狀動脈用石蠟包埋,5μm間隔連續切片備用。行HE、彈性纖維 van Gieson染色(EVG)、Masson三色法(MT)染色,物鏡(40×)下觀察組織形態學變化,并拍照。應用軟件ImageJ 1.37V計算中層和內膜層的面積,考慮到冠脈直徑大小的取樣誤差,用內膜與中層面積比來定量內膜增厚的程度。
1.4 統計學分析 連續變量用平均數±標準差表示。Pearson直線相關分析2個變量的相關性,相關系數用r表示。P<0.05認為差異有統計學意義。統計學分析用SPSS 11和Sigmaplot 8.0軟件。
2 結 果
2.1 一般資料 20例DCM 患者年齡12~72歲,平均(42.9±16.6)歲;男性 14例,女性6例。3例(15%)患高血壓,6例(30%)患糖尿病,4例(20%)患高脂血癥。術前左心室射血分數10%~30%,平均(19.35±5.85)%。
2.2 組織形態學 結合HE、EVG、MT染色,發現20例DCM患者的冠狀動脈均有不同程度同心圓形的內膜增厚(圖1),內膜與中層面積比平均為0.83±0.33。內彈力纖維層較完整,偶有斷裂;增厚的內膜為細胞纖維性,有時內膜內可見多層的節段狀彈力纖維,少見纖維脂肪樣細胞分布。
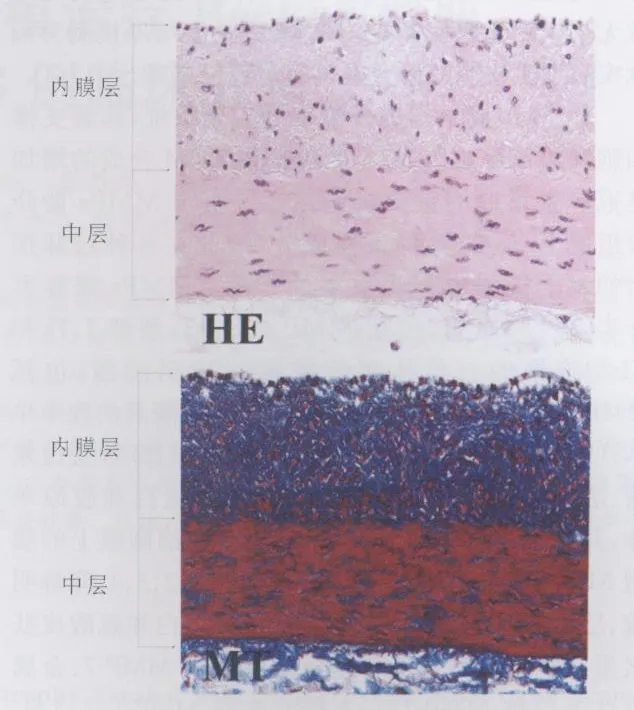
圖1 DCM冠脈切片的HE和MT染色(×400)
2.3 MMPs表達與內膜增厚的相關性 Western blot半定量分析(圖2)顯示冠脈壁中的MMP-3蛋白(r=-0.62,P<0.005)及 MMP-9蛋白(r=-0.47,P<0.05)的表達和冠脈內膜與中層面積比呈負相關。冠脈內膜增厚的程度和MMP-1蛋白(r=0.207,P=0.387)、MMP-2蛋白(r=0.159,P=0.504)、MMP-13蛋白(r=-0.293,P=0.211)、MMP-14蛋白(r=-0.104,P=0.662)及年齡(r=0.281,P=0.23)無顯著相關性。
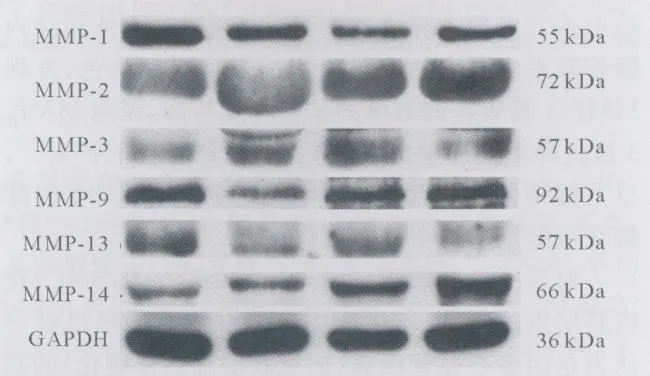
圖2 Western blot顯示 MMP-1、2、3、9、13、14 蛋白條帶
3 討 論
鑒于心臟冠狀動脈內膜增厚所致管腔狹窄是許多心臟疾病(如冠狀動脈粥樣硬化、冠脈成形術后再狹窄、移植心臟血管病變等)的基礎病理學改變,所以研究冠脈內膜增厚的機制顯得十分重要。以往研究[4]表明正常人存在一定程度的冠脈內膜增厚,這是各種病理性內膜增厚的基礎。我們希望通過研究冠脈無粥樣硬化病變的DCM患者的內膜增厚機制為冠脈疾病發生機制的研究提供一定理論基礎。
ECM組成了細胞外復雜的支架系統,起著支撐細胞和組成細胞外微環境的作用,ECM合成的增加是冠脈壁增厚的重要機制之一。由于MMPs能降解組成ECM的各種蛋白成分,因此在各種冠脈疾病的發生機制中起著重要的作用。MMPs家族可分為 :(1)膠原酶 ,包括 MMP-1、8、13,裂解 I、II 和III型膠原的三倍體螺旋結構;(2)明膠酶,包括MMP-2、9,降解彈性蛋白和經膠原酶裂解后的膠原單體;(3)基質裂解素,包括MMP-3、10、11,降解蛋白聚糖、層粘連蛋白、纖維連接蛋白、彈性蛋白和膠原單體,其中MMP-3作用最強;(4)表達在細胞膜上的膜型MMPs,包括MT-MMP1(MMP-14)、2、3、4,降解明膠、層粘連蛋白、纖維連接蛋白、波連蛋白和硫酸皮膚素蛋白多糖。另外還有基質溶解因子MMP-7、金屬彈性蛋白酶MMP-12。本研究選擇 MMP-1、2、3、9、13、14蛋白作為研究對象,分屬于4種MMPs,基本上能涵蓋MMPs在冠脈壁中的作用譜。
以往研究[2,6]表明消除MMPs基因的作用能促進病變動脈內膜的增厚。在敲除MMP-3基因的小鼠主動脈粥樣斑塊模型中,動脈粥樣內膜增厚的程度以及動脈內膜內纖維化程度較未敲除基因的對照組明顯增加[6]。同樣的現象也出現在敲除MMP-3和MMP-9基因的小鼠頭臂干動脈粥樣斑塊模型中[2]。在敲除組織MMPs抑制物-1(TIMP-1)基因后,MMPs的活性增強,可導致小鼠粥樣斑塊明顯縮小并且出現動脈瘤樣擴張[5]。通過對人體冠脈內膜切除術中取出的內膜組織的免疫組化染色,發現MMP-3高表達的冠脈的擴張程度較高,說明MMP-3通過降解冠脈壁的ECM造成冠脈直徑的擴大[3]。以上報道均說明MMP-3和 MMP-9對ECM的降解在冠脈壁重構中的重要作用。
血管平滑肌細胞(smooth muscle cell,SMC)在內膜層內的遷移、增生所引起冠脈內膜增厚已被公認為是諸多心血管疾病(如冠狀動脈粥樣硬化)的基本病理改變。我們通過免疫熒光染色也發現在DCM增厚的內膜層內存在SMC廣泛增生(待發表中)。以往的研究發現,在通過基因轉染組織MMP抑制物(TIMPs)的人大隱靜脈中,MMPs作用受到抑制,而向內膜遷移的SMC明顯減少并導致內膜增厚的程度減低[7];敲除 TIMP-1基因的小鼠MMP-2的活性增高,使損傷后的股動脈內膜的增厚程度和SMC的增生均高于對照組[8]。這種機制被認為是MMPs降解構成內膜基底膜的IV型膠原、層粘連蛋白和硫酸皮膚素蛋白多糖,從而促使SMC穿過基底膜由中層向內膜層遷移。本研究發現MMP-1、2、13、14的表達高低與內膜增厚無關聯,可能是由于MMPs有促SMC遷移至內膜層使得內膜層增厚和降解內膜ECM兩方面的作用,最終綜合起來不會影響到冠脈內膜的增厚程度。
總之,本研究發現MMP-3和MMP-9的表達與冠脈內膜增厚程度呈負相關,說明在MMPs表達差異引起冠脈內膜增厚的機制中,MMP-3和MMP-9的下調起著重要的作用。
1 Jason LJ,Christopher LJ,Gianni DA,et al.Activation of matrix-degrading metalloproteinasesby mast cell proteases in atherosclerotic plaques[J].A rterioscler Thromb Vasc Biol,1998,18(11):1707-1715.
2 Jason LJ,Sarah JG,Andrew CN,et al.Divergent effects of matrix metalloproteinases 3,7,9,and 12 on atherosclerotic plaque stability in mouse brachiocephalic arteries[J].Proc Natl Acad Sci USA,2005,102:15575-15580.
3 Paul S,Geoffrey V,Khaled MZ,et al.Relation of matrix-metalloproteinase 3 found in coronary lesion samples retrieved by directional coronary atherectomy to intravascular ultrasound observations on coronary remodeling[J].Am J Cardiol,2002,89:1354-1359.
4 Stary HC.Macrophages,macrophage foam cells,and eccentric intimal thickening in the coronary arteries of young children[J].Atherosclerosis,1987,64:91-108.
5 Silence J,Collen D,Lijnen HR.Reduced atherosclerotic plaque but enhanced aneurysm formation in mice with inactivation of the tissue inhibitor of metalloproteinase-1(TIMP-1)gene[J].Circ Res,2002,90(8):897-903.
6 Silence J,Lupu F,Collen D,et al.Persistence of atherosclerotic plaque but reduced aneury sm formation in mice with stromelysin-1(M MP-3)gene inactivation[J].Arterioscler Thromb Vasc Biol,2001,21:1440-1445.
7 Concepcion MA,Sarah JG,Jason LJ,et al.Relationship between type IV collagen degradation,metalloproteinase activity and smooth muscle cell migration and proliferation in cultured human saphenous vein[J].Cardiovasc Res,2003,58:679-688.
8 Lijnen HR,Soloway P,Collen D.Tissueinhibitor of matrix metalloproteinases-1impairs arterial neointima formation after vascular injury in mice[J].Circ Res,2002,91:1186-1191.

