豬流感病毒H1N1廣東分離株HA基因的克隆與進化分析
駱建才,劉義志,尚輝琴,冀 君,謝青梅*
(1.深圳市農牧實業有限公司,廣東深圳518023;2.華南農業大學動物科學學院,廣東廣州510642)
豬流感(Swine influenza,SI)是由甲型(A型)流感病毒引起的豬的一種急性傳染病。豬流感病毒(Swine influenza virus,SIV)的血凝素(hemagglutinin,HA)蛋白是流感病毒的膜外蛋白,可與靶細胞表面的唾液酸結合,幫助病毒顆粒黏附于細胞表面,使病毒得以侵入細胞。血凝素蛋白與病毒易感的宿主范圍和宿主對病毒感染產生的免疫反應有直接聯系,其裂解性、受體特異性和糖基化是決定流感病毒感染性和致病性的重要因素[1]。流感病毒以其基因快速突變、表面抗原頻繁變異而不斷引起新的流行。HA的受體結合位點(receptor binding site,RBS)對宿主細胞受體的結合能力的特異性對于流感病毒感染的宿主范圍起重要作用[2]。HA基因是病毒基因組中變異最快的,對于HA基因的研究在分子流行病學調查、毒株與亞型、疫情監測等方面具有重要的意義。近來年很多學者對不同地區不同時間的SIV的HA基因進行了研究分析。劉大飛等[2]對分離自廣東的一株H1N1亞型SIV研究表明,其HA基因可能來源于類人譜系的流感病毒;范鋒等[3]從無錫某豬場分離得到的H1N1亞型SIV研究表明,分離株屬于古典型H1N1 SIV;李敏等[4]從廣東不同豬場分離得到4株H3N2亞型SIV,證明HA基因屬于近代類人H3N2亞型流感病毒;溫納相等從廣東某豬場分離到9株豬流感病毒,4株為H1N1亞型,5株為H3N2亞型;趙樸等[5]成功構建了pMe-BacA-HA轉移載體,為開發HA亞單位疫苗奠定了基礎。
我國華南地區具備孕育流感病毒的自然條件和環境,在病毒起源和分子流行病學研究上,是世界新流感病毒亞型出現和流感暴發的疫源地[6-8],因此廣東地區流感毒株在未來流感病毒變異和流行中的作用值得深入研究。本研究對廣東地區2009年5—11月及2008年部分H1N1豬流感病毒的HA基因進行克隆和進化分析以及編碼的蛋白氨基酸重要的功能位點進行比對,在一定程度上反映廣東省H1N1亞型豬流感病毒的分子變異特征,為廣東及全國的豬流感疫情監測和防控提供依據。
1 材料與方法
1.1 材料
1.1.1 毒株 毒株分離于廣東一些豬場,分別命名為A/swine/Guangdong/02/2008/H1N1、A/swine/Guangdong/07/2008/H1N1、A/swine/Guangdong/09/2008/H1N1、A/swine/Guangdong/07/2009/H1N1、A/swine/Guangdong/05/2009/H1N1、A/swine/Guangdong/06/2009/H1N1、A/swine/Guangdong/09/2009/H1N1、A-swine/Guangdong/11/2009/H1N1。
1.1.2 載體和主要試劑 RNA提取試劑Trizol LS Reagent為GIBCO公司產品,AMV反轉錄酶及相關試劑、Taq聚合酶為Promega公司產品;pGEM-Teasy載體和Agarose Gel DNA Purification Kit為寶生物工程(大連)有限公司產品。
1.2 方法
1.2.1 引物的設計合成 參照文獻用流感病毒通用引物擴增HA基因,即HA-F:AGCAAAAGCAGGGGAAAA;HA-R:TCTCATGTCTCTGAAATCCT,包括全長的HA基因。引物由北京奧科生物技術有限責任公司合成。
1.2.2 病毒RNA的提取 參照Trizol LS Reagent說明書進行,提取RNA后直接用于RT-PCR。
1.2.3 HA基因的RT-PCR擴增 按常規RTPCR方法擴增HA基因,反應條件為:50℃反轉錄30 min;94℃預變性3 min;94℃40 s,55℃40 s,72℃2 min,循環30次;最后72℃10 min。反應結束后取5 μ L產物在10 g/L的瓊脂糖凝膠電泳,凝膠系統上觀察目的片段。
1.2.4 HA基因的克隆與鑒定 PCR產物純化回收,連接于T載體上。連接產物直接用于轉化DH5α感受態細胞。用PCR篩選陽性重組質粒,同時送陽性菌液到北京奧科生物技術有限責任公司測序鑒定。
1.2.5 HA基因序列比較和功能進化分析 應用Blast和DNA Star分析軟件對測序基因片段進行整個閱讀框架的核苷酸序列和推導的氨基酸序列進行同源性比較。
2 結果
2.1 HA基因的RT-PCR擴增
經10 g/L瓊脂糖凝膠電泳鑒定,擴增到的HA基因片段約1 757 bp,包括HA基因完整閱讀框(ORF)1 701 bp(圖1),與預期一致。
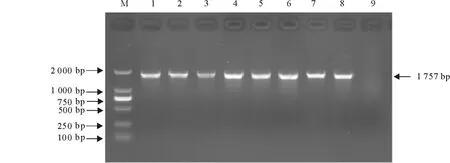
圖1 HA基因RT-PCR產物電泳結果Fig.1 Electrophoretic analysis of HA gene RT-PCR products
2.2 HA同源性及遺傳演化分析
HA氨基酸序列同源性分析表明,與經典SIV株同源性在92.3%~97.9%之間,與2009年人H1N1流感病毒同源性在80.4%~92.4%之間;與歐洲類禽SIV分離株同源性在80.4%~84.1%之間。從進化樹可以看到,本次分離得到的8株H1N1豬流感病毒的HA基因與A-swine-Shanghai-3-2005-H1N1聚在一塊形成一支,并以高Bootstrap值支持(100%),與類禽豬流感病毒的HA進化關系較遠;經典的5株豬流感HA有4株聚在一塊形成一支,其中A-swine-Maryland-23239-1991-H1N1與本次分離得到的12株HA及A-swine-Shanghai-3-2005-H1N1進化關系較近,聚在另外一大支上,以高Bootstrap值支持(96%);類禽豬流感病毒的3株單獨聚在一起形成一支Bootstrap值為100%;與2009年甲型H1N1流感病毒和經典豬流感病毒分離株親緣關系較近(圖2)。

圖2 H1N1豬流感病毒HA基因的遺傳進化樹Fig.2 Phylogenetic tree from the HA gene of H1N1 subtype swine influenza virus
2.3 HA基因編碼蛋白氨基酸序列變異分析
對本次分離得到的8株HA基因的推導氨基酸序列進行分析,均含有8個潛在的N-糖基化位點,且糖基化位點相同。對其切割位點處的氨基酸序列分析發現其序列為IPSIQSR↓G。
通過比較8株HA基因的抗原表位,發現其抗原表位無大的變異;與2009年甲型H1N1流感病毒及類禽豬流感病毒的HA蛋白抗原表位進行比較,發現有5處變異(圖3)。分離株HA與類禽豬流感病毒HA比較發現,在50位~60位,150位~160位,180位~190位,250位~260位,290位~300位氨基酸發生變化,導致其抗原表位發生了明顯變異;與2009年甲型H1N1流感病毒HA比較發現,在50位~60位,80位~70位,130位~140位,180位~190位,250位~260位氨基酸發生變化,導致其抗原表位發生了明顯變異。
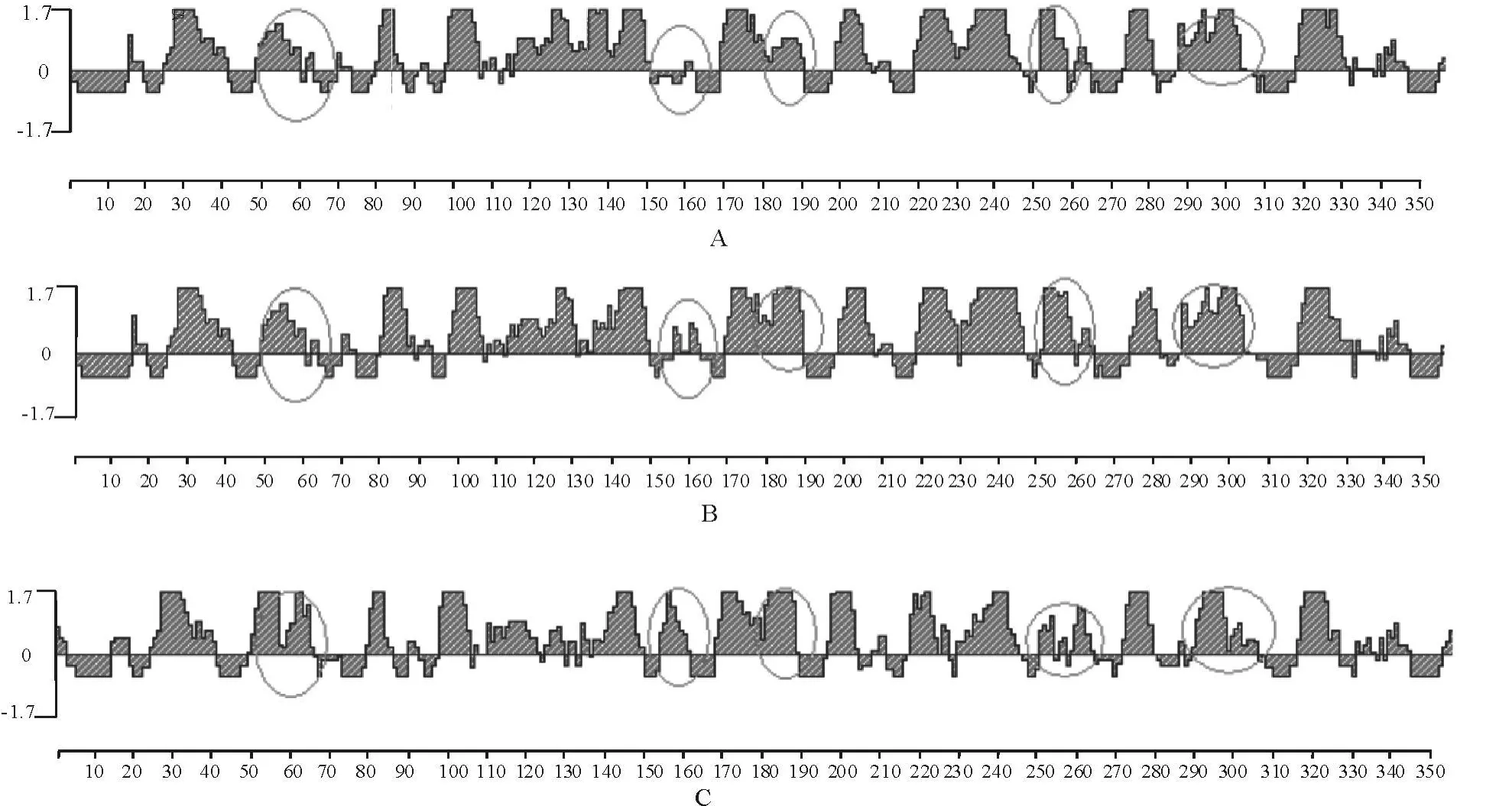
圖3 HA蛋白潛在的抗原決定簇及其特定區域位于蛋白表面的可能性比較Fig.3 Comparison of the antigenic determinant and surface probability plot of HA protein
3 討論
同源性比較及進化關系表明:本研究的分離毒株同源性很高(平均約99.8%以上),進化關系很近,都聚在一支上。表明2008年—2009年之間廣東省內流行的H1N1 SIV未發生明顯的變異;與經典SIV進化關系很近且同源性較高(最高為97.9%),與類禽SIV進化關系較遠,本研究毒株仍為經典SIV;與/swine/Shanghai/3/2005/H1N1進化關系很近,位于同一支上且同源性高(平均約為99.6%),可以推測本研究毒株與2005年上海毒株可能起源于同一毒株,2008年—2009年廣東省內流行的H1N1 SIV可能源于2005年上海毒株。
HA蛋白是SIV最主要的表面蛋白,也是宿主免疫系統最主要的靶抗原,因此對HA基因氨基酸的研究極其重要。本研究對8株分離株的HA蛋白的裂解位點、糖基化位點和受體結合位點進行了分析。豬流感病毒的HA基因存在著裂解位點(PCS)、糖基化位點和受體結合位點(RBS)等重要的氨基酸位點[9],HA糖蛋白的抗原特性直接影響病毒的感染性、致病性、宿主特異性、病毒在機體內的增殖傳播及病毒的組織嗜性。Matrosovich M等[10]研究發現,HA1和HA2裂解位點處糖基化位點的增加會降低流感病毒與細胞受體的親和力和病毒釋放能力,裂解位點處多1個堿性氨基酸的插入和糖基化位點的缺失均能使HA對蛋白酶切割的敏感性增強,而使致病力提高。本研究毒株HA基因的抗原表位無大的變異。8株分離毒株均含有8個潛在的N-糖基化位點,且糖基化位點相同。對其切割位點處的氨基酸序列分析發現其序列為IPSIQSR↓G。沒有發現糖基化位點和裂解位點的變化,說明本次獲得的分離株對宿主的致病力沒有發生大的變化,還是屬于低致病性毒株。
有研究報道,HA序列的第226位氨基酸決定病毒的宿主特異性,當SIV第226位的氨基酸為蛋氨酸(M)時,病毒就具有感染禽的的潛力。本次8個分離毒株的第226位的氨基酸為纈氨酸(V),未發生變異,因而不具有感染禽類的危險。
本研究通過對8株H1N1亞型SIV HA基因克隆的基礎上對其遺傳演化關系進行了分析,并對HA基因編碼的蛋白氨基酸重要的功能位點進行比對,在一定程度上揭示了廣東省流行的H1N1亞型豬流感病毒仍然屬于經典SIV,并未發生大的變異。
[1] Shu B,Balish A,Garten R,et al.Confirmation of the first Hongkong case of human infection by novel swine origin influenza(H1N1)virus diagnosed using ultrarapid,real-time reverse transcriptase PCR[J].J Clin Microbiol,2009,47(7):2344-2346.
[2] 劉大飛,劉 明,劉春國,等.H1N1亞型豬流感病毒廣東分離株全基因克隆及遺傳演化分析[J].病毒學報,2008,24(5):358-363.
[3] 范 鋒,倪谷音,毛愛民,等.豬流感病毒H1N1分離株HA基因的克隆與序列分析[J].動物醫學進展,2008,29(8):48-51.
[4] 李 敏,向 華,宣 華.4株H3N2亞型豬源流感病毒HA基因序列測定與特性分析[J].中國獸醫學報,2009,29(11):1424-1428.
[5] 趙 樸,鄭玉姝,賈貝貝,等.豬流感病毒H1基因的克隆及桿狀病毒轉移載體的構建[J].生物技術通報,2009(9):97-100.
[6] 蒙雪瓊,陳義祥,劉 棋,等.檢測H1和H3亞型豬流感病毒多重RT-PCR方法的建立[J].中國獸醫雜志,2009,45(4):18-19.
[7] 劉中勇,朱道中,李少璃,等.逆轉錄環介導等溫擴增技術檢測H3亞型豬流感病毒[J].動物醫學進展,2009,30(7):1-5.
[8] 謝家新,殷建華,李淑華,等.2009年新型甲型H1N1流感病毒血凝素基因進化分析[J].第二軍醫大學學報,2009,30(6):613-617.
[9] 寇 錚,胡松年,李天憲.甲型H1N1流感病毒流行株基因組進化分析[J].科學通報,2009,54(12):1652-1656.
[10] Matrosovich M,Zhou N N,Kawaoka Y,et al.The surface glycoproteins of H5 influenza viruses isolated from humans,chickens and wild aquatic birds have distinguish-able properties[J].J Virol,1999,73(2):1146-1155.