用于丙型肝炎病毒抗原測定的SiO2載體的制備及其性質分析
謝立,官月平,戈瑩,時洪波
1 首都醫科大學附屬北京佑安醫院,北京 100069
2 北京科技大學,北京 100083
丙型肝炎病毒抗原 (HCAg) 是丙型肝炎病毒(HCV) 早期感染的特異性抗原,是診斷 HCV早期感染的有效指標[1]。目前國內還沒有 HCAg的臨床檢測試劑[2]。在前期的研究工作中已用酶聯免疫吸附分析法 (ELISA) 對HCAg進行了初步檢測[3],在該方法中丙肝抗體 (抗-HCV) 通過簡單的物理吸附固定在聚苯乙烯酶標板上。有人認為聚苯乙烯酶標板吸附抗原的效果優于吸附抗體的效果;經過ELISA實驗過程中多次洗滌,聚苯乙烯酶標板吸附的蛋白質不斷解吸附而使其濃度愈來愈低;而且適用于某種抗原-抗體系統的聚苯乙烯酶標板,對另一抗原-抗體系統未必是最合適的[4]。
為此,本研究室正在進一步研究建立新的HCAg磁性免疫檢測系統,而固相載體的選擇和修飾方法是建立這種新的檢測系統的基礎。本研究旨在探討玻璃載體表面修飾方法對抗-HCV偶聯效率和免疫活性的影響。
1 材料和方法
1.1 試劑和儀器
純化 HCV基因工程表達 NS3抗原 (HCAg-NS3) (原中國預防醫學科學院病毒學研究所),戊二醛、硼氫化鈉 NaBH4、辣根過氧化物酶 (HRP) 標記山羊抗小鼠IgG (Sigma公司),牛血清白蛋白BSA (Roche公司),HRP標記丙肝 NS3單克隆抗體(McAb) (本研究室),其余試劑 (國產,分析純),酶標儀Model 680 (BIO-RAD公司),紫外分光光度計UV-2550 (日本島津)。
1.2 抗-HCV McAb的制備
按常規方法制備抗-HCV McAb[5],用飽和硫酸銨法進行純化。
1.2.1 SiO2載體的硅烷化
市售普通玻璃試管用鉻酸洗液浸泡過夜,Milli-Q水清洗,加入氨丙基三乙氧基硅烷 (APTES)水溶液 (pH 5~6),80℃振蕩反應,水清洗后再用無水乙醇清洗。
1.2.2 SiO2載體的醛基化
在已硅烷化的玻璃試管中加入 3% (V/V) 的戊二醛水溶液,室溫振蕩反應,用水清洗。
1.2.3 SiO2載體與抗-HCV McAb的偶聯
在已醛基化的玻璃試管中加入不同濃度的抗-HCV McAb溶液,37℃振蕩反應2 h,水洗4~5次后,加入濃度為2 g/L的BSA封閉液,4℃反應過夜,用水清洗。
1.2.4 抗-HCV McAb偶聯效率的吸光度測定
以稀釋抗-HCV McAb的緩沖液1×PBS為空白,在280 nm波長處分別測定抗-HCV McAb與玻璃偶聯前、后的吸光度值OD值。
1.2.5 抗-HCV McAb偶聯效率的免疫測定
在已偶聯抗-HCV McAb的玻璃試管中加入工作濃度的HRP標記山羊抗小鼠IgG,37℃反應30 min,0.02 mol/L PBST洗4~5次,TMB底物顯色,以2 mol/L H2SO4終止反應,在450 nm波長處測定吸光度值。以未偶聯抗-HCV McAb的玻璃試管為陰性對照。
1.2.6 HCAg的測定
在已偶聯抗-HCV McAb的玻璃試管中加入不同濃度的HCAg,以10% BSA溶液為陰性對照,37℃反應1 h,0.02 mol/L PBST充分洗滌后,加入工作濃度為1∶2000的HRP標記抗-HCV McAb,37℃反應30 min,0.02 mol/L PBST洗4~5次,TMB底物顯色,以2 mol/L H2SO4終止反應,在450 nm波長處測定吸光度值。加入HCAg試管的OD值與陰性對照管OD值之比大于等于2.1時判定為陽性反應。
1.2.7 統計學方法
全部數據均經SPSS13.0統計軟件分析,差異的顯著性用多元回歸分析的F檢驗和相關系數的顯著性檢驗。P<0.05為差異有統計學意義。
2 結果
用于偶聯玻璃試管的抗-HCV McAb純化后蛋白濃度為9.66 g/L,間接ELISA法測定效價為1∶30萬。
2.1 SiO2載體制備方法對抗-HCV McAb偶聯效率的影響
玻璃醛基化及蛋白質固定過程包括表面氨基化、醛基化、蛋白質的偶聯及還原等步驟 (圖 1),本研究主要討論醛基化的優化過程。
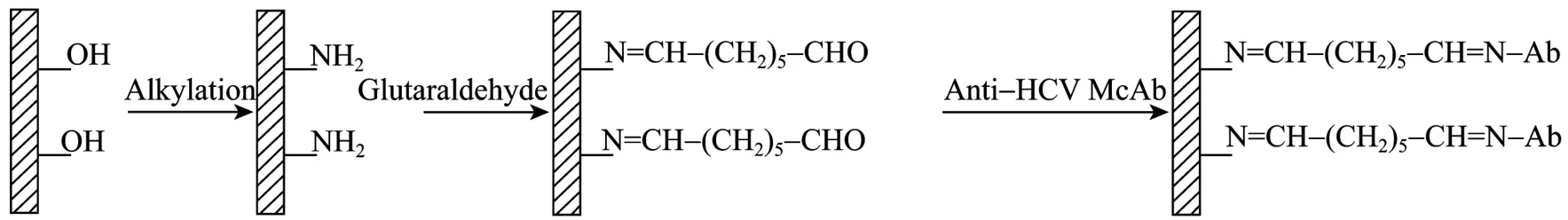
圖1 抗-HCV McAb固定到玻璃上的化學過程Fig. 1 Chemical process of anti-HCV McAb immobilized onto glass.
2.2 氨基硅烷濃度和反應時間的影響
抗-HCV McAb的偶聯效率受氨基硅烷的濃度和反應時間雙因素影響,多元回歸分析得到F=34.92,P<0.05,故總體上認為氨基硅烷的濃度和反應時間對抗-HCV McAb的偶聯效率有統計學意義。從表中可以看出,10% (V/V) 氨基硅烷水溶液處理3 h有最佳的效果 (表1)。
2.3 醛基化時間的選擇
用不同醛基化時間處理的玻璃試管進行抗-HCV McAb偶聯效率的免疫測定,結果顯示差異有統計學意義 (r=0.912,P<0.01),醛基化時間為2~ 3 h,抗-HCV McAb有較高的偶聯效率 (圖 2)。
2.4 不同濃度抗-HCV McAb的偶聯效率測定
表2數據顯示,差異有統計學意義 (r=0.945,P<0.01),抗-HCV McAb濃度增加,偶聯效率提高,在后續研究實驗中,選擇抗-HCV McAb濃度為8 mg/L作為與玻璃偶聯的濃度。
2.5 抗-HCV McAb不同偶聯時間的偶聯效率測定
從表 3可知,差異的統計學意義不明顯(r=0.676,P>0.05),在抗-HCV McAb濃度為8 mg/L時,隨著抗-HCV McAb偶聯時間增加,偶聯效率提高不明顯,所以選擇3 h為抗-HCV McAb的最佳偶聯時間。
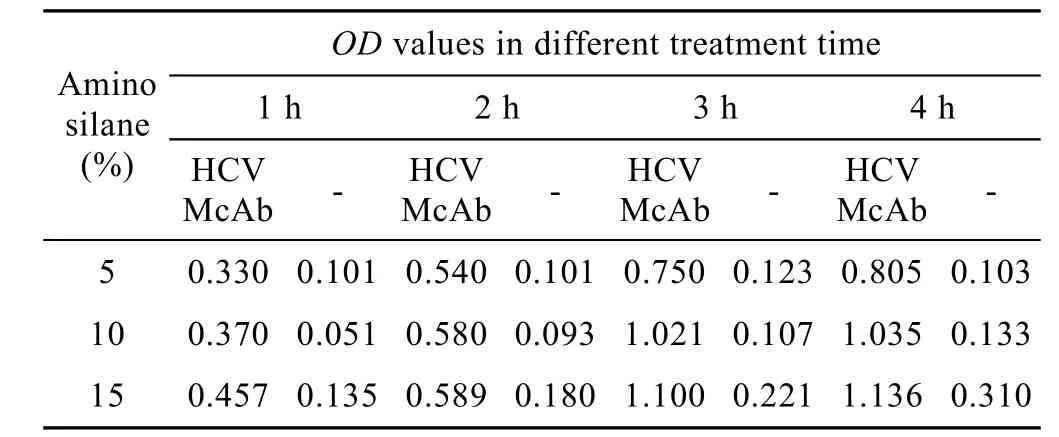
表1 氨基硅烷濃度和反應時間對抗-HCV McAb偶聯量的影響Table 1 Effect of aminosilane concentration and treatment time on anti-HCV McAb assay
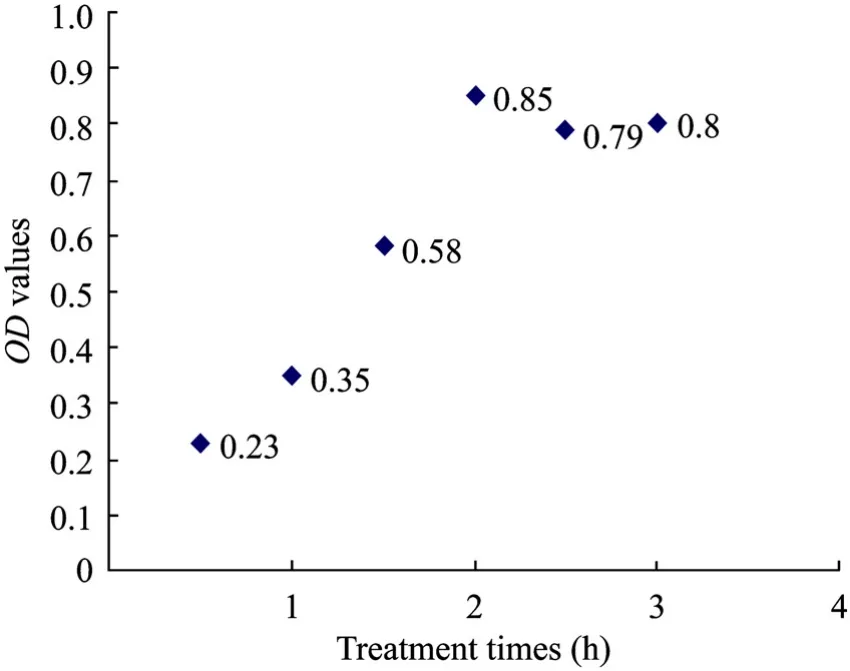
圖2 醛基化時間對抗-HCV McAb偶聯效率的影響Fig. 2 Anti-HCV McAb immobilization efficiency with different glutaraldehyde treatment time. The concentration of HCV McAb in the fig was 10 mg/L, as described previously[3]. The immobilization time in the fig was overnight, as described previously[3].
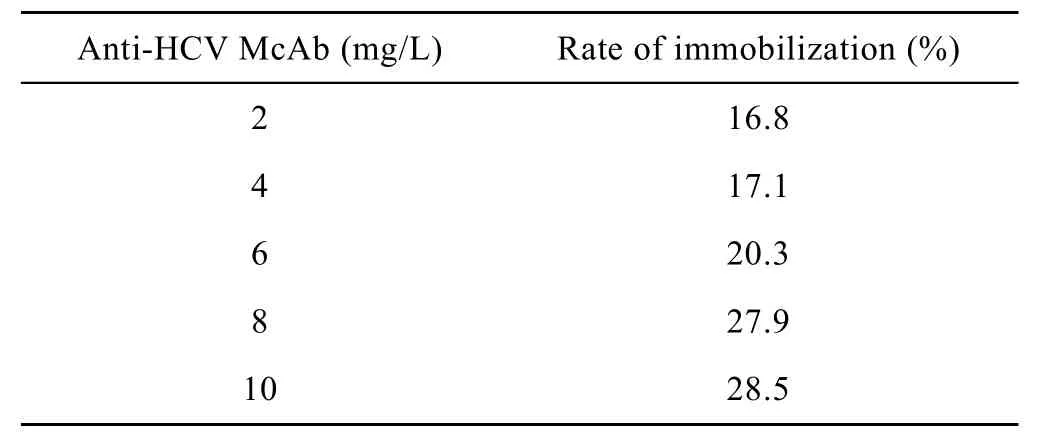
表2 抗-HCV McAb濃度對偶聯效率的影響Table 2 Effect of anti-HCV McAb concentration on immobilization efficiency

表3 抗-HCV McAb偶聯時間對偶聯效率的影響Table 3 Effect of immobilization time on immobilization efficiency
2.6 HCAg的測定
在 HCAg測定實驗中,HRP標記的抗-HCV McAb與玻璃試管上偶聯的抗-HCV McAb分別識別不同的HCAg抗原表位,形成有效的夾心模式檢測HCAg,測定結果顯示可檢測HCAg至1 μg/L。
3 討論
固相載體的質量直接關系到檢測結果,有多種不同的方法用于抗體在固相載體表面的固定[6]。目前,大多數用于臨床診斷的生物標志物的檢測方法主要為酶免疫測定、放射免疫測定、熒光免疫分析等,在這些傳統方法中,蛋白質通過疏水性物理作用微弱地吸附于固相表面,固定得不牢固,且容易影響蛋白質的結構和活性。
在蛋白質固定過程中,固相支持物的選擇和處理是很重要的一步,它不但要對蛋白質有較高的固定能力,而且還要保證固定在其表面的蛋白質保持活性[7]。玻璃具有廉價、表面光滑不滲透、背景低等優點,目前大多數蛋白芯片均以此作為固相載體[8],通過化學交聯法制得的固相蛋白質吸附容量大,蛋白質分子之間相互制約,吸附牢固,能夠耐受多次洗滌,具有較高的反應活性[9]。本研究實驗中使用的化學交聯劑是戊二醛,它是目前最常用的同型雙官能團化合物,其兩端的醛基可與硅烷化的玻璃和蛋白質的游離氨基形成shiff堿,從而完成蛋白質在玻璃表面的固定。但是戊二醛本身能使蛋白質中毒,所以根據費嘉等[10]的報道選擇 3% (V/V)的戊二醛水溶液進行反應。
Kusnezow 等[11]通過對丙基三甲氧基硅烷和多聚賴氨酸等修飾的玻片進行比較,結果顯示前者最好,但是在玻璃硅烷化過程中發現,氨基硅烷的濃度和反應時間對非特異反應有較大影響,可能是高濃度的氨基硅烷較長時間反應后吸附或固定到玻璃表面上所致。
為了減少測定過程中的非特異性結合,蛋白質固定后還應進行封閉,一般選用末端具有一個或多個羧基的封閉劑,在本研究實驗中選用濃度為 2%的BSA有較好的封閉效果。
總之,本研究中用于在玻璃上固定抗體的反應條件溫和,可在4℃~40℃及pH 6.0~8.0內進行,操作簡單,價格便宜;由于本研究應用化學交聯劑固定抗體,即抗體以共價鍵方式固定在載體表面,而前期研究工作中用ELISA方法測定HCAg時,抗體以物理吸附方式固定在載體表面,所以前者有較大量的固相蛋白參與后續反應,因而對HCAg檢測有更高的靈敏度 (ELISA法的靈敏度大于2 μg/L),為進一步用超順磁性納米微球進行高靈敏度、高特異性的HCV患者血清中痕量HCAg檢測提供了理論和實驗依據。
REFERENCES
[1] Laperche S, Le Marrec N, Simon N, et al. A new HCV core antigen assay based on disassociation of immune complexes: an alternative to molecular biology in the diagnosis of early HCV infection. Transfusion, 2003, 43(7): 958?962.
[2] Zheng HJ. The prospect on the technique of test for blood donor infected with hepatitis C virus during the infectious window period. Chin J Hepatol, 2002, 14(2): 159?160.鄭懷競. 獻血者丙型肝炎病毒“窗口期”感染的篩查技術展望. 中華肝臟病雜志, 2002, 14(2): 159?160.
[3] Xie L, Huang DZ, Chen HL, et al. The clinical application and analysis of hepatitis C virus NS3 antigen detection by ELISA in human serum. Chin J Microbiol Immunol, 2009, 29(1): 88?92.謝立, 黃德莊, 陳海倫, 等. 血清中丙型肝炎 NS3抗原ELISA檢測方法的建立和初步應用. 中華微生物學和免疫學雜志, 2009, 29(1): 88?92.
[4] Jiang CG, Tao YX. Enzyme Immunoassay. Beijing: People’s Medical Publishing House, 1984: 103?108.蔣成淦編著, 陶義訓審閱. 酶免疫測定法. 北京: 人民衛生出版社, 1984: 103?108.
[5] Xie L, Chen WR, Zhang MC, et al. Establishment and identification of monoclonal antibody of hepatitis C virus. Tianjin Medical J, 2005, 33(8): 492?494.謝立, 陳萬榮, 張明程, 等. 丙型肝炎病毒單克隆抗體的制備及其鑒定. 天津醫藥, 2005, 33(8): 492?494.
[6] Guilleaume B, Buness A, Schmidt C, et al. Systematic comparison of surface coatings for protein microarrays. Proteomics, 2005, 5(18): 4705?4712.
[7] Panicker RC, Huang X, Yao SQ. Recent advances in peptide-based microarray technologies. Comb Chem High Throughput Screen, 2004, 7(6): 547?556.
[8] Kusnezow W, Hoheisel JD. Solid supports for microarray immunoassays. J Mol Recognit, 2003, 16(4): 165?176.
[9] Wilson DS, Nock S. Functional protein microarrays. Curr Opin Chem Biol, 2002, 6(1): 81?85.
[10] Fei J, Ma WL, Wu QH, et al. Comparison of two different surface modifications for the preparation of prote in microarray. Life Sci Res, 2005, 9(4): 341?345.費嘉, 馬文麗, 吳清華, 等. 介質表面修飾對蛋白質芯片固定率和反應性的影響. 生命科學研究, 2005, 9(4): 341?345.
[11] Kusnezow W, Jacob A, Walijew A, et al. Antibody microarrays: an evaluation of production parameters. Proteomics, 2003, 3(3): 254?264.

