斜臥青霉纖維素酶和木聚糖酶高產菌株的選育
劉新育,靖梅貞,宋安東,劉亮偉,陳紅歌
(河南農業大學生命科學學院,河南鄭州 450002)
天然纖維素原料是地球上最豐富的可再生資源,但目前被利用的只有11%。纖維素大多被半纖維素包裹,其降解必然受到半纖維素(大多是木聚糖)的制約,所以纖維素酶和木聚糖酶兩種酶的聯合使用,廣泛應用到造紙、食品加工、紡織、動物飼料和能源工業等諸多領域[1-2],具有明顯的應用效果。自然界中的微生物通常能同時產生纖維素酶和木聚糖酶,但目前同時產纖維素酶和木聚糖酶的菌株產酶能力還不理想,所以獲得既產纖維素酶又產木聚糖酶的微生物成為高效降解纖維素原料的熱點途徑[3]。本研究利用纖維素酶活力為目前國內領先水平的斜臥青霉A50作為出發菌株,通過原生質體誘變育種方式獲得了產雙酶且雙酶酶活都很高的6號菌,并對該菌株雙酶的酶學性質進行了初步研究。
1 材料與方法
1.1 材料
1.1.1 實驗菌株 斜臥青霉(Penicillium decumbens)A50,由山東大學微生物技術國家重點實驗室曲音波教授饋贈。
1.1.2 試劑與儀器 樺木木聚糖是Sigma產品,蛋白質分子量Marker為TaKaRa產品;DNS溶液配置參照文獻[4]方法。UN ICO-7200型可見分光光度計為上海尤尼柯儀器有限公司產品;凝膠成像系統為Gene公司產品。
1.1.3 培養基 ①菌絲生長培養基:改良Mandels營養鹽液中加總液量10%的麩皮,煮沸10~15 min。4層紗布過濾,濾液5 000 r/min離心5 min,上清液即為菌絲生長培養基;②再生高滲培養基:向生長培養基中加入0.6 mol/L的葡萄糖;③孢子萌發培養基:生長培養基中加入0.059%的檸檬酸三鈉,0.1%的丙酮酸鈉,0.05%的L-天冬酰胺,0.005%的MgSO4·7H2O,0.015%的KH2PO4,0.005%的KCl,0.004%的NH4NO3,0.06%的葡萄糖,pH 6.0;④誘變篩選培養基:4%麩皮培養基。
1.2 方法
1.2.1 孢子懸浮液的制備 新鮮斜臥青霉A50菌株斜面,用少量無菌水洗脫后轉入50 mL裝有玻璃珠的孢子萌發培養基中,30℃靜置培養8~12 h,然后200 r/min震蕩培養3 h,用于原生質體的制備。
1.2.2 原生質體的紫外誘變 將制備好的原生質體懸浮液(纖維素酶:蝸牛酶:溶菌酶=7.5:7.5:2.5 mg/mL,30℃酶解3 h)稀釋至濃度為1×106~5×106個/mL,置于15W紫外燈下25 cm處理20 min。
1.2.3 誘變菌株的篩選 處理過的原生質體適當稀釋后涂布于添加0.1%樟腦(10%的乙醇溶液)的再生平板中。33℃恒溫避光培養4~6 d,隨機挑取菌落轉接至菌絲生長斜面,然后接入4%麩皮液體培養基中搖瓶發酵76 h,4層紗布過濾培養液,4℃下10 000 r/min離心10 min,上清即為粗酶液,測定酶活,篩選高酶活的菌株。
1.2.4 木聚糖酶活的測定[5]在最適反應條件下,以每分鐘產生1μmol木糖所需要的酶量為一個酶活力單位( IU)。
1.2.5 纖維素酶活的測定[6]在最適反應條件下,以每分鐘產生1μmol葡萄糖所需要的酶量為一個酶活力單位( IU)。
1.2.6 胞外蛋白的酶譜檢測 分離膠中添加1%木聚糖用于檢測木聚糖酶酶譜;分離膠中添加2%羧甲基纖維素鈉用于檢測纖維素酶酶譜[7-8]。
1.2.7 孢子形態的電鏡觀察 用碳膠帶印上菌落表面的孢子粉,噴鍍金原子后,在日立S-3400NⅡ型掃描電子顯微鏡下觀察。
2 結果與分析
2.1 突變株的初篩
A50的原生質體紫外誘變篩選結果見表1,從中篩選出木聚糖酶活和纖維素酶活都比較高的突變株6號菌,其纖維素酶活比親本A50有稍許提高,木聚糖酶活為67.3 IU/mL,是親本的1.86倍。經傳代10次,6號菌遺傳穩定性較好。
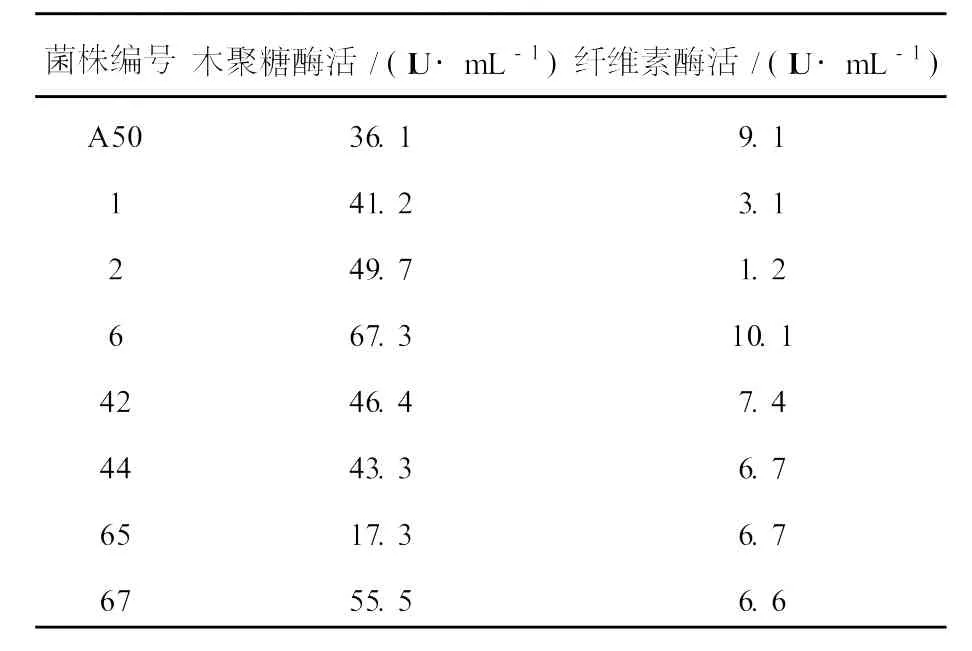
表1 A50誘變部分結果Table 1 The partial results of mutation of strain A50
2.2 菌落和孢子形態觀察
在相同生長條件下,A50和6號菌菌落形態相似;培養第10 d,6號菌菌落飽滿,而A50菌落出現褶皺。將A50和6號菌的孢子影印、處理,置電鏡下觀察,結果見圖1。A50的孢子為橢圓形,而6號菌的孢子較A50鈍圓。
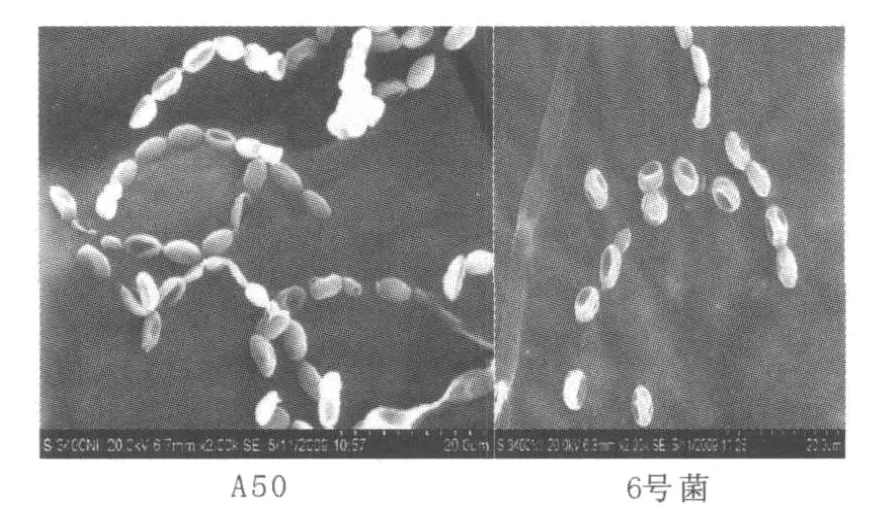
圖1 A50和6號菌孢子電鏡形態Fig.1 The spores of strain A50 and No.6 strain by SEM
2.3 木聚糖酶和纖維素酶的酶譜檢測
將A50和6號菌的粗酶液進行酶譜電泳SDS-PAGE,電泳結束后進行蛋白質復性、反應、染色,結果見圖2。酶譜檢測表明,6號菌和A50的纖維素酶譜條帶基本一致,6號菌條帶亮度略強。兩菌的木聚糖酶譜差異明顯,6號菌比A50多了一條29 ku左右的木聚糖酶條帶(PAGE上條帶較弱)。由此推測,6號菌木聚糖酶活力的提高可能是因為它的木聚糖酶系發生了變化。
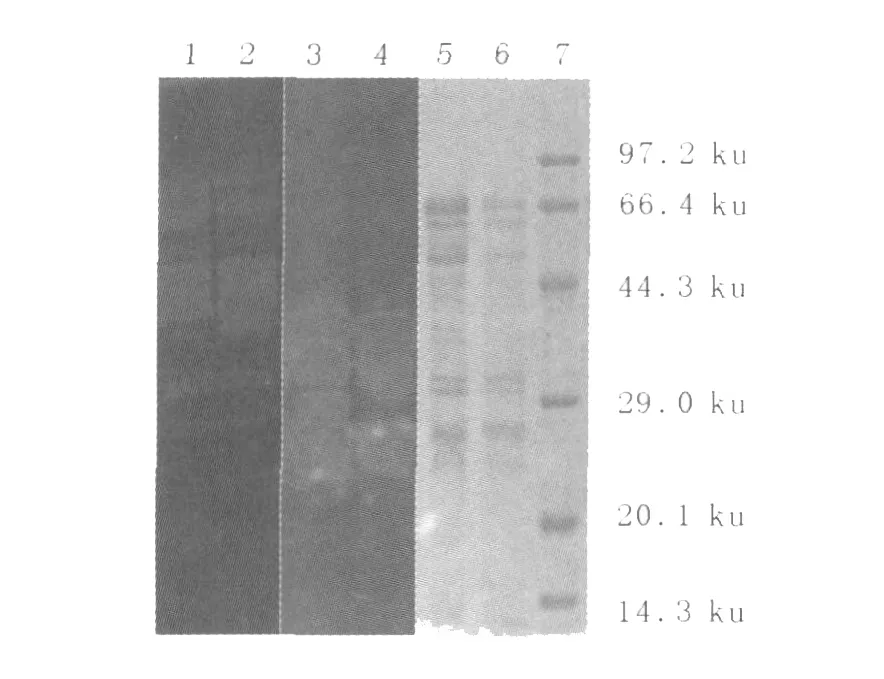
圖2 A50和6號菌培養液的SDS-PAGE和酶譜檢測Fig.2 Detection of SDS-PAGE and zymogram of cultures from strain A50 and No.6
2.4 麩皮濃度對菌株產酶的影響
選取不同濃度麩皮進行發酵,產酶情況見圖3。結果表明,當麩皮濃度為7%時,木聚糖酶活和纖維素酶活都達到最高。
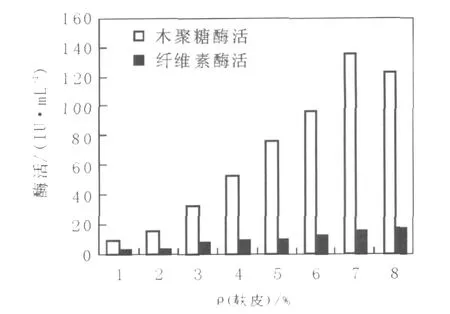
圖3 麩皮濃度對6號菌產酶的影響Fig.3 Effects of concentration of bran on strain No.6 producing xylanase and CMCase
2.5 輔加碳源對菌株產酶的影響
在主碳源為7%麩皮的條件下,選擇葡萄糖和蔗糖作為輔加碳源,添加濃度為0.1%~0.5%。液體發酵76 h測定雙酶活性,結果見表2。從表2可以看出,隨著葡萄糖濃度的增大,木聚糖酶活逐漸升高,纖維素酶活稍有下降,可見低濃度的葡萄糖可以促進木聚糖酶的產生;隨著蔗糖添加量的增大,纖維素酶活基本不變;蔗糖添加量從0.1%增加到0.2%時木聚糖酶活力有小幅升高,大于0.2%時基本不變。從生產成本的角度,選擇0.1%的葡萄糖作為輔加碳源。
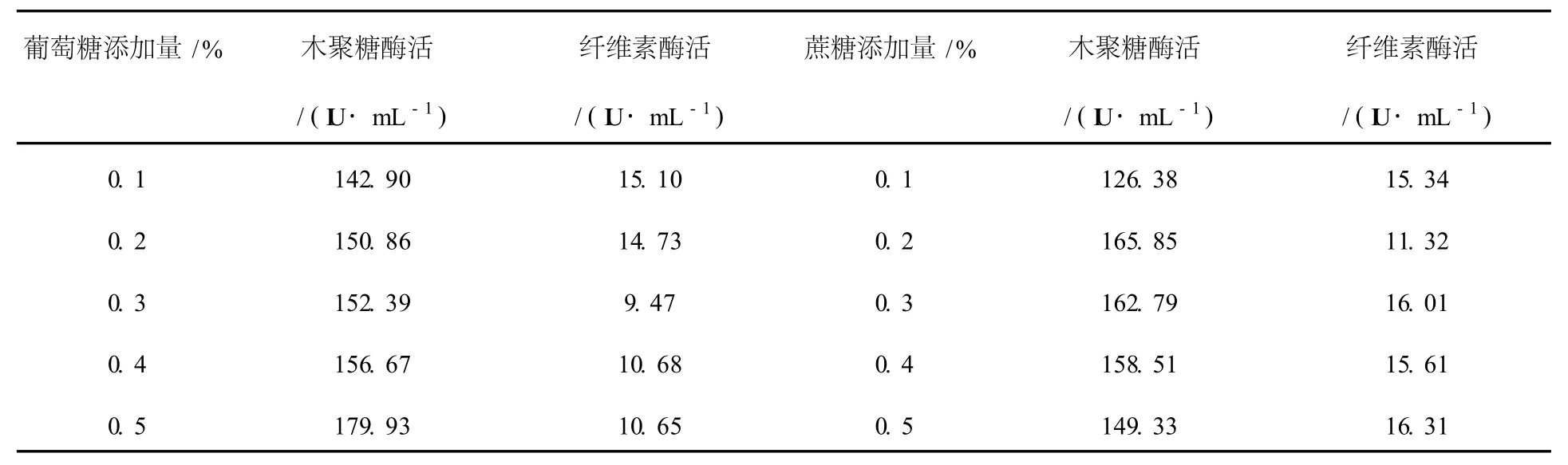
表2 葡萄糖和蔗糖添加量對產酶的影響Table 2 Effects of addition of glucose and sucrose on strain No.6 producing xylanase and CMCase
2.6 突變6號菌在不同溫度下的產酶曲線
將突變株6號菌接入上述優化培養基,并在不同溫度下搖床培養,從24 h開始,每隔12 h測定雙酶酶活,直到96 h結束,結果見圖4、圖5。結果表明,不同溫度下木聚糖酶的產量不同,在28℃和30℃時,木聚糖酶均在84 h到達產酶高峰期,28℃最高酶活力比30℃高,33℃產酶高峰期提前到72 h,且最高酶活比28℃略高;對于纖維素酶,6號菌在28℃和30℃下產酶比較緩慢,菌絲從36 h才開始產酶,84 h達到產酶高峰期,最高酶活性也相差不大,之后產酶能力逐漸下降,33℃時72 h即達到產酶高峰期,最高酶活比前兩者也要高。
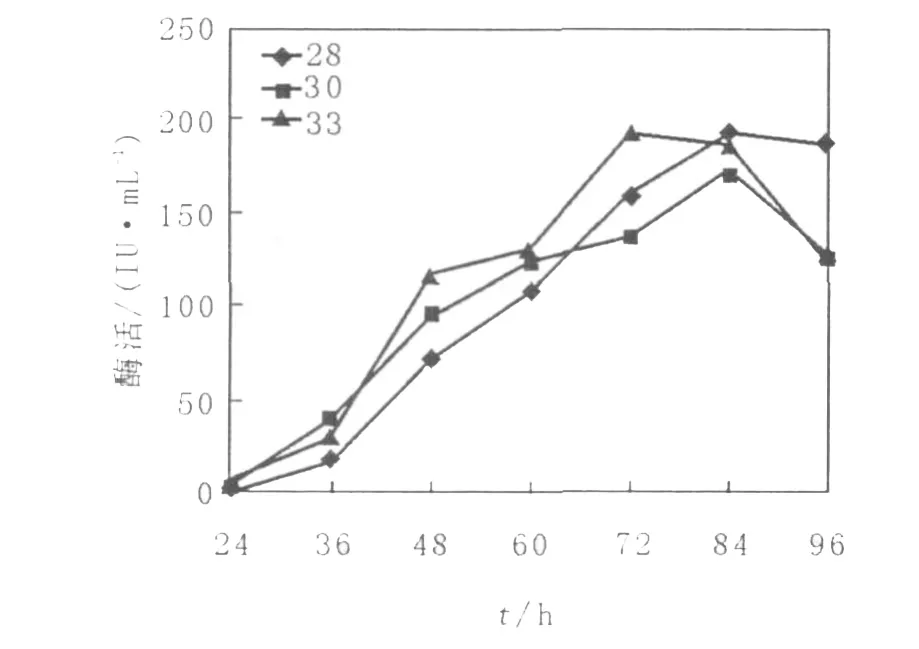
圖4 不同溫度下6號菌木聚糖酶的產酶曲線Fig.4 The course of strain No.6 producing xylanase under different temperature

圖5 不同溫度下6號菌纖維素酶的產酶曲線Fig.5 The course of strain No.6 producing cellulase under different temperature
由于木聚糖酶和纖維素酶產酶期同步,所以選擇33℃作為最適發酵溫度。
3 討 論
突變株6號菌的木聚糖酶譜比親本A50多了一條帶,相同培養條件下兩者的孢子形態也不同,表明6號菌確實發生了突變,可能是由于基因的表達調控因子得到了誘導或者是抑制因子被解除,使得受抑制的木聚糖酶基因得到表達,從而使木聚糖酶的酶活得到很大提高。
該菌遺傳穩定性良好,同時具備纖維素酶和木聚糖酶較高的產酶能力。另外,產酶培養基簡單,只需要7%的麩皮和0.1%的葡萄糖,不需要添加其他任何碳源、氮源以及表面活性劑等物質(數據未顯示),所以該菌株是一株非常適合工業生產的纖維素酶/木聚糖酶復合酶生產菌株,將有效地提高對纖維素原料的利用效率,在生物轉化和飼料等領域將具有很好的應用前景。
[1] P.I.P.Ponte,L.M.A.Ferreira,M.A.C.Soares.Use of Cellulases and Xylanases to SupplementDiets ContainingAlfalfa for Broiler Chicks:Effects on Bird Performance and Skin Color[J].J.Appl.Poult.Res.,2004,13(1):412-420.
[2] 陳朝銀,石家驥,錢世鈞.纖維素酶的研究進展與發展趨勢[J].微生物學雜志,2008,28(1):83-87.
[3] Subramaniyan S,Prema P.Cellulase-free xylanases from Bacillus and othermicroorganis ms[J].FEMSMicrobio Lett,2000,183:1-7.
[4] 北京大學制藥廠.微生物和酶學基本知識[M].北京:科學出版社,1971:201.
[5] 陳紅歌,朱靜,梁改芹,等.黑曲霉木聚糖酶的純化與性質[J].菌物系統,2000,19(1):111-116.
[6] 孫憲昀.斜臥青霉木質纖維素酶系的合成調控研究[D].山東大學博士論文,2007.
[7] Bartley TD,Murphy-Holland K,Eveleigh DE,A method for the detection and differentiation of celluase compotents in polyacrylamide gels[J].Anal.Biochem.,1984,140-157.
[8] Biely P,Mislivicova D,oman R.Soluble chromogenic substrates for the assay of endo-1,4-β-xylanase and endo-1,4-βglucanases[J].Anal.Biochem.,1985,144:140-142.

