ε-聚賴氨酸產生菌的篩選方法改進
李樹, 陳旭升, 廖莉娟, 張建華, 毛忠貴 *
(1.江南大學工業生物技術教育部重點實驗室,江蘇無錫 214122;2.江南大學生物工程學院,江蘇無錫 214122)
ε-聚賴氨酸產生菌的篩選方法改進
李樹1,2, 陳旭升1,2, 廖莉娟1,2, 張建華1,2, 毛忠貴*1,2
(1.江南大學工業生物技術教育部重點實驗室,江蘇無錫 214122;2.江南大學生物工程學院,江蘇無錫 214122)
改進了ε-聚賴氨酸(ε-PL)產生菌的篩選方法。在加有復合抑制劑的初篩平板上涂布土壤懸液,于30℃培養7 d后,將瓊脂整體揭下,平鋪到另一加有美蘭的瓊脂上。挑取形成透明圈的137株菌進行搖瓶發酵,發酵液與Dragendorff試劑和甲基橙反應,有50株呈陽性。通過薄板層析,確定有42株菌的產物含有賴氨酸聚合物。通過水楊醛保護氨基的化學法對產物進行了酰胺鍵連接方式的研究,確定了聚賴氨酸是由ε-NH2和α-COOH形成的ε-酰氨鍵聚合而成。通過生理生化特征和分子生物學鑒定,表明其中的一株菌為鏈霉菌屬中的稠李鏈霉菌Streptomyces padenus,其初始菌的搖瓶產量可達0.8 g/L。
ε-聚賴氨酸;篩選;菌種鑒定;16s rDNA
ε-聚賴氨酸(ε-PL)是一種水溶性強、抑菌譜廣、可以食用并且對人體無任何毒副作用的新型生物防腐劑,它由單一的L-賴氨酸通過α-COOH和ε-NH2形成的ε型酰氨鍵聚合而成,在人體內可分解為L-賴氨酸,作為人體必需氨基酸被吸收,不存在任何毒副作用[1-2]。1989年日本窒素公司首先用生物技術方法工業生產ε-PL,并獲日本厚生省批準使用,以后韓國也允許作為食品添加劑使用。2003年10月,美國 FDA正式批準ε-PL可以作為天然食品添加劑,即美國也開始使用ε-PL。有報道稱將ε-PL與其它防腐劑如山梨酸鉀復合使用則效果更佳[3]。除此以外,它還可以作為生物材料廣泛應用于藥物載體和基因芯片等領域[4]。因此,ε-PL在近些年來引起了學者們的廣泛關注。
ε-PL在國外尤其是日本研究較成熟且應用廣泛,而在我國正處于研發階段中,尚未見工業化生產報道。目前,國內有關ε-PL的研究領域走在前列的是天津科技大學[5]和南京工業大學[6],他們通過菌種選育和發酵條件的優化,使ε-PL實驗室水平達到20~30 g/L,但與日本窒素公司48.3 g/L的工業化水平相比還有較大差距。
研究ε-PL原始產生菌的篩選方法,獲得高產出發菌是通向產業化的重要途徑。2002年,Masanobu Nishikawa[7]通過在培養基中加入一種染料PolyR-478,使聚賴氨酸產生菌的周圍產生顏色變化,據此形成了大通量篩選方法。其研究表明,聚賴氨酸基本上是由鏈霉菌科的一些菌株產生的,少數麥角真菌也能產生。2005年,南京工業大學朱宏陽等[10]對賴氨酸產生菌進行了篩選,他們在初篩培養基中加入了美蘭,并利用檢測生物堿的D ragendorff試劑檢測,從而使篩選的特異性大為提高,并且篩選到了一株北里孢菌。江南大學的張超采用這種方法,在2006年也篩選到了一株白色鏈霉菌[9]。2007華南農業大學的段杉等用噴灑美蘭的方法代替了往培養基中添加美蘭,并設計了一種轉移裝置將瓊脂塊中成分轉移濃縮到濾紙上,簡化了顯色和檢測方法,篩得了一株灰橙鏈霉菌[11]。
在上述研究的基礎上,作者對段杉的篩選方法做了改進,實現了聚賴氨酸產生菌更靈敏的篩選方法;結合形態觀察和生理生化培養實驗,對其中一株潛在高產菌進行16s rDNA基因序列分析,鑒定為稠李鏈霉菌(Streptomyces padenus),這一結果尚未見報道。經搖瓶試驗,稠李鏈霉菌發酵產量達0.8 g/L。
1 材料與方法
1.1 實驗材料
1.1.1 土樣 采自山東、山西、江蘇、內蒙古等地,以林地和荒草地為主。除去表層土,取距表層5~15 cm的土壤50 g左右,裝入已滅菌的牛皮紙袋中。
1.1.2 培養基
1)初篩培養基:甘油10 g,(NH4)2SO40.66 g,M gSO4·7H2O 0.25 g,NaCl 0.5 g,ZnSO4·7H2O 0.01 g,FeSO4·7H2O 0.01 g,K2HPO4·3H2O 1.0 g,酵母膏0.1 g,抑菌劑(重鉻酸鉀30 mg,氟哌酸3 mg,青霉素2 m g,制霉素80 mg),瓊脂條20 g,純凈水 1 000 m L,p H 7.2。
2)復篩培養基:葡萄糖50.0 g,(NH4)2SO410.0 g,酵母膏5.0 g,M gSO4·7H2O 0.5 g,ZnSO4·7H2O 0.04 g,FeSO4·7H2O 0.03 g,K2HPO40.8 g,KH2PO41.4 g,水 1 000 m L,p H 6.8。
1.2 實驗方法
1.2.1 初篩方法 將稀釋后的土壤懸液涂布于初篩平板上,30℃恒溫培養7 d。將長有菌落的瓊脂整塊揭下來,平鋪到另一個加有美蘭的瓊脂平板上,其中美蘭質量濃度為0.003 g/dL。將兩層瓊脂于30℃放置2 h,觀察是否有透明圈形成。保留有透明圈形成的菌落進一步復篩。
1.2.2 復篩方法 菌落接種于復篩培養基,于30℃搖床培養,200 r/min離心72 h。離心去除菌體,取上清液分別與Dragendorff試劑和1 mmol/L的甲基橙溶液混合,兩者都有磚紅色沉淀生成的為陽性。從發酵液中提取產物,用6 mol/L的鹽酸水解,與賴氨酸作對照進行層析。
1.2.3ε-聚賴氨酸的定量測定 見文獻[11]。
1.2.4ε-聚賴氨酸的提取 發酵液過濾除菌體后,濾液用 NaOH調至p H 8.5,再過濾除去沉淀,濾液用陽離子(H+)交換樹脂(Amberlite IRC-50)吸附,分別用0.2 mol/L醋酸和0.1 mol/L鹽酸進行沖洗和洗脫,洗脫液用 NaOH中和至 pH 6.5,再進行減壓蒸發濃縮 ,濃縮液用活性碳脫色后,加入乙醇和乙醚(2∶1)混合液,過濾后得到的沉淀物即為ε-聚賴氨酸粗品。將提取到的ε-聚賴氨酸粗品溶解在蒸餾水中,然后經 G-25凝膠柱純化,凍干后得到固體樣品[6]。
1.2.5ε-聚賴氨酸的聚合方式鑒定 由于賴氨酸有α-NH2和ε-NH2兩個氨基 ,理論上可形成α-PL和ε-PL兩種形式的聚賴氨酸,所以需鑒定酰胺鍵的連接方式。準確稱取ε-PL標準品和樣品1.5 g,吸取2.3 mL水楊醛,分別加入裝有20 mL無水乙醇的圓底燒瓶中,加熱回流2 h。反應完畢后,過濾所得的沉淀,烘干,置于無水乙醇中,添加 4 g NaBH4還原,待反應完全后,加入蒸餾水,回收沉淀,烘干,加入 6 mol/L HCl,密封,于 121 ℃水解24 h,用薄層層析分析組成成分。
周祖謨先生在《審母古讀考》中指出“……即此觀之,可知審母二等字古蓋讀如心母矣”[4]。郭店楚簡中聲母為審母二等的通假字出現6次,其中有3次和心母接觸,也可補充周先生的結論。
1.2.6 菌株鑒定
1)形態與培養特征鑒定方法:參照文獻[13]。2)生理生化特征鑒定方法:參照文獻[14]。
3)16S rDNA分子生物學鑒定:取待鑒定菌株的純培養物,提取DNA,由上海生工生物工程技術服務公司進行PCR擴增及16S rDNA的測序,將得到的堿基序列在 GenBank數據庫中進行同源序列搜索,找出與待鑒定菌株同源性最高的模式菌株[15]。
2 結果與討論
2.1 初篩
2.1.1 初篩培養基中抑制劑的確定 相對于真菌和細菌來說,放線菌生長緩慢,為有效分離放線菌,需要抑制平板上細菌和真菌的生長。根據文獻報道,使用重鉻酸鉀可以有效抑制細菌和霉菌的生長,并且在一定程度上還能促進放線菌的生長。本研究中單獨使用重鉻酸鉀的效果并不好,難以滿足分離放線菌的要求,于是試驗了抑制劑青霉素、氟哌酸、制霉素、重鉻酸鉀的抑制效果[11],最終確定在初篩培養基中復合添加氟哌酸3 mg/L,青霉素2 mg/L,制霉素80 mg/L,重鉻酸鉀30 mg/L。采用這種組合,平板培養7 d內,幾乎沒有細菌和霉菌生長,并且放線菌的菌落數和菌落大小基本不受影響 ,見圖 1。
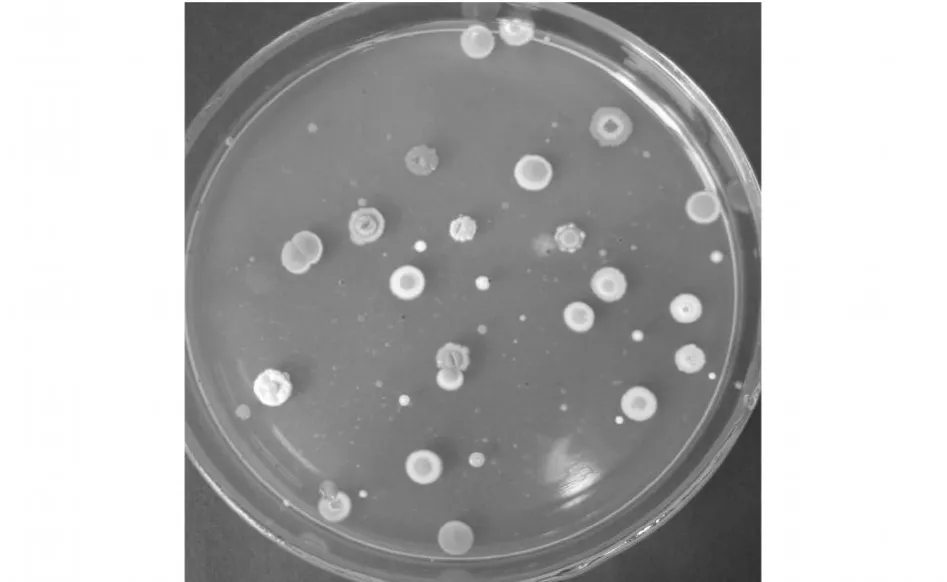
圖1 放線菌在復合抑制劑平板上的形態Fig.1 Colonymorphology on petridish added inhibitors of Actinomyces
2.1.2 平板初篩 將生長有菌落的瓊脂平鋪到美蘭瓊脂上后,上層瓊脂中的產物就會擴散到下層,由于美藍帶有正電荷,與同樣帶正電荷的堿性物質(包括ε-聚賴氨酸)發生靜電排斥作用,在菌落的周圍形成透明圈,見圖2。初篩中共發現137株產正電荷物質的放線菌。
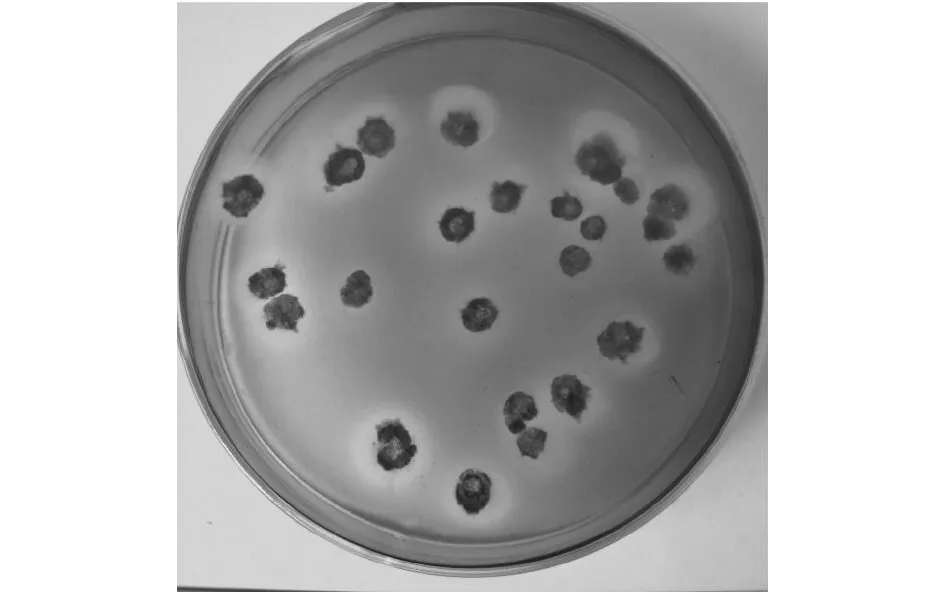
圖2 產正電荷物質的菌落排斥美蘭形成透明圈Fig.2 Special zoon formed by the electrostatic polymer producing strains
2.2 復篩
將137株產生透明圈的放線菌接種到復篩培養基中,發酵結束后離心除去菌體,取上清液分別與Dragendorff試劑和1 mmol/L的甲基橙溶液混合。由于ε-聚賴氨酸呈現生物堿的性質,能與Dragendorff試劑反應生成磚紅色沉淀;聚賴氨酸的氨基陽離子能與甲基橙的磺酸基陰離子形成離子對,在p H 3~10范圍內形成復合物沉淀。研究中共有50株菌的發酵液符合以上兩種特性。
選取有潛在高產能力的3株菌的發酵液按照1.2.4的方法提取產物,再用6 mol/L鹽酸水解后與賴氨酸對照層析,結果見圖3。發酵液的提取產物e停留在原點,通過與茚三酮顯色而呈現氨基酸的性質;而3種提取產物a,b和c的水解物在賴氨酸d相應的位置分別有條帶,這表明這些提取產物中均有賴氨酸聚合物的存在。
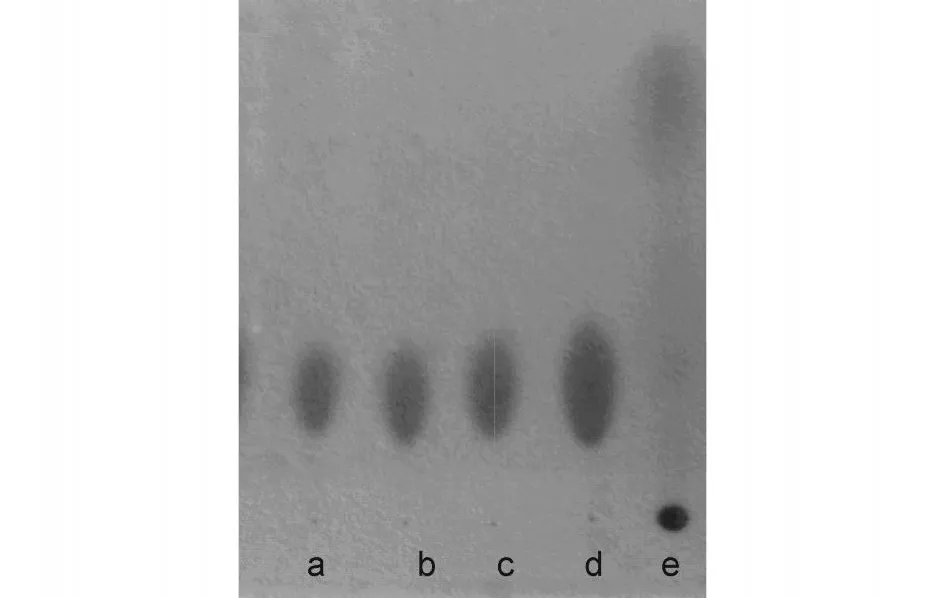
圖3 薄板層析的條帶圖譜Fig.3 Strips on Chromatography plate
2.3 賴氨酸單體連接方式的鑒定
通過ε-酰胺鍵連接成的ε-聚賴氨酸分子式見圖4。

圖4 ε-聚賴氨酸的分子結構Fig.4 The molecular structure ofε-PL
水楊醛保護ε-PL中游離的-NH2,經NaBH4還原后再水解得到兩種保護的賴氨酸,即Nα-鄰羥基苯甲基賴氨酸(圖5中以3代表)和 Nα,Nε-二鄰羥基苯甲基賴氨酸(圖5中以2代表)。由于第一步反應是可逆反應,反應體系中殘留部分ε-PL,再進一步水解成賴氨酸(圖5中以1代表)。若樣品為α-PL,用上述方法將生成1、3和Nε-鄰羥基苯甲基賴氨酸(圖5中以4代表),而2與 4的Rf值是不同的,據此來判斷酰胺鍵的連接方式。在圖5中,樣品的層析條帶中2與標準品的2有相同的Rf值,說明樣品為ε-PL。
通過化學法合成的聚賴氨酸一般為α型,而微生物合成的聚賴氨酸大多為ε型,至今尚未有化學法合成ε-PL的報道。
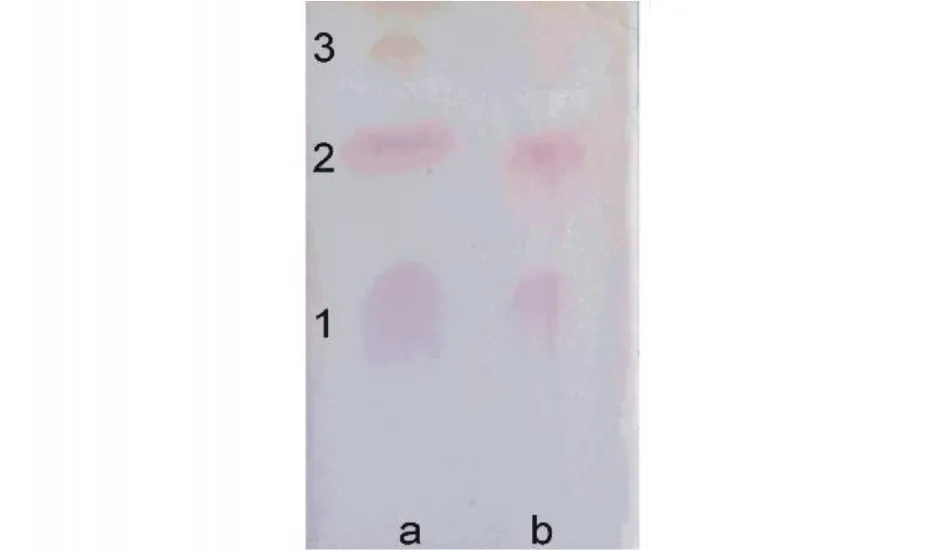
圖5 樣品酰胺鍵連接方式的測定結果Fig.5 The structure of poly-L-lysine produced by actinomyces
2.4 菌株的鑒定
在篩選獲得的諸多菌株中,編號L 5的初步搖瓶產量最高,達到0.8 g/L左右。
2.4.1 形態與培養特征 菌株L 5在無機鹽淀粉瓊脂培養基上生長良好,孢子絲在油鏡下觀察呈波曲狀或松柔旋,電鏡下孢子圓形至橢圓形,大小差別較大,其培養特征見表1。與白色鏈霉菌[9]、北里孢菌[10]、灰橙鏈霉菌[11]相比具有較大差異。
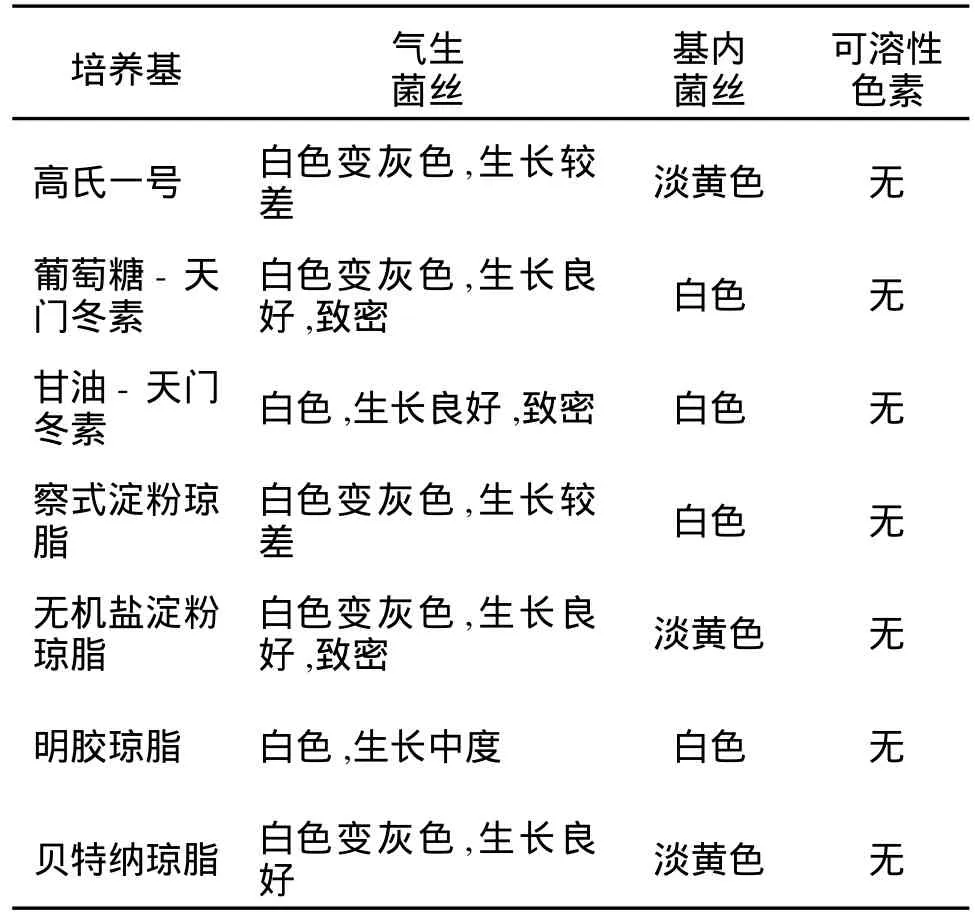
表1 L5菌株的培養特征Tab.1 Morphological characteristics of L5 on petri dishes
2.4.2 生理生化特征 L 5可以以多種物質為唯一碳源生長,如葡萄糖、蔗糖、甘油、半乳糖、果糖、甘露醇、麥芽糖、糊精、山梨醇等,不利用棉籽糖,木糖與肌醇利用可疑。能快速液化明膠、水解淀粉、使牛乳凝固且胨化,稍微利用纖維素,不產生 H2S,不產幾丁質酶,不產生黑色素。
綜合菌株L 5的培養特征與生理生化特性,對照《伯杰氏細菌系統鑒定手冊》,初步確定L 5屬于鏈霉菌屬,并且與多個種之間有較相近的表型。這幾個種為:稠李鏈霉菌Streptomyces padenus、微白鏈霉菌Streptomyces albidus、生白鏈霉菌Streptomyces albofaciens、白淺灰鏈霉菌Streptomyces albogriseolus。
2.4.3 16s rDNA分子鑒定 為了進一步對L 5的種屬進行鑒定,將提取出L 5菌株的DNA,進行了PCR擴增及16S rDNA測序實驗,最終獲得了該菌株的堿基序列,見圖6。通過將堿基序列與 Gen-Bank數據庫中相關同源序列進行對照,確定與L5菌株同源性最高的模式菌株。16s rDNA長度1 478 bp,其序列見圖6。
用DNAMAN軟件將菌株L5的16s rDNA堿基序列分別與稠李鏈霉菌、微白鏈霉菌、生白鏈霉菌、白淺灰鏈霉菌的16s rDNA堿基序列進行比對,計算其同源性。結果表明:菌株L5與白淺灰鏈霉菌Streptomyces albogriseolus的同源性為92.4%,與生白鏈霉菌Streptomyces albofaciens同源性為93.3%,與微白鏈霉菌Streptomyces albidus同源性為96.6%,與稠李鏈霉菌Streptomyces padenus的同源性為99.8%。由此可以基本確定菌株L 5的分類地位,即:菌株L 5屬于鏈霉菌屬,并且與稠李鏈霉菌具有極高的同源性,所以初步確定L 5為稠李鏈霉菌。

圖6 L5菌株16s rDNA的堿基序列Fig.6 The 16S rDNA sequence of strain L5
3 結 語
根據文獻[16]報道,重鉻酸鉀對真菌和細菌都有很顯著的抑制作用,而且在一定程度上還有促進放線菌的生長作用。但是實驗發現,重鉻酸鉀對細菌、霉菌、放線菌有幾乎同等程度的抑制作用,不能滿足篩菌的需求[17]。參考段杉等人的研究方法,采用了抗生素等復合抑制劑,達到了滿意的效果。但采用段杉的噴灑美蘭方法,那么本來相對失水的瓊脂會快速吸水,美蘭吸附在瓊脂表面,由于親和力較大而不易被排斥;若噴灑量過大,則溶液會在瓊脂表面流動,這樣就有可能使相鄰幾株菌的產物混溶在一起,產物被稀釋也不易形成透明圈,而且噴灑美蘭會對實驗環境造成污染,平板也不易洗干凈。作者對聚賴氨酸產生菌的篩選方法做了另一種改進,即把這種噴灑美蘭法改成了平鋪美蘭瓊脂法。這樣,菌落產生的物質可以擴散到下層排斥美蘭產生透明圈,從而避免了上述的問題。方便了檢測,段杉等人的研究中首創了一套簡易轉移裝置,可以使瓊脂塊中的產物轉移到分別蘸有Dragendorff試劑和茚三酮的濾紙上。但是,微生物在代謝過程中總要不可避免的要利用或合成一些氨基酸類物質,而與茚三酮顯色是氨基酸類物質普遍擁有的性質,所以上述的茚三酮濾紙檢測缺乏針對性。再者,即使是經過復篩挑選出的菌株也必須經過搖瓶發酵才能進行后續的層析和產量測定。所以,作者直接進行搖瓶發酵一次性進行后續的檢測。發酵液先與Dragendorff試劑和1 mmol/L的甲基橙進行雙重反應,兩者都呈陽性者進行下一步的層析,同時也測定了聚賴氨酸的質量濃度。因而,這種方法具有更強的實用性。
采用以上的篩選方法,作者所在實驗室在較短的時間內篩得了包括稠李鏈霉菌在內共42株ε-PL產生菌,證明了該篩選方法的靈敏性和實用性,而且該法還有較高的重復性,目前報道的ε-PL產生菌主要有白色鏈霉菌、北里孢菌和灰橙鏈霉菌3種,而稠李鏈霉菌則未見報道,其培養特征與生理生化特性與前3者也是明顯不同的。報道過的幾株ε-PL產生菌,其初始產量一般為0.2~0.4 g/L,其中北里孢菌的初始產量最高,為0.41 g/L,而稠李鏈霉菌的初始產量為0.8 g/L,若經過菌種改造和發酵工藝的優化,其生產潛力應該會得到更大的提升。
(References):
[1]Yoshizawa K,Takahashi K.Utilization of urease for decomposition of urea in sake[J].Brew Soc Japan,1988,83(2):142-144.
[2]Kakimoto S,Sumino Y.Purification and characterization of acidurease from Lactobacillus fermentum[J].Appl Microbiol Biotechnol, 1990,32:538-543.
[3]Weatherburn M W.Phenol-hypochlo rite reaction for determination of aminonia[J].Anal Chem,1967,39(8):971-974.
[4]Shoji Shima,Heiichi Sakai.Polylysine produced by streptomyces[J].Agric Biol Chem,1977,41(9):1807-1809.
[5]賈士儒,董惠均.ε-聚賴氨酸高產菌株的選育[J].食品與發酵工業,2004,30(11):14-17.
JIA Shi-ru,DONG Hui-jun.The selection and breeding ofε-polylysine high-producing strain[J].Food and Fermentation Industries,2004,30(11):14-17.(in Chinese)
[6]陳瑋瑋,朱宏陽,徐虹.ε-聚賴氨酸高產菌株選育及分批發酵的研究[J].工業微生物,2007,37(2):28-30.
CHEN Wei-wei,ZHU Hong-yang,XU Hong.Breeding of mass-p roducingε-polylysinemutant and its batch fermentation[J].Industrial M icrobiology,2007,37(2):28-30.(in Chinese)
[7]Masanobu Nishikawa,Kenichi Ogawa.Distribution of microbes producing antimicrobialε-poly-L-Lysine in soil polymers microflora determined by a novel method[J].Applied and Environmental Microbiology,2002,68(7):3575-3581.
[8]朱宏陽,徐虹,吳 群,等.ε-聚賴氨酸生產菌株的篩選和鑒定[J].微生物學通報,2005,32(5):127-130.
ZHU Hong-yang,XU Hong,WU Qun.Screening and Identification ofε-PL producing strain[J].Microbiology,2005,32(5):127-130.(in Chinese)
[9]張超,張東榮,賀魏,等.一種簡便的ε-聚賴氨酸生產菌的篩選方法[J].山東大學學報,2006,44(11):1104-1107.
ZHANG Chao,ZHANG Dong-rong,HE Wei,et al.A simple and sensitive method for screeningε-PL producing strains from soils[J].Journal of Shandong University,2006,44(11):1104-1107.(in Chinese)
[10]段杉,朱偉珊.ε-聚賴氨酸產生菌的篩選[J].食品與發酵工業,2007,33(8):14-17.
DUAN Shan,ZHU Wei-shan.Isolating of aε-polylysine-producing strain[J].Food and Fermentation Industries,2007 33(8):14-17.(in Chinese)
[11]Ruth F Itzhaki.Colorimetric method for estimating poly-lysine and polyarginine[J].Analytical Biochemistry,1972,50:569-574.
[12]陳旭升,李樹,張超,等.微生物合成ε-聚賴氨酸的結構鑒定及其抑菌活性的研究[J].食品與發酵工業,2008,34(9):54-57.
[13]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001.
[14]布坎南R E,吉本斯N E.伯杰氏細菌系統鑒定手冊(第九版)[M].北京:北京科學出版社,1984.
[15]薩姆布魯克J,拉塞爾D w著.分子克隆實驗指南[M].黃培堂譯.北京:科學出版社,2002.
[16]楊字容,徐麗華,李啟任,等.放線菌分離方法的研究抑制劑的選擇[J].微生物學通報,1995,22(2):88-93.
YANG Yu-rong,XU Li-hua,LI Qi-ren,et al.A study on isolation methods of actionmycetes[J].Microbiology,1995,22(2):88-93.(in Chinese)
[17]司美茹,薛泉宏.放線菌分離培養基篩選及雜菌抑制放法研究[J].微生物學通報,2004,31(2):61-64.
SI Mei-ru,XUE Quan-hong,LAI Hang-xian.Studies on Selection of the isolation medium fo rActinomycetesand inhabition methods to miscellaneous microorganism[J].Microbiology,2004,31(2):61-64.(in Chinese)
A Protocol for Screening ofε-Polylysine Producing Strains
LI Shu1,2, CHEN Xu-sheng1,2, LIAO Li-juan1,2,ZHANG Jian-hua1,2, MAO Zhong-gui*1,2
(1.Key Labo ratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
A novelε-polylysine produce strain screen protocol was developed in this study based on the chemical characteristics ofε-polylysine.Through this three-steps protocol,42 strains has been identified as lysine polymer producer,then those polymer structure were analysized by chemical method,by which confirm s that the polymer is linked byε-NH2andα-COOH.Among of them,one strain,0.8 g/Lε-polylysine was found in fermentation broth,w as identified asStrep tomycespadanusby the combination results of physiological and biochemical characteristics,and 16s rDNA sequence.
ε-polylysine,screening,strain identification,16s rDNA
TQ 920.1
A
1673-1689(2010)02-0282-06
2009-04-01
國家863計劃項目(2006AA 020301)。
*
毛忠貴 (1954-),男,江蘇溧水人,教授,博士生導師,主要從事清潔生產、功能性物質開發及纖維資源高值轉化方面的研究。Email:maozg@vip.163.com。。
(責任編輯:李春麗)

