微波處理對鈣質土壤放線菌分離效果的影響
薛 清,段春梅,王玲娜,林雁冰*
(1.西北農林科技大學植物保護學院,陜西楊凌 712100;2.西北農林科技大學資源環境學院,陜西楊凌 712100 3.西北農林科技大學生命科學學院,陜西楊凌 712100;)
放線菌是一類產生豐富生物活性物質的重要微生物資源。放線菌是新的生物活性物質的主要產生菌,放線菌資源研究對抗生素工業發展有重要影響。今天隨著放線菌生物多樣性研究的進展,放線菌仍然具有產生新的生物活性物質的極大潛力[1]。研究資料顯示,目前已分離出的放線菌僅占其自然界存在總量的10%~20%,大多數放線菌由于多種原因不能在人工培養基上生長。要分離到更多的新放線菌類群,需要探索新的分離方法。目前,國內外在放線菌分離方法研究方面已經取得了較大的進展[2-8],研究發現,采用多種物理、化學刺激以及改變培養基成分等措施[9-12],能有效提高稀有放線菌的出菌率,并分離出放線菌的新種屬[13-15]。微波是一種振蕩頻率為每秒24.5億次高頻電磁波。微波的加熱與殺菌作用已有大量研究,微波對生物體可以產生熱效應、電效應、磁效應及化學效應等,從而引起生物細胞多種生理生化變化或致死效應[16]。從物理學和生物學原理推知,低強度微波輻射有可能消除抑制放線菌孢子萌發的某些制約因素,使部分不可培養放線菌的孢子萌發,增加可培養放線菌的種類與數量。楊斌等[17]研究了微波處理不同有機質含量沙質土壤引起的放線菌數量變化,發現微波處理可以顯著增加放線菌的出菌率和拮抗性放線菌比例,但對鈣質土壤及培養基加鈣后微波的處理效應尚不清楚。本文重點探索中強度微波預處理對鈣質土壤和培養基加CaCl2后土壤放線菌數量的影響,旨在為改善放線菌分離效果的微波預處理技術研究提供新的科學依據。
1 材料與方法
1.1 材料
1.1.1 土壤樣品 供試土壤為栗鈣土,碳酸鈣含量為29.7~40.7 g/kg,采自內蒙古自治區太仆寺旗寶昌鎮永勝村西芹田。其中,1~3號土樣為風干土樣,4號土樣為4℃冰箱保存的濕土樣。土壤pH用DELTA 320pH計測定,有機質用重鉻酸鉀氧化-外加熱法測定,碳酸鈣用鹽酸氣量法測定[18]。土壤化學性質見表1。
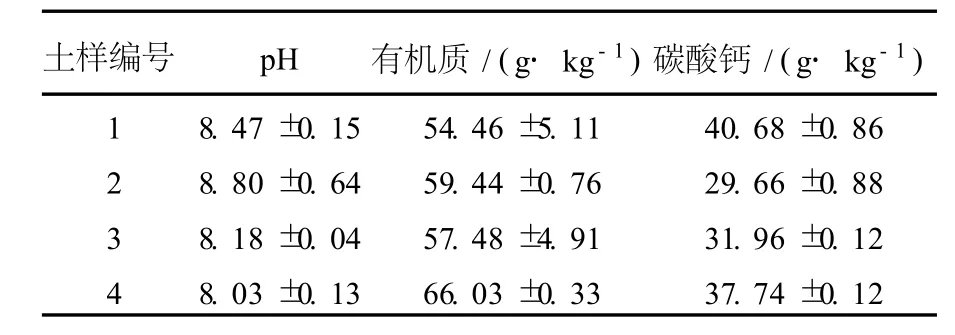
表1 供試土壤化學性質Table 1 The chemical properties of the soil tested
1.1.2 培養基 放線菌分離培養基:高氏1號培養基(GA)[19];高氏1號加鈣培養基(GA-Ca),即高氏1號培養基加入5 g/L的CaCl2;腐植酸瓊脂培養基HA[20]。以上培養基均在滅菌后加入滅菌的濃度為8 g/L的K2Cr2O7至80μg/mL。
1.2 方法
1.2.1 試驗方案 試驗設2個處理:對照土樣(CK):不進行微波輻照;微波處理(Microwave Irradiation,M I):120W功率模式下微波輻照3 min。1.2.2 土壤預處理 1~3號土樣在自然狀態下風干;4號土樣為濕土,4℃冰箱保藏。試驗前將1~3號風干稱5.0 g碾磨至細粉的土樣,加95 mL無菌水制成懸液;4號濕土樣直接稱5.0 g加95 mL無菌水制成懸液,同時測定土壤含水量,用于計算干土含菌量。微波處理:稱取磨細的1~3號干土和4號濕土各5.0 g置于10 mL塑料離心管中,加入3 mL無菌水濕潤(使土壤能夠吸收微波);離心管放置于裝有500 mL、24℃自來水的水浴中(避免待處理土壤樣品因溫度升高產生溫度效應),將放置土壤樣品的水浴置于微波爐內,以功率120 W模式處理3 min,再用滅菌針管吸取無菌水沖洗土樣,轉入裝有92 mL無菌水的三角瓶中,震蕩15 min分離測數。
1.2.3 放線菌分離計數及初步鑒定 將處理好的土壤懸液用10倍稀釋法稀釋,充分混勻后分別吸取0.1 mL滴加于GA、GA-Ca及HA平板上,重復3次。涂布均勻后在28℃下倒置培養10 d,計數,并據菌落形態特征將具有鏈霉菌和小單孢菌菌落特征的放線菌暫定為“鏈霉菌屬”和“小單孢菌屬”,其余放線菌皆歸入“未鑒定屬”。同時挑取放線菌單菌落于高氏1號斜面中培養保存。
1.2.4 數據處理與結果計算 微波處理土壤放線菌數量與對照的相對差異用微波效應EM I表示,計算公式如下:
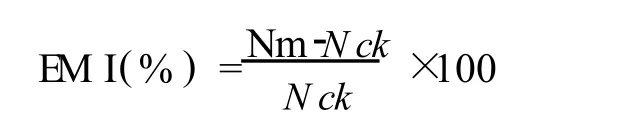
式中Nm、Nck及EM I分別為微波處理、對照CK的放線菌數量及微波效應。
試驗結果顯著性分析采用DPS 9.50數據處理系統(T-檢驗)。
2 結果與分析
2.1 微波對放線菌數量的影響
2.1.1 GA培養基 從表2可以看出,就GA培養基而言,微波處理能夠提高放線菌出菌率。其中,供試土樣放線菌總數較對照增加99.5%~234.1%,均達到極顯著水平(P<0.01);鏈霉菌較對照增加58.3%~377.7%,除3號土樣外均達到極顯著水平;對小單孢菌而言,1~3號干土增加94.7%~651.4%,其中2、3號土樣微波處理與對照的差異達到顯著水平(P<0.05),4號濕土較對照減少4.4%,與對照差異不顯著;未鑒定屬放線菌較對照增加96.7%~304.8%,均達到顯著(P<0.05)或極顯著水平(P<0.01)。
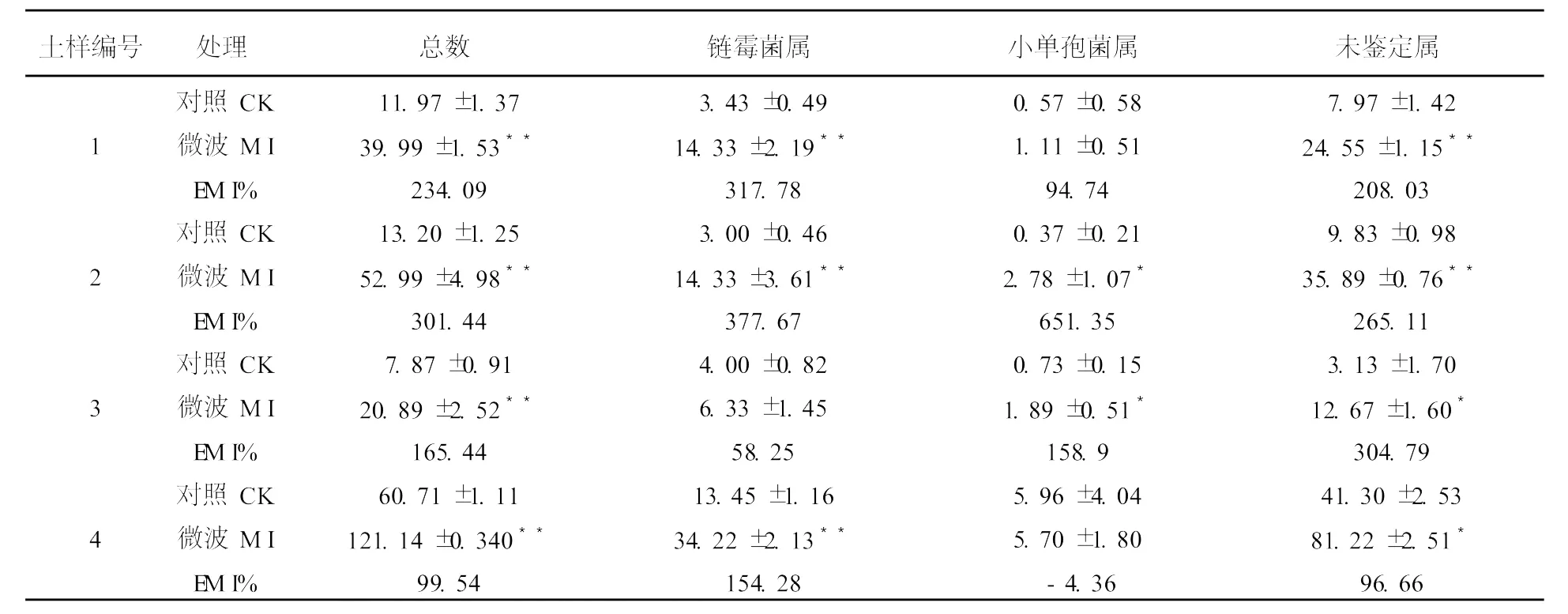
表2 微波處理后高氏1號培養基上放線菌的分離數量(105cfu/g)Table 2 The quantity of actinomycetes isolated from the medium of GA aftermicrowave irradiation(105cfu/g)
2.1.2 GA-Ca培養基 微波處理后GA-Ca培養基上放線菌出菌率也有不同程度增加,見表3。其中放線菌總數較對照增加8.8%~180.6%,均達到極顯著(P<0.01)或顯著水平(P<0.05);鏈霉菌總數較對照增加17.7%~151.3%,其中2號和3號土樣達到極顯著水平(P<0.01);小單孢菌增加2.3%~420.0%,其中2號和3號土樣達到顯著水平(P<0.05);未鑒定屬增加8.8%~234.5%,除4號土外,其余土壤樣品均達顯著(P<0.05)或極顯著水平(P<0.01)。
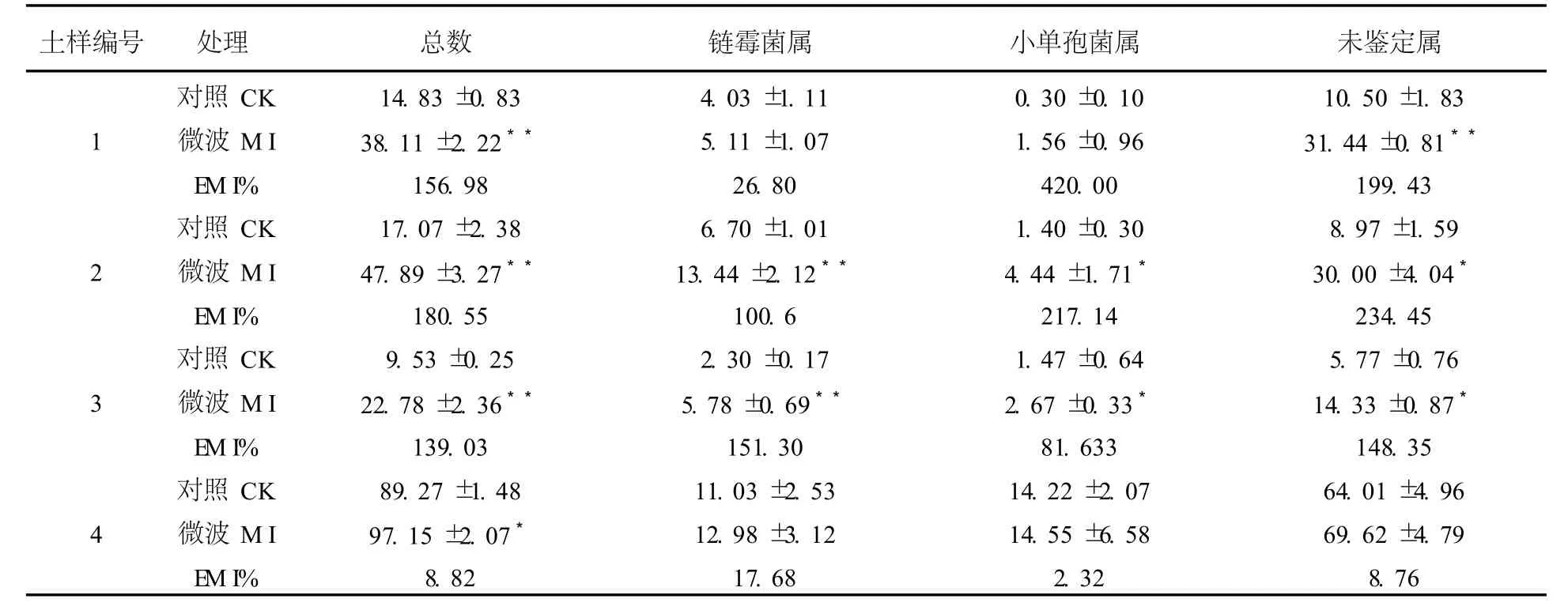
表3 微波處理后GA-Ca培養基上的放線菌數量(105cfu/g)Table 3 The quantity of actinomycetes isolated from the medium of GA-Ca aftermicrowave irradiation(105cfu/g)
2.1.3 HA培養基 HA培養基為鏈霉菌的選擇性培養基。微波處理后,HA培養基上鏈霉菌分離數量增加顯著,見表4。4種土樣較對照增長79.0%~126.0%,均達到極顯著水平(P<0.01)。說明微波處理能夠顯著增加HA培養基上鏈霉菌的數量。
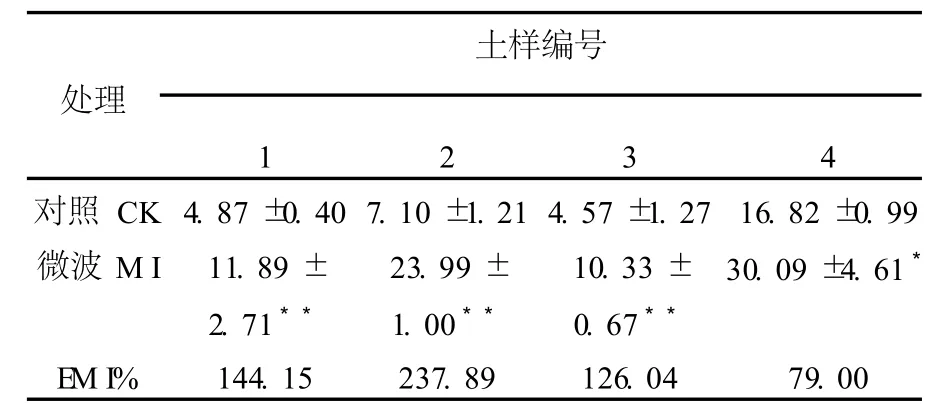
表4 微波處理后腐植酸培養基上鏈霉菌分離數量(105cfu/g)Table 4 The quantity ofStreptomycetesisolated from the medium of HA aftermicrowave irradiation(105cfu/g)
由以上分析可看出,采用低強度微波對土壤進行預處理可以增加放線菌的出菌率,大多數土樣的處理效應達到顯著或極顯著水平,在3種培養基上的結果表現出基本相同的趨勢。
2.2 不同培養基上的微波效應
從圖1可以看出,在不同培養基上EM I不同,其變化呈現出基本相同的趨勢:對放線菌總數、未鑒定屬放線菌及2號和3號土樣的小單孢菌數量而言,EM I均表現為GA>GA-Ca;對鏈霉菌數量表現為GA>HA>GA-Ca。微波處理后,GA培養基上放線菌總數的EM I最大,GA上4個土樣處理后的EM I分別較GA-Ca培養基上處理后提高77.1%、120.9%、26.4%及90.7%;GA培養基上1、2、4號土壤鏈霉菌數量的EM I分別較HA培養基上鏈霉菌數量的EM I提高173.6%、139.8%、75.3%,即培養基成分影響微波效應。
2.3 土樣含水量對微波效應的影響
從圖1中1~3號干土與4號濕土(含水量415 g/kg)的微波增率對比可以看出,微波處理后濕土中放線菌總數、未鑒定放線菌數量的EM I均小于1~3號干土,其中4號土GA上放線菌總數的EM I較1~3號土樣分別減少134.6%、201.9%、65.9%;在GA-Ca培養基上放線菌總數的EM I分別減少148.16%、171.7%、130.2%;除3號土的在GA培養基上的測值外,1~3號土壤在GA、GA-Ca培養基上鏈霉菌數量的EM I也符合濕土小于干土的趨勢;在HA培養基上,1、2、3號土壤鏈霉菌數量的EM I分別減少65.2%、158.9%、47.0%,即冰箱4℃保藏的含水量較高的新鮮土樣的EM I應低于風干土壤,其原因尚不清楚。
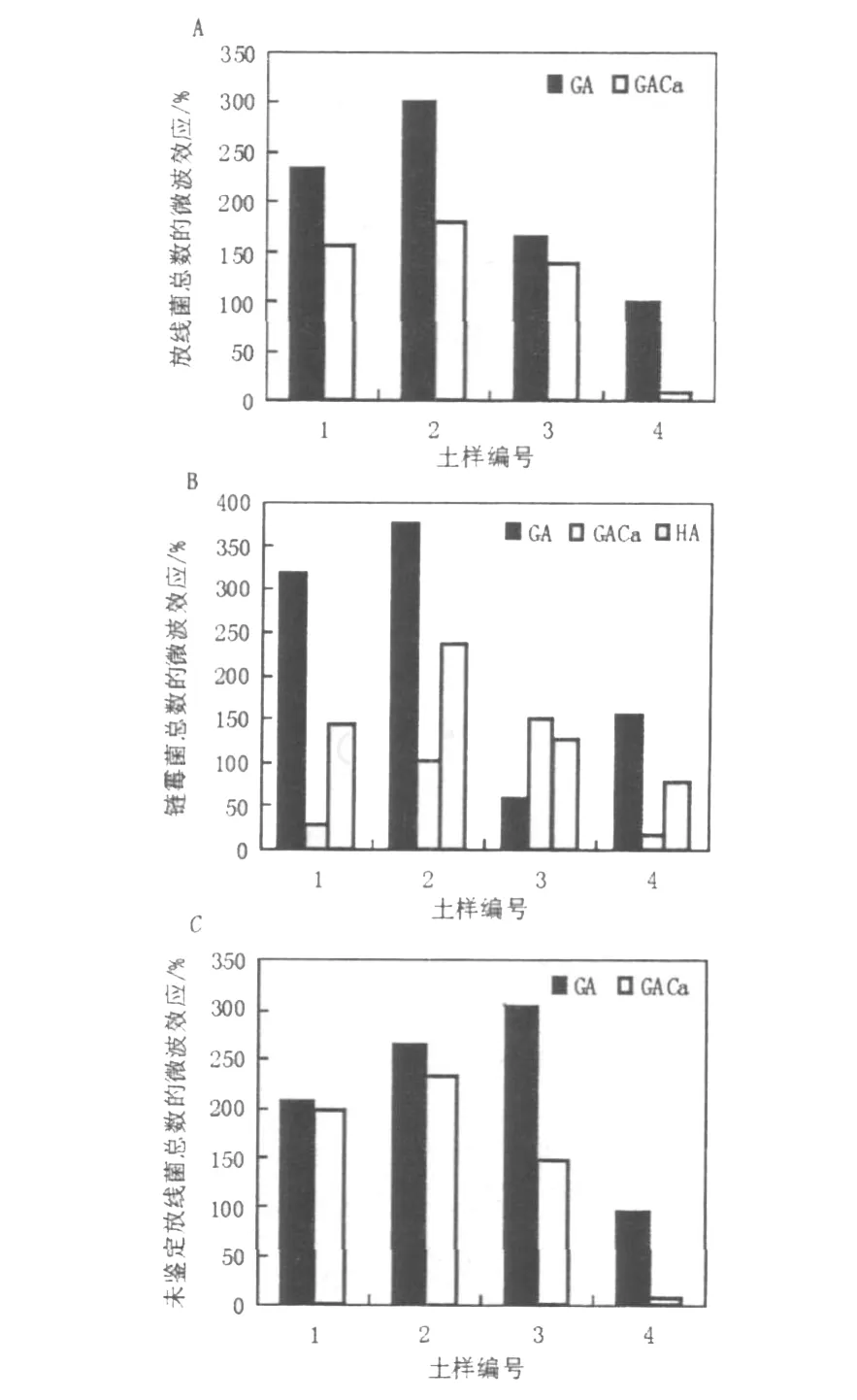
圖1 供試土壤不同培養基上微波處理后放線菌數的微波效應Fig.1 The EM Iof the quantity of the actinomycetes on the differentmedia in the tested soil aftermicrowave irradiation
3 討 論
為了分離到更多的新放線菌種類,很多學者不斷對放線菌分離方法進行探索,研究工作主要集中在樣品預處理、抑制劑選擇以及改變培養基成分等方面。樣品預處理包括物理方法處理與化學方法處理。化學方法主要是通過添加適當濃度的某種化學抑制劑,抑制鏈霉菌的生長,或者加入孢子激活劑,促進孢子萌發,從而選擇性地分離出稀有放線菌。如姜怡等[9]向土壤懸液加入6%的酵母膏和0.05%的十二烷基磺酸鈉混合液,在40℃處理20 min,能有效地分離到小單孢菌屬、鏈孢囊菌屬、馬杜拉菌屬及小雙孢菌屬等稀有放線菌。物理方法主要有干熱預處理[21]、超聲波振蕩、土壤懸液差速離心法以及極高頻輻射法等[9]。Li等[10]使用1 kHz以上的極高頻射線(EHF)對土壤懸液進行照射,發現在波長8~11.5 mm時,各稀有放線菌總數較對照提高了7.5倍。Li等[11]使用連續照射與極高頻輻射結合的方法,發現在波長為4.6~5.8 mm及8~11.5 mm時,放線菌總數與稀有放線菌的種類及數量大幅度提高。Likhacheva等[12]用超高頻輻射法(SHF)對幾種鏈霉菌孢子懸液進行不同時間的預處理,發現不同處理時間鏈霉菌的生物量以及活性均受到不同程度的影響。微波是一種高頻電磁波,利用微波殺菌已有大量研究及應用。但用微波處理改善放線菌分離效果研究很少,國外僅有Bulina等[2]將其應用于放線菌分離的初步研究報道,該研究發現,小功率、短時間微波處理對放線菌分離效果有一定影響,使用80 W微波對土壤懸液處理30 s時能有效提高小單孢菌屬、小多孢菌屬、諾卡氏菌屬及馬杜拉菌屬等稀有放線菌的比率。楊斌等[17]研究了微波處理時間對不同有機質含量沙質土壤放線菌分離效果的影響,發現微波處理后高有機質土壤放線菌總數、鏈霉菌數以及小單孢菌數較對照有一定程度的增加,120 W中等強度、3 min條件下處理效果最好。本試驗研究了該條件下微波處理鈣質土壤對放線菌分離效果的影響,發現微波處理后絕大部分供試鈣質土壤在GA、GA-Ca及HA 3種培養基上的放線菌總數、鏈霉菌數、小單孢菌及未鑒定放線菌數量均有明顯增加,與楊斌等微波處理不同有機質含量沙質土壤時得到的結果[17]一致,表明微波處理土壤對放線菌分離時出菌量的提高效果具有較為廣泛的一致性。
另外,本研究探討了微波處理對鈣質土壤放線菌在不同培養基上分離效果的影響,發現加鈣培養基(GA-Ca)上的微波效應(EM I)小于高氏1號培養基(GA),該結果說明加鈣也能提高放線菌的出菌率。鑒于在現有分離方法和條件下,土壤中可培養放線菌的數量是一定的,如果加鈣激活一部分孢子,剩余的待微波激活的孢子量就會減少,導致在加鈣培養基GA-Ca上的EM I小于高氏1號,該推論尚待進一步證實。
在本研究中,將待處理土壤樣品置于裝水量500 mL、24℃的水浴中,消除了微波處理期間加熱引起樣品溫度升高產生的熱效應,故本研究中微波處理對放線菌出菌率的影響主要來自微波高頻電磁波的生物效應。初步推斷,微波對放線菌出菌率的增加可能與放線菌孢子的通透性改變有關。短時間微波處理濕土可能改變細胞膜的通透性,影響水分和養分進入孢子,促進部分難萌發孢子萌發,增加出菌量,本研究中風干土樣的微波處理效應大于濕土樣的結果也支持微波處理影響孢子膜透性的推斷。但上述推論及微波增加放線菌出菌量的詳細機理尚待進一步研究證實。
[1] 劉志恒.放線菌—微生物藥物的重要資源[J].微生物學通報,2005,32(6):143-145.
[2] Bulina T I,Alferova IV,Terekhova L P.A novel approach to isolation of actinomycetes involving irradiation of soil samples with microwaves[J].Microbiology,1997,66(2):231-234.
[3] Hayakawa M,Sadakata T,Kajiura T,et al.New methods for the highly selective isolation of micromonospora and microbispora from soil[J].Journal of Fer mentation and Bioengineering,1991,72(5):320-326.
[4] Hayakawa M,Kajiura T,Nonomura H.New methods for the highly selective isolation of streptosporangium and dactylosporangium from soil[J].Journal of Fermentation and Bioengineering,1991,72(5):327-333.
[5] Hayakawa M,Tamura T,Nonomura H.Selective isolation of actinoplanes and dactylosporangium from soil by usingγ-collidine as the chemoattractant[J].Journal of Fermentation and Bioengineering,1991,72(6):426-432.
[6] HayakawaM,Tamura T,Iino H,et al.Pollen-baiting and drying method for the highly selective isolation of actinoplanes spp.from soil[J].Journal of Fermentation and Bioengineering,1991,72(6):433-438.
[7] HayakawaM,Momose Y,Kajiura T,et al.A selective isolation method for Actinomadura viridis in soil[J].Journalof Fermentation and Bioengineering,1995,79(3):287-289.
[8] Hendricks CW,Pascoe N.Soilmicrobial biomass estimates using 2450MHz microwave irradiation[J].Plant and Soil,1988,110(1):39-47.
[9] 姜怡,段淑蓉,唐蜀昆,等.稀有放線菌分離方法[J].微生物學通報,2006,33(1):181-183.
[10] Li YV,Terekhova L P,GapochkaM G.Isolation of actinomycetes from soil using extremely high frequency radiation[J].Microbiology,2002,71(1):105-108.
[11] Li YV,Terekhova L P,Alferova IV,et al.The application of succession analysis in combination with EHF irradiation to the selective isolation of actinomycetes from soil[J].Microbiology,2003,72(1):114-117.
[12] Likhacheva A A,Komarova A S,Luk yanov A A,et al.The Influence of SHF radiation on soil streptomycetes[J].Eurasian Soil Science,2006,39(8):854-858.
[13] 肖煒,李銘剛,崔曉龍,等.幾種選擇性分離稀有放線菌的方法[J].微生物學通報,2006,33(1):133-137.
[14] 楊宇容,徐麗華,段若玲,等.稀有放線菌分離方法的研究[J].云南大學學報(自然科學版),1997,19(4):403-408.
[15] 張學武,張建麗.稀有放線菌的選擇性分離[J].生命科學儀器,2005,3(6):17-20.
[16] 吳道澄,金友煌,席曉莉,等.高功率微波對金黃葡萄球菌殺滅效應的實驗研究[J].中國醫學物理學雜志,1999,16(3):183-186.
[17] 楊斌,薛泉宏,陳占全,等.微波處理對土壤放線菌分離效果的影響[J].應用生態學報,2008,19(5):1091-1098.
[18] 鮑士旦.土壤農化分析[M].北京:中國農業出版社,2000.
[19] 程麗娟,薛泉宏.微生物學實驗技術[M].西安:世界圖書出版公司,2000.
[20] 林超峰,陳占全,薛泉宏,等.青海三江源地區風沙土養分及微生物區系[J].應用生態學報,2007,18(1):101-106.
[21] 司美茹,薛泉宏,來航線.放線菌分離培養基篩選及雜菌抑制方法研究[J].微生物學通報,2004,31(2):61-65.

