毛建草組織培養再生體系的建立


摘要:本研究以毛建草(Dracocephalum rupestre Hance)葉片為外植體,研究不同消毒處理和不同植物生長激素配比對葉片愈傷組織誘導、不定芽分化、增殖、生根的影響。結果表明:葉片最佳的消毒方式為75%乙醇浸泡30 s后,用0.1% HgCl2消毒4 min,污染率最低為11.11%;誘導愈傷組織的最佳培養基為MS(Murashige and Skoog)基本培養基+1.0 mg·L-16-芐氨基腺嘌呤(6-Benzylaminopurine,6-BA)+0.1 mg·L-1吲哚乙酸(Indole acetic acid,IAA)+1.0 mg·L-12,4-二氯苯氧乙酸(2,4-Dichlorophenoxyacetic acid,2,4-D),誘導率達84.51%;愈傷組織分化的最佳培養基為MS+3 mg·L-16-BA+0.50 mg·L-1噻苯隆(Thidiazuron,TDZ)+0.50 mg·L-1IAA,不定芽分化率為66.37%;不定芽增殖最佳培養基為MS+2.0 mg·L-16-BA +0.05 mg·L-1萘乙酸(Naphthylacetic acid,NAA),增殖率為83.57%;適宜生根的培養基為1/2MS基本培養基(1/2MS)+0.1 mg·L-1NAA+0.1 mg·L-1吲哚丁酸(Beta-indolebutyric acid,IBA),生根率為86.97%。本研究建立了毛建草葉片離體培養與再生體系,為其種質資源的保存和組培快繁提供理論與技術支持。
關鍵詞:愈傷;不定芽;增殖;生根
中圖分類號:Q813.1""" 文獻標識碼:A"""" 文章編號:1007-0435(2024)08-2523-08
Establishing Tissue Culture and Regeneration System of
Dracocephalum rupestre
YUE Kang-jie, KANG Hong-wei, LIU Hui-xin, WANG Jia-li, TIAN Xu-ping*
(College of Forestry, Shanxi Agricultural University, Taigu, Shanxi Province 030801, China)
Abstract:Using leaves of Dracocephalum rupestre as explants,in this study we explored the effects of different sterialization methods and varying combinations of plant growth hormones on the initiation of callus,development of adventitious buds,cell proliferation,and root formation on the leaf explants. The results indicated that the most effective sterialization approach for the leaves involved a 30-second immersion in 75% ethanol,followed by 4-minute treatment with 0.1% HgCl2,which resulting in a remarkably low contamination rate of 11.11%. The optimal culture medium for callus initiation consisted of Murashige and Skoog (MS)+1.0 mg·L-16-Benzylaminopurine (6-BA)+0.1 mg·L-1Indole acetic acid (IAA)+1.0 mg·L-12,4-Dichlorophenoxyacetic acid (2,4-D),achieving an induction rate of 84.51%. For callus differentiation,the best medium was MS+3 mg·L-16-BA+0.50 mg·L-1Thidiazuron (TDZ)+0.50 mg·L-1IAA,with an adventitious bud differentiation rate of 66.37%. The medium promoting shoot proliferation was MS+2.0 mg·L-16-BA+0.05 mg·L-1NAA,resulting in a proliferation rate of 83.57%. The suitable rooting medium was 1/2MS+0.1 mg·L-1Naphthylacetic acid (NAA)+0.1 mg·L-1Beta-indolebutyric acid (IBA),with a rooting rate of 86.97%. The study established an in vitro culture and regeneration system for the leaf explants of Dracocephalum rupestre,providing a theoretical and technical support for the conservation of its germplasm resources and tissue culture propagation.
Key words:Callus;Adventitious buds;Proliferation;Rooting
毛建草(Dracocephalum rupestre Hance)為唇形科多年生草本,主要分布于華北、西北及遼寧等海拔650 m~2400 m(青海省達3 100 m)的高山草原、草坡或疏林下向陽處[1]。該植物可全草入藥,在清熱解毒、治療風濕頭痛、延緩衰老等方面有一定作用[2]。在山西、河北、遼寧及青海等地有把毛建草制作成茶葉的習俗。在山西,毛建草茶是一個重要的藥茶產業,但是目前,資源產量成為制約產業規模的一個關鍵因素。因此,對毛建草種苗的繁育技術亟待研究。
在自然環境中,毛建草主要通過種子繁殖,在栽培中常用種子育苗、分株[3]及珠芽繁殖[4],然而,這些繁殖方式局限和影響了良種的快速繁育。因此,近年來對毛建草組織快繁的研究逐漸增多,劉俊等[5]以毛建草帶腋芽的莖段為外植體建立無菌體系,發現適宜莖段的消毒方法是用75%乙醇浸泡30 s,后用HgCl2消毒7 min,適宜腋芽誘導的培養基是MS(Murashige and Skoog)培養基+0.5 mg·L-16-芐氨基腺嘌呤(6-Benzylaminopurine,6-BA)+0.1 mg·L-1萘乙酸(Naphthylacetic acid,NAA)+0.2 mg·L-1吲哚乙酸(Indole acetic acid,IAA),芽增殖培養基是MS+0.75 mg·L-16-BA+4.0 mg·L-1激動素(Kinetin,KT)+0.01 mg·L-1NAA+0.2 mg·L-1赤霉素(Gibberellin,GA3),不定根誘導培養基是MS+0.2 mg·L-1NAA。李倩[6]發現適宜毛建草種子萌發的培養基是MS+0.5 mg·L-1NAA和MS+0.5 mg·L-1吲哚丁酸(Beta-indolebutyric acid,IBA)。宗越[7]以毛建草莖段和葉片為外植體誘導愈傷,發現適宜葉片消毒的方法是用75%乙醇浸泡30 s,后用HgCl2消毒7 min,誘導愈傷組織的培養基是MS+0.5 mg·L-16-BA+0.5 mg·L-1NAA。桑曉霞[8]發現MS培養基適宜莖段愈傷組織誘導,培養基是MS+0.5 mg·L-16-BA +0.5 mg·L-1NAA,與宗越[6]研究一致。
以上研究中,毛建草愈傷組織僅分化出不定根[6-8],分化不定芽的研究未見報道。因此,本研究以毛建草葉片為材料,探討激素對愈傷組織誘導、不定芽分化、芽增殖及生根培養的影響,為毛建草種質資源保存及組織培養快繁提供一定的技術支撐。
1 材料與方法
1.1 試驗材料
試驗材料取自山西農業大學林業站的毛建草葉片。試驗內所用的MS和1/2MS培養基內均添加蔗糖30 g·L-1、瓊脂7 g·L-1,pH值調為5.8~6.0。培養室溫度為(25±1)℃,光照強度為3000 Lux,光周期16 h·d-1。
1.2 試驗方法
1.2.1 外植體消毒 在4—5月晴天上午采集毛建草花枝頂端幼嫩葉片,清水洗掉葉片表面灰塵,先用含有洗潔精的水溶液浸泡15 min,用流水沖洗30 min,然后置于超凈工作臺進行下一步的表面消毒。用75%乙醇浸泡30 s后,接著用無菌水清洗3次,再用0.1% HgCl2分別浸泡消毒2 min,3 min,4 min和5 min,最后用無菌水沖洗5~6次。將消毒后的葉片切割成0.5 cm2左右,葉面朝上接入MS培養基中,每個處理接種20個葉片,重復3次。10 d后統計葉片褐化率、污染率和成活率。
1.2.2 葉片愈傷組織的誘導 在MS培養基中添加6-BA(0.5 mg·L-1,1.0 mg·L-1和2.0 mg·L-1),2,4-D(0 mg·L-1,0.1 mg·L-1,0.5 mg·L-1和1.0 mg·L-1)和IAA(0 mg·L-1,0.1 mg·L-1,0.5 mg·L-1和1.0 mg·L-1)組合,每個處理接種20個葉片,3次重復。30 d后統計愈傷組織誘導率及生長狀態。
1.2.3 愈傷組織分化 在MS培養基中添加6-BA(1 mg·L-1,2 mg·L-1和3 mg·L-1)、TDZ(0.5 mg·L-1,1.0 mg·L-1和2.0 mg·L-1)與IAA,NAA各(0.05 mg·L-1,0.50 mg·L-1和1.00 mg·L-1)組合。每個處理接種20塊愈傷組織,重復3次。30 d后統計愈傷組織不定芽、不定根分化率以及平均再生芽數。
1.2.4 不定芽增殖培養 在MS培養基中分別添加6-BA(0.5 mg·L-1,1.0 mg·L-1和2.0 mg·L-1)與NAA(0.01 mg·L-1,0.05 mg·L-1和0.10 mg·L-1)組合。每個處理接種15個不定芽,重復3次。30 d后統計不定芽的增殖情況,計算增殖率、增殖系數及株高。
1.2.5 不定芽生根誘導 在1/2MS培養基中分別添加NAA(0 mg·L-1,0.1 mg·L-1,0.5 mg·L-1和1.0 mg·L-1)和IBA(0 mg·L-1,0.1 mg·L-1,0.5 mg·L-1和1.0 mg·L-1)組合。每個處理接種15個芽苗,重復3次。30 d后觀察芽的生根情況,統計生根率、平均根數、平均根長及株高。
1.3 數據統計與分析方法
褐化率/%=褐化數/接種數×100%;污染率/%=污染數/接種數×100%;成活率/%=(接種數-褐化數-污染數)/接種數×100%;愈傷組織誘導率/%=有愈傷的外植體數/接種數×100%;分化率/%=分化的愈傷數/接種數×100%;平均再生芽數/個=再生不定芽總數/再生外植體總數;芽增殖率/%=有增殖的芽數/接種數×100%;苗成活率/%=成活的苗數/接種數×100%;生根率/%=生根的苗數/成活的苗數×100%。
采用SPSS 23.0統計軟件進行方差分析和顯著性分析,采用Excel 2016統計數據和制作圖表,數據均為 3次重復試驗的平均值。
2 結果與分析
2.1 HgCl2消毒時間的比較
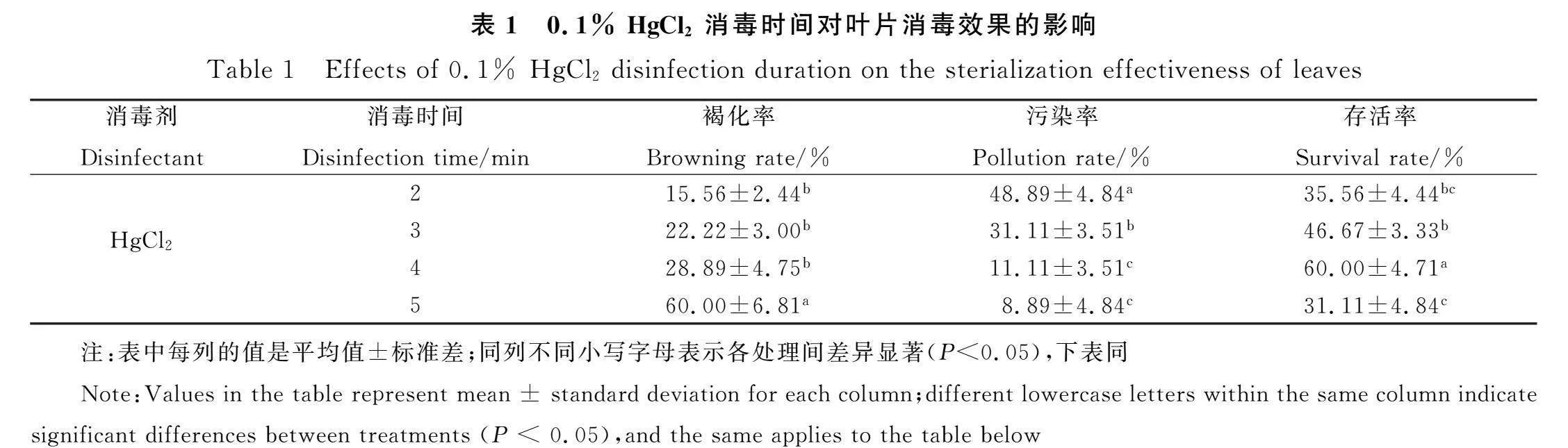
由表1可知,外植體褐化率隨消毒時間延長而增加,褐化率在15.56%~60.00%之間;污染率隨消毒時間延長而降低,成活率隨消毒時間延長呈先升高后降低的趨勢。當0.1% HgCl2消毒5 min時,污染率最低為8.89%,但褐化率達到60.00%,顯著高于其他處理(Plt;0.05)。0.1% HgCl2消毒4 min時,存活率最高為60.00%,與其他處理時間差異顯著(Plt;0.05)。葉片最好的消毒方法是75%乙醇浸泡30 s,后用0.1% HgCl2消毒4 min。
2.2 葉片愈傷組織誘導的最佳培養基
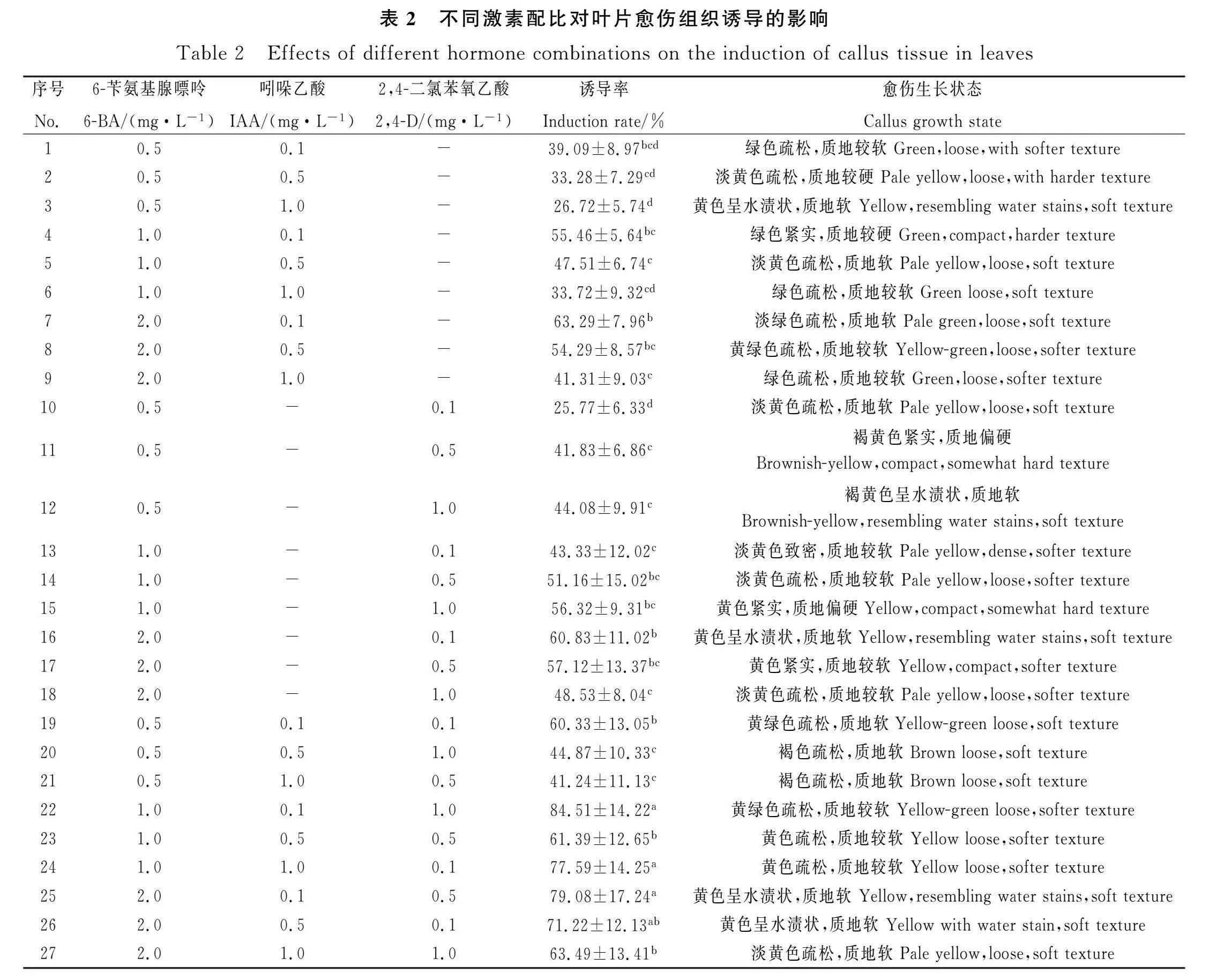
葉片在接種后的第6 d開始膨大卷曲(圖1),由表2可知,葉片在含有不同激素配比的培養基中愈傷組織誘導率在25.77%~84.51%之間。當6-BA濃度相同時,愈傷組織誘導率隨IAA濃度增加逐漸下降。當6-BA濃度在2.0 mg·L-1時,誘導率隨2,4-D濃度升高而降低,其余處理隨2,4- D濃度升高而增加。在含有6-BA,IAA和2,4-D的培養基中,22號處理組的誘導率最高為84.51%,此時愈傷組織呈黃綠色、疏松(圖1),24,25和26組合誘導率較高,但愈傷組織生長狀態與22號處理相比較差,有水漬化現象發生。綜合比較,誘導葉片愈傷組織的最佳培養基是22號處理MS+1.0 mg·L-1 6-BA+0.1 mg·L-1IAA+1.0 mg·L-12,4-D。
2.3 葉片愈傷組織分化的最佳培養基
由表3可知,僅添加6-BA時,出芽率最高的是3號處理,為4.66%,其余兩組處理未分化出不定芽;僅添加TDZ時,愈傷組織未分化出不定芽。僅添加6-BA和TDZ時,愈傷組織都能生根,但生根率隨6-BA,TDZ濃度的增加逐漸降低。同時添加6-BA和TDZ時,出芽率最高的是13號處理,為16.71%,與其余各組差異顯著(Plt;0.05)。生根率最高的為9號處理,其生根率為12.43%。當6-BA,TDZ,NAA三者同時添加時,18號和23號處理只分化不定芽,16,17和19號處理只分化不定根,其他四種處理呈現不同結果,有的產生不定根,有的產生不定芽。出芽率最高的是22號處理,出芽率為66.37%(圖1),生根率最高的是24號處理,為28.91%(圖1)。當6-BA濃度在3 mg·L-1時,平均不定芽數均在4個以上,最多的是22號處理,為5.73個。
綜合比較,愈傷組織出芽率最高的培養基是22號處理MS+3 mg·L-16-BA+0.5 mg·L-1TDZ+0.5 mg·L-1IAA。生根率最高的培養基是24號處理MS+3 mg·L-16-BA+2.0 mg·L-1TDZ+1.0 mg·L-1IAA。
2.4 不定芽增殖的最佳培養基
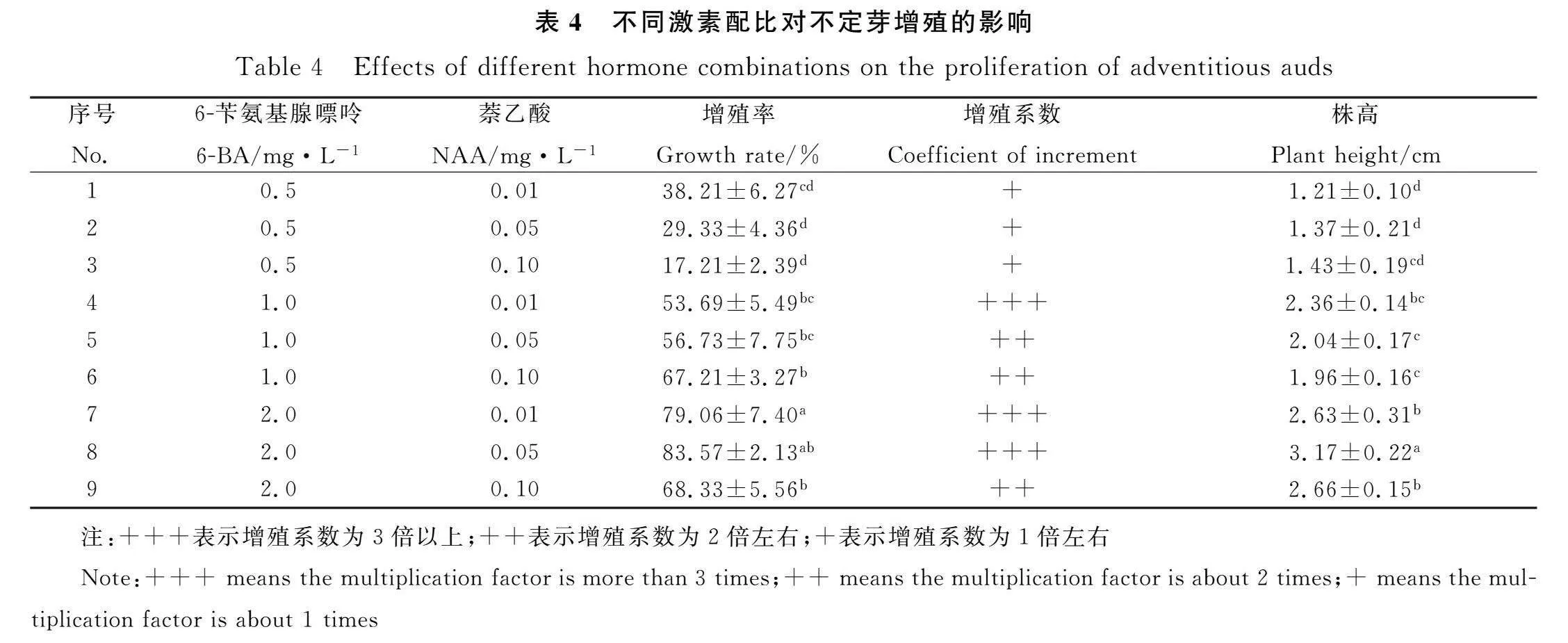
將愈傷組織誘導的不定芽接到增殖培養基后,芽塊體積增大,20 d后在芽塊周圍增殖出不定芽(圖1)。由表4可知,不定芽增殖率在17.21%~83.57%之間,8號處理的芽增殖率最高,為83.57%,增殖系數平均在3倍以上。NAA濃度固定時,不定芽增殖率、增殖系數和株高隨6-BA濃度增加而增加。當6-BA在0.5 mg·L-1時,隨NAA濃度增加,不定芽增殖率逐漸降低,增殖系數在1倍左右,株高逐漸增加。當6-BA在1.0 mg·L-1時,隨NAA濃度增加,不定芽增殖率逐漸升高,株高逐漸降低。當6-BA在2.0 mg·L-1時,不定芽增殖率和株高呈先升后降的趨勢。綜合比較,適宜不定芽增殖的培養基是8號處理MS+2.0 mg·L-16-BA+0.05 mg·L-1NAA。
2.5 不定芽生根誘導的最佳培養基
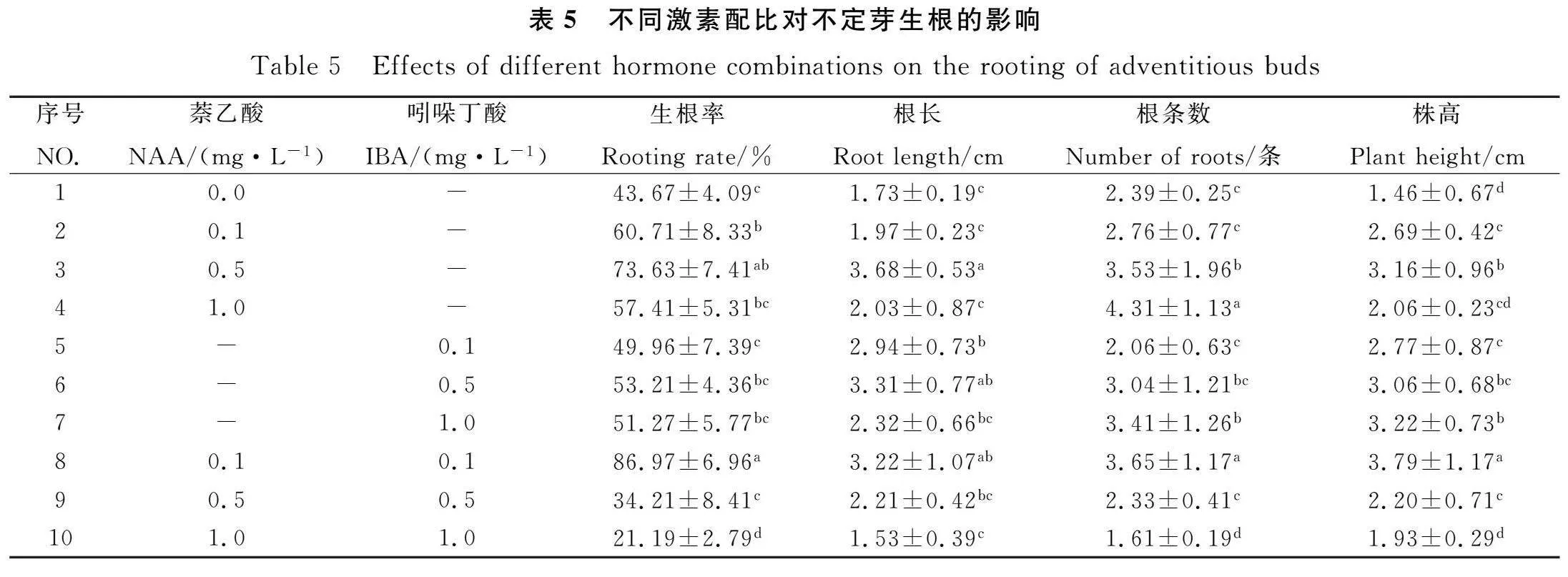
將生長至1 cm左右的不定芽接種至含有不同濃度激素的生根培養基中,在接種后的第8 d產生根系,20 d后逐漸伸長(圖1)。由表5可知,生根率在21.19%~86.97%之間,生根率隨NAA,IBA(0~0.5 mg·L-1)濃度增加呈先升后降的趨勢。相同濃度下,NAA的生根率優于IBA。單一添加0.5 mg·L-1NAA時,生根率最高,為73.63%;單一添加0.5 mg·L-1IBA時,生根率最高為53.21%。當NAA和IBA濃度都為0.1 mg·L-1時,生根率最高為86.97%。
根長隨NAA和IBA濃度的增加表現為先升后降,當NAA和IBA組合時,根長隨濃度增加而降低。NAA在 0.5 mg·L-1時,根長最長。
生根數隨NAA和IBA濃度的增加而增加,相同濃度時,NAA較IBA更能促進根數增加。當NAA和IBA組合時,根數隨濃度增加而降低。
株高隨NAA和IBA濃度增加表現為先升后降的趨勢,當NAA和IBA組合時,隨濃度的升高而下降。株高在NAA和IBA濃度都為0.1 mg·L-1時最高。綜上所述,NAA對毛建草不定芽生根的影響優于IBA,適宜不定芽生根的處理是8號處理1/2MS+0.1 mg·L-1NAA+0.1 mg·L-1IBA。
3 討論
3.1 外植體消毒的最佳時間
外植體表面消毒效果的好壞是離體培養能否成功的關鍵,植物種類及外植體的不同使得消毒劑種類和消毒時長不同[9]。消毒時間短導致滅菌不徹底,消毒時間過長則會降低植物的存活率[10]。唇形科常用75%乙醇與0.1% HgCl2組合進行消毒[10],適宜狹葉黃芩(Scutellaria regeliana)莖段消毒的組合為75%乙醇+0.1% HgCl2消毒5 min[12],芡歐鼠尾草(Salvia Hispanica)種子適宜的HgCl2消毒時間是10 min[13],‘雜花’薰衣草(Lavandula ‘Zahua’)葉片的HgCl2消毒時間為3 min[14],由此可知,HgCl2消毒時間會隨植物種類改變。宗越以毛建草葉片為外植體時,適宜其消毒的組合為75%乙醇30 s+0.1% HgCl2 7 min[7],存活率為48.00%,與本研究結論不同,這可能與采集時間、前期處理及部位選擇不同有關。
3.2 愈傷組織誘導及分化的最佳培養基
植物組織培養中,細胞分裂素和生長素的用量對愈傷組織誘導及分化有重要的調節作用,過高或過低都不利于植物生長[15-16]。常用6-BA,TDZ,2,4-D,IAA,NAA等激素誘導唇形科植物葉片產生愈傷組織[17-20],適宜狹葉薰衣草(Lavandula angustifolia)[21]葉片愈傷組織誘導培養基是MS+2.0 mg·L-16-BA+2.0 mg·L-12,4-D;百里香(Thymus mongolicus)[10]葉片愈傷組織誘導培養基是MS+2.0 mg·L-16-BA+0.1 mg·L-1IAA;北青蘭(Dracocep halum argunense)[22]葉片在MS+2.0 mg·L-16-BA+0.5 mg·L-1NAA培養基中,其愈傷組織生長狀態良好,顏色翠綠。宗越[7]發現適宜毛建草莖段、葉片愈傷組織誘導培養基是MS+0.5 mg·L-16-BA+0.5 mg·L-1NAA,愈傷組織呈黃色,質地緊密。桑曉霞[8]以組培苗莖段研究毛建草再生體系,其結論與宗越[7]的研究一致。宗越和桑曉霞的研究表明,愈傷組織在含有6-BA和NAA的培養基中較難分化不定芽,僅分化出不定根,這種現象可能因為是6-BA和NAA組合不適宜愈傷組織不定芽分化。本研究中,毛建草葉片在6-BA與2,4-D或IAA組合時,愈傷組織誘導率低、狀態差,不利于后期不定芽分化,同時添加6-BA,IAA,2,4-D的培養基,愈傷組織誘導率最高為84.51%,此時愈傷組織疏松,顏色呈黃綠色,培養效果較好。這與宗越[7]和桑曉霞[8]的研究不同,可能是多種激素協同作用遠大于一種激素單獨使用,其效果與外植體及愈傷組織內源激素的種類和濃度有重要關系[23-25]。劉俊等[5]以毛建草帶芽莖段經消毒處理后直接誘導腋芽產生,未經愈傷組織誘導及分化,研究發現IAA能促進腋芽生長,本研究中添加6-BA或TDZ時,不定芽分化率較低,添加IAA后分化率逐漸上升,本研究與劉俊等[5]研究結論相似。黃芩(Scutellaria baicalensis)[26] 和狹葉黃芩[12]愈傷組織不定芽分化率隨6-BA濃度升高而增加。本研究中,IAA濃度一定時,愈傷組織不定芽分化率隨6-BA和TDZ濃度升高而增加。
3.3 不定芽增殖的最佳培養基
常用6-BA和NAA組合對唇形科植物不定芽進行增殖培養,芽增殖系數大且生長勢強,其比例因植物不同而不同[27]。6-BA對一串紅(Salvia splendens)[28]芽叢的誘導起決定作用,但含量過高會抑制芽叢的形成,僅添加NAA或IBA的培養基中,一串紅不定芽增殖率低,芽生長較弱,適宜其不定芽增殖的培養基是1/2MS+2.0 mg·L-16-BA+0.1 mg·L-1NAA+0.5 mg·L-1IBA。本研究中,NAA濃度一定時,不定芽增殖率隨6-BA濃度升高而增加,但NAA濃度在0.1 mg·L-1時,6-BA濃度過高會降低不定芽的增殖系數,株高也隨之降低。這與前者的研究結論一致[28],不定芽在MS+2.0 mg·L-16-BA+0.05 mg·L-1NAA培養基中增殖率最高,增殖系數在3倍以上,這說明適宜的6-BA和NAA組合可以產生較高的增殖率和增殖系數。
3.4 不定芽生根的最佳培養基
NAA和IBA有助于不定芽生根[15]。濃度相同時,NAA對丹參(Salvia miltiorrhiza)[29]的生根效果優于IBA,隨NAA和IBA濃度增加,丹參不定芽生根率表現為先升后降,適宜其生根的NAA濃度是0.4 mg·L-1。僅添加NAA或IBA不利于涼粉草(Platostoma palustre)[30]不定芽根系的誘導,同時添加NAA和IBA時,其生根率較高,植株生長健壯,適宜其生根的培養基是MS+0.5 mg·L-1NAA+1.0 mg·L-1IBA。
本研究發現,添加NAA的組合整體比添加IBA的生根效果好,NAA和IBA同時添加時,生根率較高,不定芽生根率隨NAA和IBA濃度增加呈先升后降的趨勢,說明高濃度的NAA和IBA抑制根系的形成,這與前人的研究結論一致[29-30],適宜毛建草不定芽生根的培養基是1/2MS+0.1 mg·L-1NAA+0.1 mg·L-1IBA。
4 結論
適宜毛建草葉片表面消毒的方法是75%乙醇浸泡30 s后,再用0.1%HgCl2消毒4 min。適宜葉片愈傷組織誘導培養基是MS+1.0 mg·L-16-BA+0.1 mg·L-12,4-D+1.0 mg·L-1IAA,誘導率達84.51%。愈傷組織分化的最佳培養基為MS+3 mg·L-16-BA+0.5 mg·L-1TDZ+0.5 mg·L-1IAA,適宜不定芽分化率為66.37%。適宜不定芽增殖培養基為MS+2.0 mg·L-16-BA+0.05 mg·L-1NAA,增殖率為83.57%。適宜生根的培養基為1/2MS+0.1 mg·L-1NAA+0.1 mg·L-1IBA,生根率為86.97%。本研究以葉片為外植體建立了毛建草間接器官發生的組織培養再生體系,篩選出了適宜其各培養階段的培養基及激素組合,為毛建草的種苗快繁及種質資源保存提供了一定的技術基礎,但仍需進一步探討外源添加物、光照、溫度等因素對各階段培養的最佳條件。
參考文獻
[1] 梁寶愛,張素娟,湯國朝,等. 毛建草作為新食品原料的研究[J]. 食品工程,2022(2):45-48
[2] 楊宇昊. 毛建草藥茶黃酮類物質的提取純化及活性研究[D]. 太原:山西大學,2023:5-7
[3] 張彥廣. 河北省野生花卉調查及部分種的引種栽培研究[D]. 北京:北京林業大學,2006:9-13
[4] 田旭平,郭慶浩,孫鳴嶼,等. 不同種源的毛建草珠芽形成比較研究[J]. 草地學報,2021,29(6):1357-1362
[5] 劉俊,孫瑞芬,耿牡丹,等. 毛建草離體培養快繁體系的建立[J]. 北方農業學報,2017,45(6):102-106
[6] 李倩. 秋水仙素對毛建草種子萌發及幼苗生長的影響[D]. 太谷:山西農業大學,2021:49-51
[7] 宗越. 毛建草茶飲習俗及組織培養研究[D]. 太谷:山西農業大學,2019:39-41
[8] 桑曉霞. 藥茶原料毛建草快繁體系建立及功能成分研究[D]. 太原:山西大學,2021:4-6
[9] 范欲航,許悅,祝詩詞,等. 美洲狼尾草組織培養再生體系的建立[J]. 草地學報,2023,31(1):89-95
[10]位明君,王萌,范希峰,等. 青綠苔草(Care breviculmis)愈傷組織誘導與再生體系的建立[J]. 草地學報,2022,30(8):2053-2057
[11]姚鳳琴. 羅勒等4種唇形科香花植物離體培養與離體保存研究[D]. 福州:福建農林大學,2012:44-46
[12]張靜,牛喆,范衛芳,等. 狹葉黃芩組織培養再生體系的建立[J]. 植物研究,2020,40(1):50-57
[13]李偉麗,黃麗芳,夏新界. 芡歐鼠尾草的組織培養和快速繁殖[J]. 草業科學,2016,33(3):393-399
[14]克熱木汗·吾斯曼,蘇秀娟,張明浩,等. ‘雜花’薰衣草再生體系的建立[J]. 分子植物育種,2023,21(24):8187-8194
[15]BOIX Y F,ARRUDA R C O,DEFAVERI A C A,et al. Callus in Rosmarinus officinalis L.(Lamiaceae):A morphoanatomical,histochemical and volatile analysis[J]. Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology,2013,147(3):751-757
[16]KOSAR M,MAHMOUD O. Trichomes and regeneration by direct organogenesis of medicinal plant Dracocephalum kotschyi L,using shoot tips (Lamiaceae)[J]. Journal of Crop Science and Biotechnology,2012,15(3):251-257
[17]GHARARI Z,BAGHERI K,KARIMKHANLOOEI G. Study of tissue culture and in vitro organogenesis of Scutellaria bornmuelleri using benzylaminopurine,isopentenyl adenine and thidiazuron[J]. South African Journal of Botany,139,2021:458-469
[18]ZHANG G,SHI X,PAN H,et al. Study on callus induction and tissue culture regeneration in vitro of Dracocephalum rupestre[J]. Bulletin of Botanical Research,2019,8:525-532
[19]孟祥玉,熊亞,張素勤,等. 植物生長調節劑對草石蠶愈傷組織和不定芽誘導的影響[J]. 種子,2019,38(10):14-18
[20]舒英杰,陸艷,唐玉超,等. 薄荷葉片離體再生體系的建立[J]. 分子植物育種,2016,14(12):3483-3488
[21]王嬋,陳麗娟,程明華,等. 狹葉薰衣草離體培養技術研究[J]. 海南師范大學學報(自然科學版),2012,25(4):435-437,469,479
[22]胡國富,李鳳蘭,袁強,等. 北青蘭(Dracocephalum argunense)葉片組織培養的研究[J]. 東北農業大學學報,2004(2):195-198
[23]JACOBS W P. Hormone transport and action in the green shoot:long-term studies of a clonal stock of Coleus blumei (Labiatae)[J]. American Journal of Botany,85(10),1998:1353-1363
[24]DAS S,SULTALA K W,CHANDRA I. In vitro propagation,phytochemistry and pharmacology properties of Basilicum polystachyon (L.) Moench (Lamiaceae):A short review[J]. South African Journal of Botany,2023,155:178-186
[25]JONUBI P,MAJD A,ZAMANI N M. Indirect regeneration of endangered Dracocephalum kotschyi Boiss[J]. Developmental Biology,2018,10(1):33-42
[26]賀美忠. 黃芩組織培養與快速繁殖條件的研究[J]. 農業科技通訊,2016(4):79-80
[27]STEFANOVA M A,KOLEVA D P,GANEVA T G,et al. Effect of plant growth regulators on the regeneration of in vitro-propagated Lamium album L. plants[J]. Journal of Pharmacy Research,2011,4(7):1982-1985
[28]劉靜. 一串紅的組織培養和四倍體育種[D]. 重慶:西南大學,2008:11-14
[29]龐艷菊. 丹參快速擴繁與遺傳轉化體系建立的研究[D]. 武漢:華中農業大學,2019:36-39
[30]龐秋凌,曾成,余扣花,等. 涼粉草的組培快繁技術研究[J]. 南方園藝,2022,33(5):30-34
(責任編輯 閔芝智)

