黃河三角洲寬體金線蛭腸道菌群多樣性分析


摘要" 為探究寬體金線蛭腸道與土壤環境中細菌群落多樣性差異,本研究使用高通量測序技術測定了該物種腸道和土壤中的細菌群落。結果表明,金線蛭腸道和土壤樣品中的細菌群落多樣性和群落結構存在明顯差異,表明土壤對腸道細菌群落的建立影響不大。與土壤樣品相比,腸道樣品中的細菌豐富度和多樣性明顯降低;腸道中的優勢菌門為厚壁菌門(Firmicutes)40.64%、變形桿菌(Proteobacteria)28.94%和擬桿菌門(Bacteroidota)16.20%等,土壤中的優勢菌門為變形桿菌48.95%、擬桿菌門16.69%和放線菌門(Actinobacteriota)14.85%等;腸道中優勢屬為氣單胞菌屬(Aeromonas)23.76%、鯨桿菌屬(Cetobacterium)9.98%和刺骨魚屬(Epulopiscium)8.16%。土壤類群中優勢屬為氫噬胞菌屬(Hydrogenophaga)6.16%、黃桿菌屬(Flavobacterium)11.36%和氣單胞菌屬5.26%。兩者在轉運通路、碳循環通路和免疫等方面存在差異。研究結果為了解寬體金線蛭的腸道細菌群落及與土壤環境間的關系提供參考。
關鍵詞" 寬體金線蛭;腸道菌群;土壤菌群;菌群多樣性
中圖分類號" S917.4" " " "文獻標識碼" A" " " "文章編號" 1007-7731(2024)23-0035-05
DOI號" 10.16377/j.cnki.issn1007-7731.2024.23.008
Analysis of intestinal flora diversity of Whitmania pigra in Yellow River Delta
LIANG Zhaodong" " CUI Qinghua
(Binzhou Environmental Protection Science and Technology Institute, Binzhou 256600, China)
Abstract" To investigate the diversity of bacterial communities in the intestinal tract of Whitmania pigra and soil of enviroment, high-throughput sequencing technology was used to determine the bacterial communities in the intestinal tract of this species.and soil of enviroment The results showed that there were significant differences in bacterial community diversity between and community structure intestinal and soil samples,indicated that soil had little effect on the establishment of intestinal bacterial community. Compared with soil samples, the richness and diversity of bacteria in intestinal samples were significantly reduced. The dominant bacteria in the gut were Firmicutes 40.64%, Proteobacteria 28.94% and Bacteroidota 16.20%. The dominant bacteria in soil were Proteobacteria 48.95%, Bacteroides 16.69% and Actinobacteriota 14.85%. The dominant genera were Aeromonas 23.76%, Cetobacterium 9.98% and Epulopiscium 8.16%. The dominant genera of the soil groups were Hydrogenophaga 6.16%, Flavobacterium 11.36% and Aeromonas 5.26%. There were differences in transport pathway, carbon cycle and immunity between the two. The research results provided a reference for understanding the relationship between intestinal bacterial community of Whitmania pigraand and soil environment .
Keywords" Whitmania pigra; intestinal flora; soil flora; bacterial diversity
腸道微生物及其代謝產物在宿主的一系列生物學功能中發揮著重要作用,如營養和能量獲取、免疫和炎癥調節以及神經傳導等[1-2]。寄主系統發育、生長、飲食和健康狀況對腸道細菌群落的組成和多樣性有一定的影響[3-4]。外部環境中的微生物有助于動物腸道微生物群落的建立。Zhang等[5]研究發現,土壤無脊椎動物的腸道微生物是由土壤微生態帶逐漸建立而成。微生物群落分析通常采用分離培養法,但這種方法從樣品中分離出微生物有限,因此較難準確地計算出微生物的數量[6]。嚴瓊英等[7]利用聚合酶鏈式反應-變性梯度凝膠電泳和16S rDNA技術進行菌群結構分析,得出的結果較完整。劉驍蒨等[8]分析了變性梯度凝膠電泳技術在馬屬動物腸道微生物多樣性研究中的應用,表明該技術在分析動物腸道微生物多樣性方面具有快速、精確等優點,是篩選優勢菌株和分離有害菌的有效手段之一。隨著測序技術不斷發展,高通量測序成為反映樣品中微生物信息的有效工具之一。
大多數水蛭生活在淡水環境中,部分物種可以在陸地和海洋環境中生存。其種類較多,目前已確認的水蛭有近700種,其中約100種是海洋物種,90種是陸生物種,其余的是淡水類群[9]。寬體金線蛭(Whitmania pigra)為淡水水蛭,屬于環節動物,有前后兩個吸盤,用于移動和取食。該物種分布廣泛,具有較高的藥用價值,是水蛭養殖中的常見種類之一[10-11]。盡管水蛭與人類有密切關系,但對寬體金線蛭的腸道菌群研究相對較少。基于此,本研究使用高通量測序技術測定了該物種腸道和土壤環境中的細菌群落,分析兩者間的菌群群落多樣性和結構的差異,為了解寬體金線蛭的腸道細菌群落及與土壤環境間的關系提供參考。
1 材料與方法
1.1 樣品采集和處理
在黃河三角洲地區進行樣品采集。在寬體金線蛭養殖區域設置4塊1 m×1 m的樣地,清除可見的植物凋落物和石塊,從每塊樣地采集0~10 cm的表層土壤樣品,保存于干冰中運回實驗室。從土壤中取出寬體金線蛭,放入原始棲息地的土壤中,然后活體帶回實驗室。隨機抽取體重(2.0±0.6)g的寬體金線蛭,放入冰塊中,用75%乙醇和無菌蒸餾水清洗。然后在無菌條件下解剖金線蛭標本,收集腸道組織。將采集的腸道組織(GUT)和土壤樣品(WS)保存在-80 ℃冰箱中,用于DNA提取。
1.2 高通量測序
使用土壤DNA試劑盒提取土壤樣本的總基因組DNA,并使用糞便DNA試劑盒提取水蛭腸道樣本的總基因組DNA。使用通用引物341F(5’-CCTACGGGNGGCWGCAG-3’)和805R(5’-GACTACHVGGGGTATCTAATCC-3’)擴增細菌16S rRNA基因的V3-V4區,擴增條件為98 ℃變性30 s;98 ℃變性10 s,54 ℃退火30 s,72 ℃延伸45 s,32個循環;72 ℃延伸10 min[12]。反應混合物包括25 ng模板DNA、12.5 μL預混料、上、下游引物序列各2.5 μL和PCR級水。用2%瓊脂糖凝膠電泳法鑒定擴增產物,用AMPure XT純化,用Qubit定量。在此基礎上,建立擴增子庫,利用NovaSeq 6000測序儀進行雙端2×250 bp測序。
1.3 數據分析
將測序過程、統計分析和雙端讀數組裝成基于條碼的樣本,切割條碼和引物序列。使用FLASH v1.2.8軟件合并對端讀數。通過篩選嵌合體和去除長度小于100 bp的序列,獲得高質量的數據。使用QIIME2軟件中的除性擴增去噪算法(DADA2)插件進行復制,得到擴增序列變異(ASV)表,并去除單態ASV,分析細菌多樣性組成[13],使用Kruskal-Wallis計算細菌豐富度指數(Chao1指數)和多樣性指數(Shannon指數),評價細菌群落豐富度和多樣性。利用R語言繪制韋恩圖和主坐標分析(Principal coordinates analysis,PCoA)圖。進行置換多變量方差分析,對PCoA結果進行統計。使用Python LEfse包,進行線性判別(LEfse)分析,分析組間差異,獲得不同分組具有統計學差異的微生物組成。采用PICRUST2對不同分組的菌群開展功能預測分析。
2 結果與分析
2.1 細菌菌群多樣性
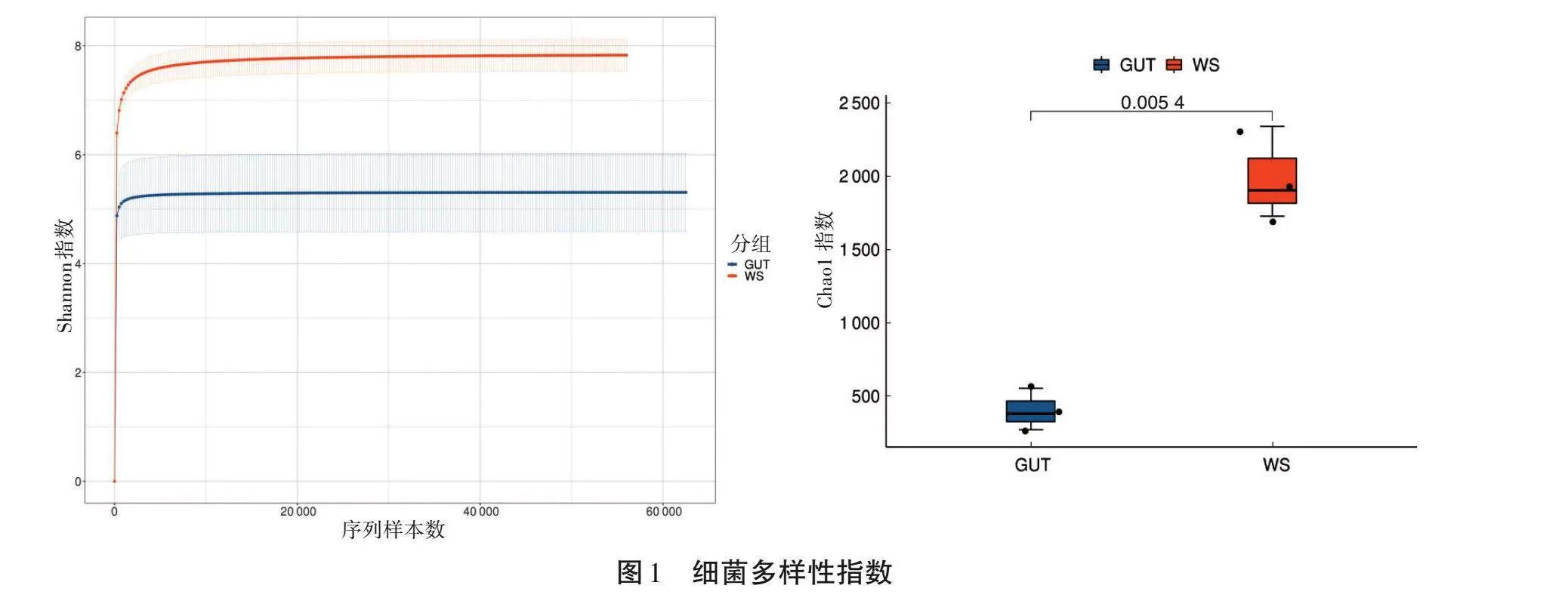
本研究共獲得480 044個原始讀數。過濾原始讀數后,獲得479 411個有效讀數。由圖1可知,腸道組(GUT)和土壤組(WS)中細菌群落的豐富度和多樣性存在差異。腸道細菌群落Shannon指數和Chao1指數明顯低于土壤組,說明相比于水蛭腸道菌群,土壤細菌群落更加多樣化。
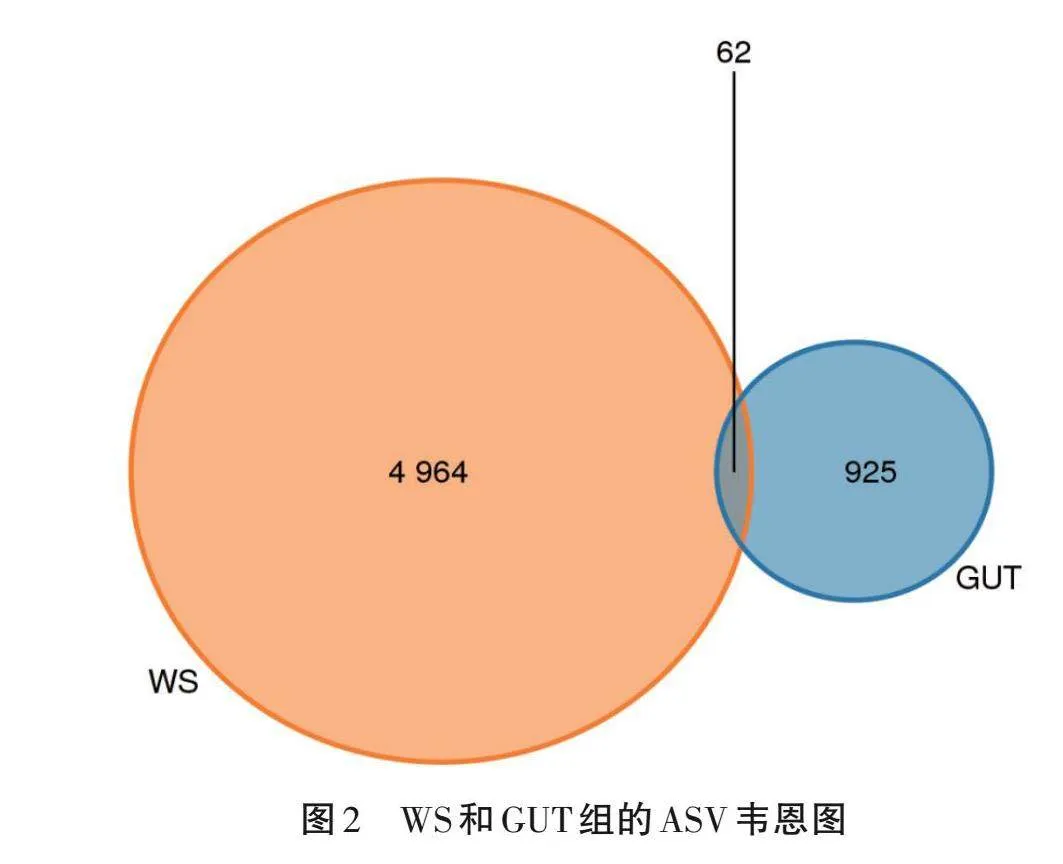
韋恩圖(圖2)顯示了土壤和腸道菌群之間共享和獨有的ASV數量。GUT和WS組的ASV數分別為987和5 026個,共有的ASV數量為62個。共享ASV在兩組ASV總數中所占比例很小。表明土壤微生物中包含更多的ASV,具有更高的特異性。
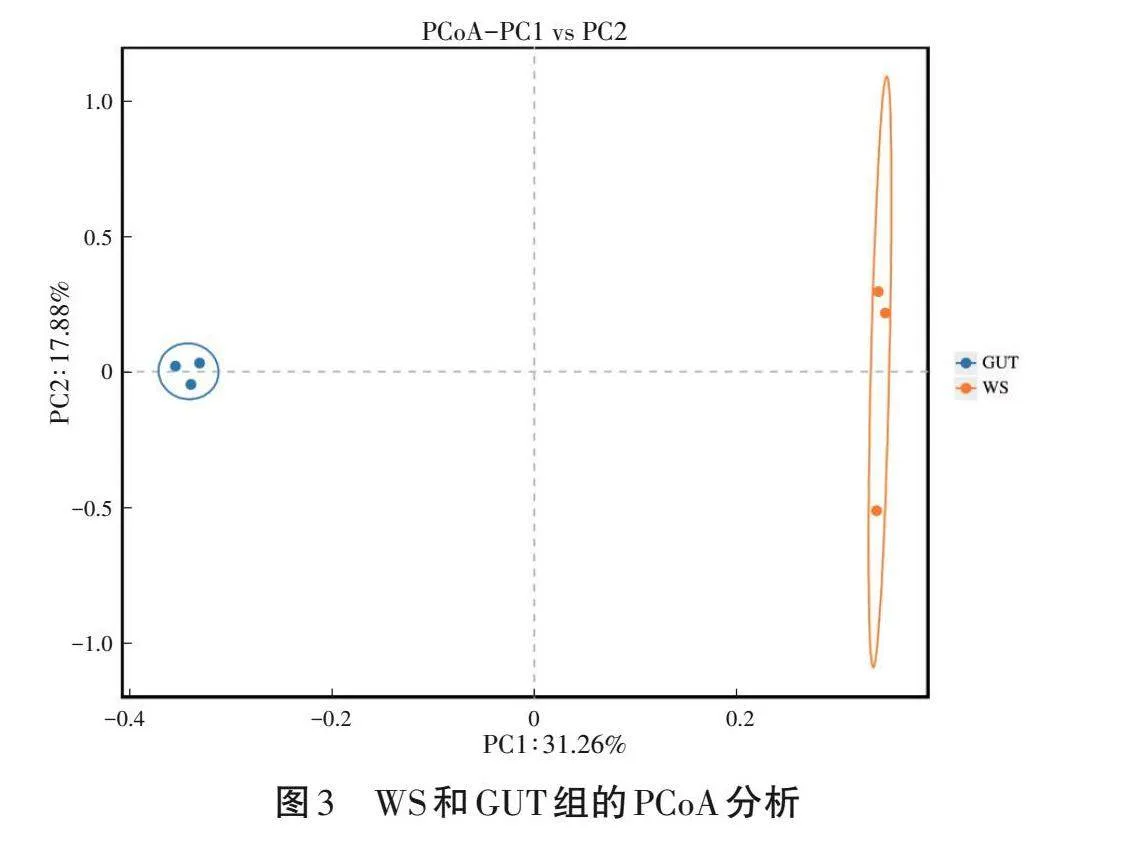
基于未加權UniFrac距離的PCoA確定組間的組成結構上的差異。由圖3可知,PC1和PC2分別解釋了31.26%和17.88%的變異(圖3)。PCoA結果顯示兩組細菌有明顯的分離,代表了細菌群落具有明顯的差異。此外,GUT組樣品間距離較小,表明水蛭腸道組的樣品比土壤組的樣品具有更高的相似性。
2.2 細菌菌群組成
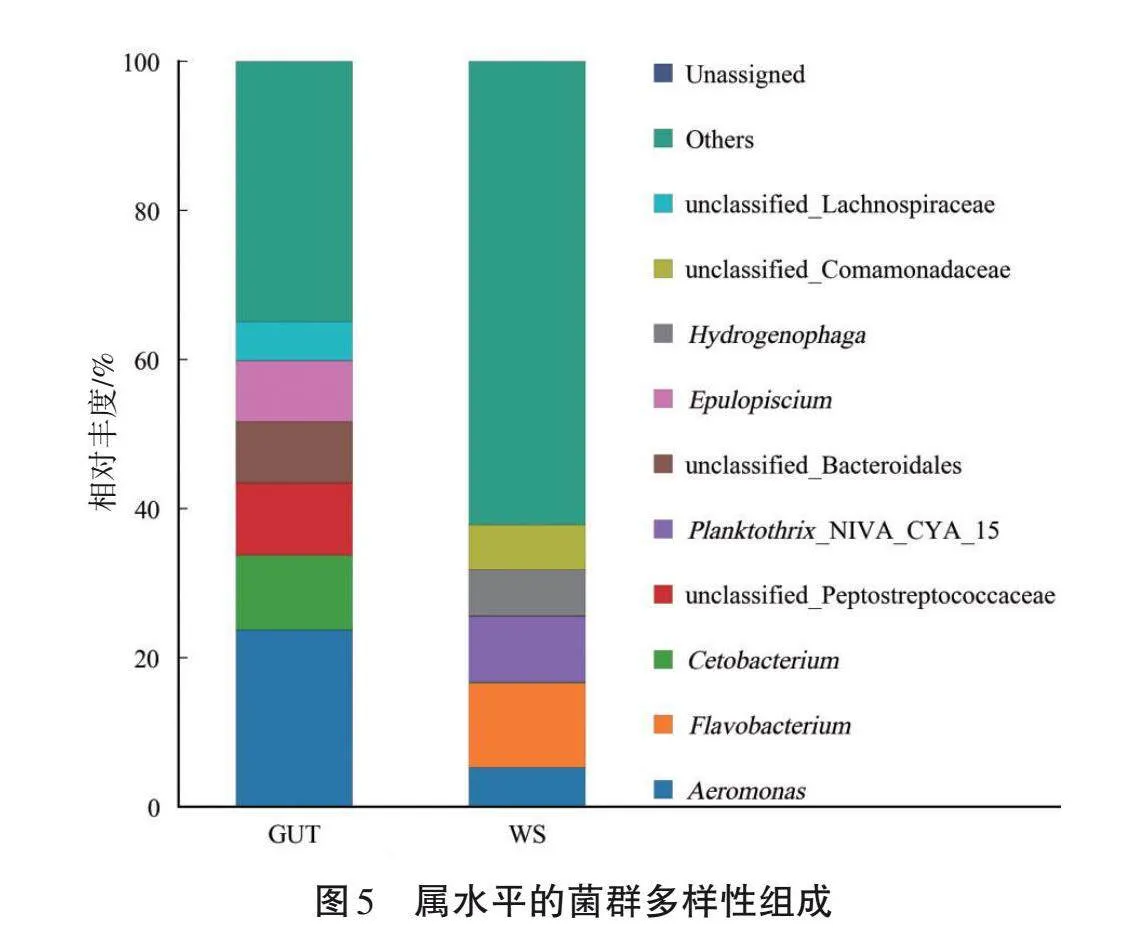
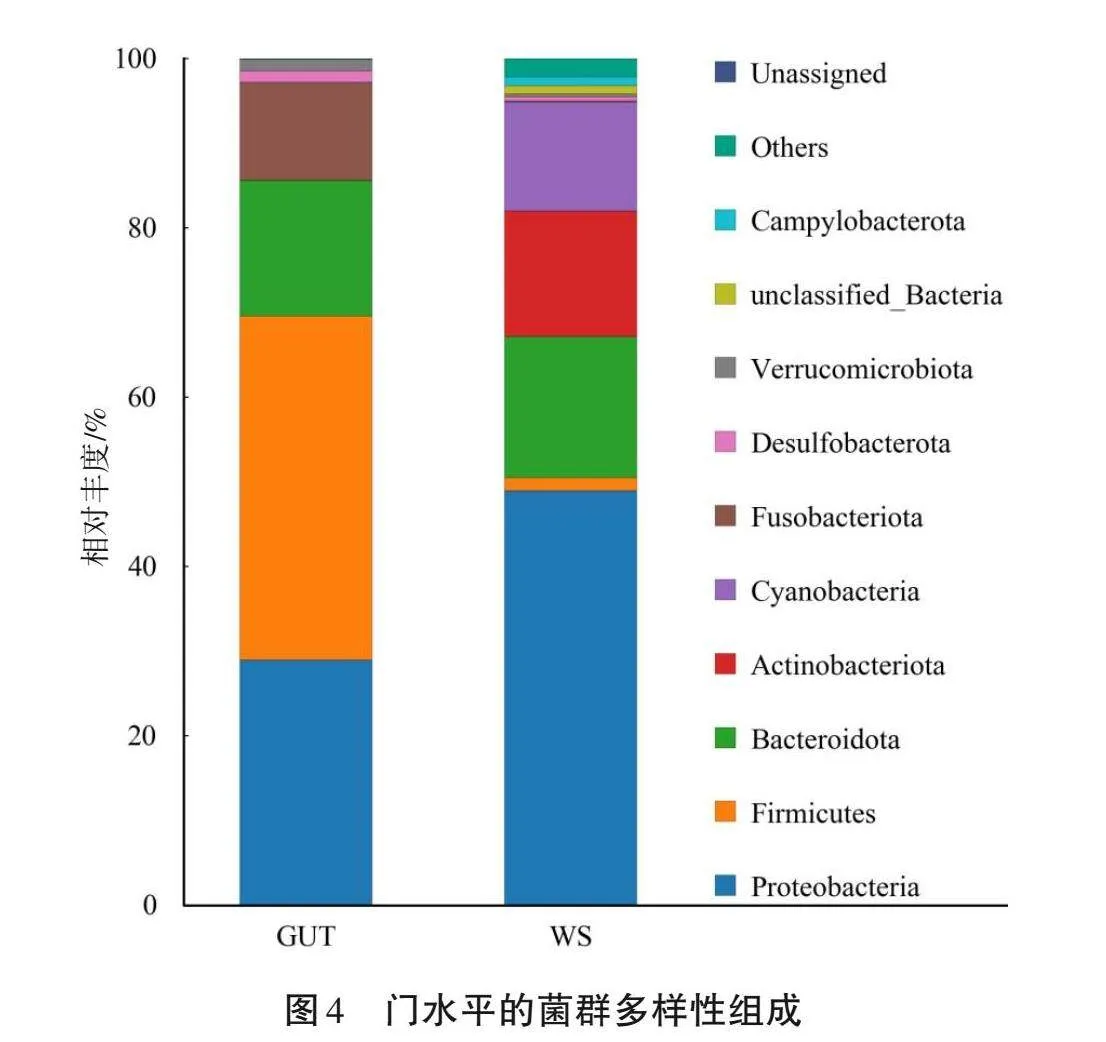
細菌群落在門水平的相對豐度如圖4所示,水蛭腸道類群中相對豐度大于1%的類群為厚壁菌門(Firmicutes)40.64%、變形桿菌(Proteobacteria)28.94%、擬桿菌門(Bacteroidota)16.20%和梭桿菌門(Fusobacteriota)11.57%。土壤類群中相對豐度大于1%的類群為變形桿菌48.95%、擬桿菌門16.69%、放線菌門(Actinobacteriota)14.85%、藍藻菌門(Cyanobacteria)12.87%和厚壁菌門1.52%。變形桿菌是兩組菌群中最豐富的類群。
由圖5可知,在屬水平上,除未分類屬外,腸道類群中優勢屬(相對豐度gt;1%)為氣單胞菌屬(Aeromonas)23.76%、鯨桿菌屬(Cetobacterium)9.98%和刺骨魚屬(Epulopiscium)8.16%。土壤類群中優勢屬為氫噬胞菌屬(Hydrogenophaga)6.16%、黃桿菌屬(Flavobacterium)11.36%和氣單胞菌屬5.26%。兩者的細菌菌落屬水平的優勢菌屬有所不同。
2.3 線性判別
LEfse分析可篩選不同分組間具有統計學差異的生物學標記,檢測具有統計學意義的特征值,并將其定位到相應的類群。由圖6可知,在門水平,放線菌門、藍藻菌門等在土壤組中具有重要功能,梭桿菌門、厚壁菌門在水蛭腸道菌群具有重要功能;在屬水平,黃桿菌屬、氫噬胞菌屬和紅細菌屬(Rhodobacter)等在土壤分組中具有重要功能,理研菌屬(Rikenella)和氣單胞菌屬等在水蛭腸道菌群具有重要功能。
2.4 功能預測
為探究不同分組的功能差異,將篩選獲得差異類群,通過原核生物同源蛋白庫數據集開展定位分析。由圖7可知,轉錄(Transcription)、染色質結構和動力學(Chromatin structure and dynamics)、次生代謝物的合成、轉運和分解功能(secondary metabolites biosynthesis,transport and catabolism)等存在明顯功能差異。主要參與細菌體內的轉運通路、碳循環通路和免疫等過程。
3 結論與討論
腸道微生物對宿主的健康和代謝具有重要作用。測序技術的發展有利于促進對微生物群落的全面了解。腸道微生物的變化是由宿主特性(宿主的飲食、年齡和行為)和外部環境因素引起的。本研究對寬體金線蛭腸道細菌群落進行了鑒定,發現其腸道細菌群落與土壤中的細菌群落有較小的相似性。土壤中的細菌多樣性和豐富度明顯較高。厚壁菌門、變形桿菌和擬桿菌門是腸道細菌群落的優勢菌門,相關研究發現在一些甲殼類動物的腸道中,優勢細菌門為厚壁菌門,如黑虎蝦[14]、中華絨螯蟹[15]和南美白對蝦[16],本研究結果與此具有相似性。變形桿菌具有兼性厭氧或必需厭氧的特點,能夠適應一系列的好氧條件,具有更強的營養獲取能力[17],因此是腸道優勢菌群之一,有助于維持腸道厭氧環境的動態平衡。在所有的腸道樣本中均未鑒定出類桿菌門的菌種,或者比例較低。可能是由于其他腸道微生物的生物聚合物具有降解功能。
綜上,本研究使用高通量測序技術測定了金線蛭腸道和土壤中的細菌群落。結果表明,該物種腸道和土壤樣品中的細菌群落多樣性和結構存在明顯差異,兩者間的優勢菌門和菌屬存在差異,細菌群落的相似性較小,且在轉運通路、碳循環通路和免疫等方面存在差異。表明土壤對腸道細菌群落的建立影響不大。關于土壤和寬體金線蛭腸道細菌群落差異的原因還有待進一步探討。
參考文獻
[1] LEE W J,HASE K. Gut microbiota-generated metabolites in animal health and disease[J]. Nature chemical biology,2014,10:416-424.
[2] XUE J J,AJUWON K M,FANG R J. Mechanistic insight into the gut microbiome and its interaction with host immunity and inflammation[J]. Animal nutrition,2020,6(4):421-428.
[3] XIONG J B,WANG K,WU J F,et al. Changes in intestinal bacterial communities are closely associated with shrimp disease severity[J]. Applied microbiology and biotechnology,2015,99(16):6911-6919.
[4] GONG L X,LIU B Y,WU H,et al. Seasonal dietary shifts alter the gut microbiota of avivorous bats:implication for adaptation to energy harvest and nutritional utilization[J]. mSphere,2021,6(4):e0046721.
[5] ZHANG Q,ZHANG Z Y,LU T,et al. Gammaproteobacteria,a core taxon in the guts of soil fauna,are potential responders to environmental concentrations of soil pollutants[J]. Microbiome,2021,9(1):196.
[6] 劉月姣,李儉杰,孫一凡,等. 利用培養組學技術分離培養肺部微生物群研究[J]. 微生物學報,2022,62(3):1110-1118.
[7] 嚴瓊英,林霖,葉秀玲,等. 應用聚合酶鏈式反應-變性梯度凝膠電泳和16S rDNA技術分析果凍脹氣原因[J]. 食品安全質量檢測學報,2015,6(12):5041-5045.
[8] 劉驍蒨,尤凡,尹航,等. 變性梯度凝膠電泳技術在馬屬動物腸道微生物多樣性研究中的應用[J]. 科技與創新,2020(10):156-157,159.
[9] TONG L,DAI S X,KONG D J,et al. The genome of medicinal leech (Whitmania pigra) and comparative genomic study for exploration of bioactive ingredients[J]. BMC genomics,2022,23(1):76.
[10] 鄭利,覃川杰. 寬體金線蛭研究進展[J]. 安徽農業科學,2020,48(20):1-5,8.
[11] 何昶昊,陳曉瑩,張曉萌,等. 寬體金線蛭作為藥用水蛭基原的考證[J]. 中國醫藥導報,2021,18(24):112-115.
[12] LOGUE J B,STEDMON C A,KELLERMAN A M,et al. Experimental insights into the importance of aquatic bacterial community composition to the degradation of dissolved organic matter[J]. ISME journal,2016,10(3):533-545.
[13] CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al. DADA2:High-resolution sample inference from Illumina amplicon data[J]. Nature methods,2016,13:581-583.
[14] RUNGRASSAMEE W,KLANCHUI A,CHAIYAPECHARA S,et al. Bacterial population in intestines of the black tiger shrimp (Penaeus monodon) under different growth stages[J]. PLoS one,2013,8(4):e60802.
[15] LI K,GUAN W,WEI G,et al. Phylogenetic analysis of intestinal bacteria in the Chinese mitten crab (Eriocheir sinensis)[J]. Journal of applied microbiology,2007,103(3):675-682.
[16] 孫振麗,宣引明,張皓,等. 南美白對蝦養殖環境及其腸道細菌多樣性分析[J]. 中國水產科學,2016,23(3):594-605.
[17] WANG N,WANG W H,JIANG Y J,et al. Variations in bacterial taxonomic profiles and potential functions in response to the gut transit of earthworms (Eisenia fetida) feeding on cow manure[J]. Science of the total environment,2021,787:147392.
(責任編輯:胡立萍)

