高壓均質(zhì)聯(lián)合酶法破除條斑紫菜細(xì)胞壁工藝研究



摘要:為建立一種有效的條斑紫菜細(xì)胞破壁工藝,釋放出細(xì)胞中更多的營(yíng)養(yǎng)物質(zhì),從而更好地促進(jìn)人體的消化吸收,以連云港地區(qū)的條斑紫菜為原料,以蛋白質(zhì)和多糖的總得率為評(píng)價(jià)指標(biāo),利用高壓均質(zhì)法和酶法相結(jié)合的方法對(duì)條斑紫菜細(xì)胞進(jìn)行破壁處理,在單因素試驗(yàn)的基礎(chǔ)上采用正交試驗(yàn)進(jìn)行優(yōu)化,進(jìn)一步得出條斑紫菜細(xì)胞破壁的最優(yōu)工藝條件,并通過(guò)光學(xué)顯微鏡觀察破壁前后條斑紫菜細(xì)胞的破壞效果。結(jié)果表明,在最優(yōu)的輔助處理方式組合條件下,先經(jīng)過(guò)高壓均質(zhì)再用纖維素酶酶解處理后的紫菜細(xì)胞破壁效果良好,最佳的工藝條件為均質(zhì)壓力100 MPa、均質(zhì)次數(shù)8次、料液比1∶20、纖維素酶的添加比例2%、酶解時(shí)間3 h、酶解溫度50 ℃、酶解pH 5,在此最優(yōu)工藝條件下,條斑紫菜的蛋白質(zhì)和多糖總得率為40.12%,在光學(xué)顯微鏡下觀察到大部分條斑紫菜細(xì)胞破損嚴(yán)重,有細(xì)胞內(nèi)容物析出。試驗(yàn)數(shù)據(jù)證明了高壓均質(zhì)聯(lián)合酶法破除條斑紫菜細(xì)胞壁可以顯著提高條斑紫菜的蛋白質(zhì)和多糖得率,對(duì)條斑紫菜細(xì)胞壁具有明顯的破壞效果。
關(guān)鍵詞:條斑紫菜;破壁;酶解;高壓均質(zhì)
中圖分類號(hào):TS201.1""""" 文獻(xiàn)標(biāo)志碼:A"""" 文章編號(hào):1000-9973(2024)10-0074-07
Study on Technology of Breaking Cell Wall of Porphyra yezoensis by
High-Pressure Homogenization Combined with Enzymatic Method
GAO Zi-xin, MA Yong, YANG Jin-yu, YANG Liu-ying, WANG Ze-cheng,
CHEN Ze-xu, PAN Sai-kun*
(School of Ocean Food and Biological Engineering, Jiangsu Ocean University, Lianyungang 222005, China)
Abstract: In order to establish an effective technology for breaking the cell wall of Porphyra yezoensis, release more nutrients from the cells, and promote digestion and absorption in the human body better, with Porphyra yezoensis from Lianyungang area as the raw material, the total yield of protein and polysaccharide as the evaluation indexes, high-pressure homogenization method combined with enzymatic method is used to break the cell wall of Porphyra yezoensis. On the basis of single factor test, orthogonal test is used for optimization, and the optimal technological conditions for breaking the cell wall of Porphyra yezoensis are further obtained, and the destructive effect of Porphyra yezoensis cells before and after breaking the cell wall is observed by optical microscope. The results show that under the optimal combination of auxiliary treatment methods, the wall-breaking effect of Porphyra yezoensis cells treated with high-pressure homogenization firstly and then cellulase hydrolysis is good. The optimal process conditions are homogenization pressure of 100 MPa, homogenization frequency of 8 times, solid-liquid ratio of 1∶20, cellulase addition proportion of 2%, enzymatic hydrolysis time of 3 h, enzymolysis temperature of 50 ℃ and enzymatic hydrolysis pH of 5.Under the optimal technological conditions, the total yield of protein and polysaccharide of Porphyra yezoensis is 40.12%. In the optical microscope, it is observed that most of Porphyra yezoensis cells are badly
damaged and the content of cells is separated out. Through the test data, it is proven that" breaking the cell wall of Porphyra yezoensis by high-pressure homogenization combined enzymatic method could significantly improve the yield of protein and polysaccharide of Porphyra yezoensis, and has obvious destractive effect on the cell wall of Porphyra yezoensis.
Key words: Porphyra yezoensis; cell wall breaking; enzymatic hydrolysis; high-pressure homogenization
條斑紫菜(Porphyra yezoensis)是我國(guó)沿海地區(qū)一類具有重要經(jīng)濟(jì)價(jià)值的海洋藻類,其味道鮮美、風(fēng)味獨(dú)特,并且含有大量的蛋白質(zhì)、維生素、膳食纖維等營(yíng)養(yǎng)元素和多糖、藻膽蛋白、多肽等生物活性成分[1]。另外,條斑紫菜還具有降血壓[2]、降血脂[3]、抗氧化[4]、抗腫瘤[5]、提高人體免疫力等功效[6],是一種具有較高食用和藥用價(jià)值的海洋藻類植物。
盡管條斑紫菜有很多優(yōu)勢(shì),但是在進(jìn)行高值化、大規(guī)模利用方面仍然存在著很多問題。和其他藻類一樣,條斑紫菜中的營(yíng)養(yǎng)物質(zhì)和活性成分大多存在于細(xì)胞內(nèi),條斑紫菜細(xì)胞結(jié)構(gòu)緊密,破壁難度大,在破壁的過(guò)程中還要保證其主要的營(yíng)養(yǎng)物質(zhì)和生物活性不被破壞,因此,藻類細(xì)胞破壁成為細(xì)胞內(nèi)容物提取的關(guān)鍵環(huán)節(jié)[7]。郭鎖蓮等[8]利用響應(yīng)面分析法優(yōu)化纖維素酶對(duì)螺旋藻細(xì)胞的酶解破壁工藝,在最優(yōu)的條件下螺旋藻細(xì)胞的破壁率達(dá)到85.2%。劉春延等[9]使用高壓均質(zhì)技術(shù)破除靈芝孢子細(xì)胞壁,破壁率平均值為94.35%。Olmstead等[10]研究表明,高壓均質(zhì)法適用于高濃度(質(zhì)量分?jǐn)?shù)20%~25%)的微藻料液。在壓力800 MPa下均質(zhì)10次,小球藻的油脂提取率約達(dá)到90%。
綜上所述,經(jīng)破壁處理能有效提高內(nèi)容物的溶出及利用效率,高壓均質(zhì)法和酶法都對(duì)海洋藻類細(xì)胞壁的破壞有一定的效果,為了使蛋白質(zhì)和多糖的總得率最高,本文采用高壓均質(zhì)聯(lián)合酶法的技術(shù)對(duì)條斑紫菜細(xì)胞進(jìn)行破壁處理,在單因素試驗(yàn)的基礎(chǔ)上進(jìn)行正交試驗(yàn)優(yōu)化,并用光學(xué)顯微鏡觀察其破壁情況。
1 試驗(yàn)材料與方法
1.1 材料與試劑
原料:脫腥條斑紫菜,實(shí)驗(yàn)室自制。
主要試劑:纖維素酶(1.0×104 U/g),購(gòu)于山東隆科特酶制劑有限公司;考馬斯亮藍(lán)G-250、乙醇(95%)、磷酸(98%)、牛血清蛋白(BSA,純度≥99.0%)、硫酸(ρ=1.84 g/mL)、苯酚(5%)、葡萄糖等,均為國(guó)產(chǎn)分析純。
1.2 儀器與設(shè)備
1.3 條斑紫菜細(xì)胞破壁工藝流程
脫腥條斑紫菜片→超微粉碎→過(guò)篩→加水調(diào)漿→高壓均質(zhì)→酶解→滅酶→冷凍干燥→粉碎。
1.4 操作要點(diǎn)
將脫腥后的條斑紫菜粉過(guò)100目篩,準(zhǔn)確稱取10 g,按照一定的比例與水混合制成一定濃度的紫菜懸濁液,用0.1 mol/L的鹽酸或0.1 mol/L的NaOH溶液調(diào)節(jié)pH值。
將制成的紫菜懸濁液攪拌均勻后,倒入高壓均質(zhì)機(jī)內(nèi)以不同的均質(zhì)機(jī)壓力和次數(shù)進(jìn)行均質(zhì)。
均質(zhì)結(jié)束后加入不同質(zhì)量的纖維素酶,放入恒溫水浴鍋中,調(diào)整酶解溫度和時(shí)間,酶解結(jié)束后98 ℃水浴滅酶10 min,待冷卻后,以4 000 r/min離心10 min,提取上清液,測(cè)定蛋白質(zhì)和多糖的含量。
參考鄔應(yīng)龍等[11]的方法,將紫菜懸濁液進(jìn)行冷凍干燥,并進(jìn)行粉碎備用。
1.5 條斑紫菜蛋白含量的測(cè)定方法
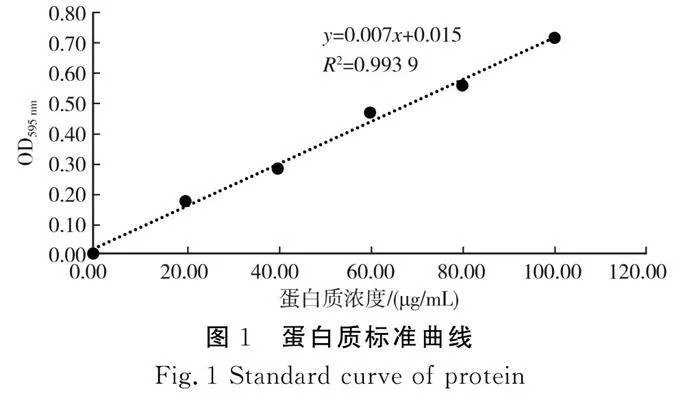
參考柳蔭等[12]的方法,即考馬斯亮藍(lán)法進(jìn)行測(cè)定,吸取100 μg/mL的牛血清標(biāo)準(zhǔn)蛋白液0,0.2,0.4,0.6,0.8,1.0 mL于具塞試管中,加入蒸餾水至1.0 mL,分別加入5.0 mL考馬斯亮藍(lán)試劑。蓋住試管后振蕩混勻,靜置2 min后采用1 cm光徑的比色皿在595 nm波長(zhǎng)處測(cè)定吸光值,以牛血清標(biāo)準(zhǔn)蛋白質(zhì)濃度為橫坐標(biāo),繪制標(biāo)準(zhǔn)曲線,得到線性回歸方程:y=0.007x+0.015,R2=0.993 9,見圖1。蛋白質(zhì)得率按式(1)計(jì)算:
蛋白質(zhì)得率(%)=提取液蛋白質(zhì)質(zhì)量(μg)原料質(zhì)量(μg)×100%。
(1)
1.6 條斑紫菜提取液多糖含量的測(cè)定
參照林靖瑩等[13]的方法,即苯酚-硫酸法并加以改進(jìn),分別吸取100 mg/L標(biāo)準(zhǔn)葡萄糖溶液0,0.1,0.3,0.5,0.7,0.9 mL于具塞試管中,用蒸餾水補(bǔ)至1.0 mL,然后向每個(gè)試管中加入1.0 mL濃度為5.0%的苯酚溶液,迅速加入5.0 mL濃硫酸,靜置8 min左右后,將試管放入30 ℃水浴鍋中反應(yīng)20 min,待反應(yīng)完全后利用紫外可見分光光度計(jì)在490 nm處測(cè)吸光度,以葡萄糖標(biāo)準(zhǔn)溶液濃度為橫坐標(biāo),吸光度為縱坐標(biāo),得到線性回歸方程:y=8.747 1x+0.008 6,R2=0.999 1,見圖2。多糖得率按式(2)計(jì)算:
多糖得率(%)=提取液多糖質(zhì)量(mg)原料質(zhì)量(mg)×100%。
(2)
1.7 條斑紫菜提取液總得率的計(jì)算
條斑紫菜提取液的總得率按式(3)計(jì)算:
總得率(%)=蛋白質(zhì)得率(%)+多糖得率(%)。(3)
1.8 不同輔助處理方式組合對(duì)蛋白質(zhì)和多糖得率的影響
建立5組對(duì)比試驗(yàn),固定料液比1∶25、均質(zhì)壓力80 MPa、高壓均質(zhì)次數(shù)6次、纖維素酶添加量2%、酶解時(shí)間3 h、酶解溫度40 ℃、酶解pH 6,考察不同輔助處理方式組合對(duì)蛋白質(zhì)和多糖得率的影響。第一組作為對(duì)照組,不均質(zhì)、不酶解,第二組只進(jìn)行高壓均質(zhì),第三組只進(jìn)行酶解,第四組先均質(zhì)后酶解,第五組先酶解后均質(zhì)。
1.9 高壓均質(zhì)聯(lián)合酶法對(duì)條斑紫菜細(xì)胞破壁的單因素試驗(yàn)設(shè)計(jì)
1.9.1 均質(zhì)壓力對(duì)蛋白質(zhì)、多糖得率的影響
固定紫菜細(xì)胞懸濁液的料液比1∶25、高壓均質(zhì)次數(shù)6次、纖維素酶添加量2%、酶解時(shí)間3 h、酶解溫度40 ℃、酶解pH 6,研究不同均質(zhì)壓力(0,20,40,60,80,100,120 MPa)對(duì)條斑紫菜細(xì)胞破壁效果的影響。
1.9.2 料液比對(duì)蛋白質(zhì)、多糖得率的影響
固定高壓均質(zhì)機(jī)的均質(zhì)壓力80 MPa、均質(zhì)次數(shù)6次、纖維素酶添加量2%、酶解時(shí)間3 h、酶解溫度40 ℃、酶解pH 6,研究不同料液比1∶15、1∶20、1∶25、1∶30、1∶35對(duì)條斑紫菜細(xì)胞破壁效果的影響。
1.9.3 高壓均質(zhì)次數(shù)對(duì)蛋白質(zhì)、多糖得率的影響
固定高壓均質(zhì)機(jī)的均質(zhì)壓力80 MPa、料液比1∶25、纖維素酶添加量2%、酶解時(shí)間3 h、酶解溫度40 ℃、酶解pH 6,研究不同高壓均質(zhì)次數(shù)2,4,6,8,10,12,14次對(duì)條斑紫菜細(xì)胞破壁效果的影響。
1.9.4 酶添加量對(duì)蛋白質(zhì)、多糖得率的影響
固定高壓均質(zhì)機(jī)的均質(zhì)壓力80 MPa、料液比1∶25、均質(zhì)次數(shù)6次、酶解時(shí)間3 h、酶解溫度40 ℃、酶解pH 6、研究不同纖維素酶添加量1.0%、1.5%、2.0%、2.5%、3.0%、3.5%對(duì)條斑紫菜細(xì)胞破壁效果的影響。
1.9.5 酶解溫度對(duì)蛋白質(zhì)、多糖得率的影響
固定高壓均質(zhì)機(jī)的均質(zhì)壓力80 MPa、料液比1∶25、均質(zhì)次數(shù)6次、纖維素酶添加量2%、酶解時(shí)間3 h、酶解pH 6,研究不同酶解溫度30,35,40,45,50,55,60 ℃對(duì)條斑紫菜細(xì)胞破壁效果的影響。
1.9.6 酶解時(shí)間對(duì)蛋白質(zhì)、多糖得率的影響
固定高壓均質(zhì)機(jī)的均質(zhì)壓力80 MPa、料液比1∶25、均質(zhì)次數(shù)6次、纖維素酶添加量2%、酶解pH 6、酶解溫度40 ℃,研究不同酶解時(shí)間0.0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0 h對(duì)條斑紫菜細(xì)胞破壁效果的影響。
1.9.7 酶解pH對(duì)蛋白質(zhì)、多糖得率的影響
固定高壓均質(zhì)機(jī)的均質(zhì)壓力80 MPa、料液比1∶25、均質(zhì)次數(shù)6次、纖維素酶添加量2%、酶解時(shí)間3 h、酶解溫度40 ℃,研究不同酶解pH 4,5,6,7,8對(duì)條斑紫菜細(xì)胞破壁效果的影響。
1.10 高壓均質(zhì)聯(lián)合酶法對(duì)條斑紫菜細(xì)胞破壁的正交試驗(yàn)設(shè)計(jì)
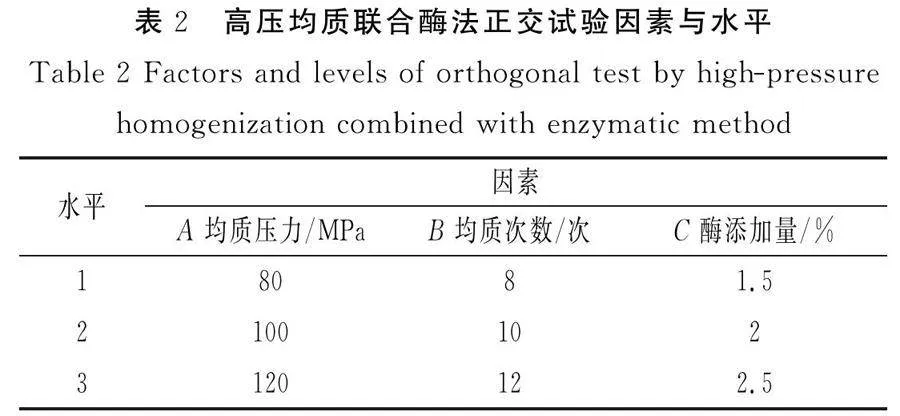
根據(jù)單因素試驗(yàn)結(jié)果,分析對(duì)均質(zhì)壓力、料液比、均質(zhì)次數(shù)、酶添加量、酶解溫度、酶解時(shí)間、酶解pH的變化,用SPSS 22軟件進(jìn)行數(shù)據(jù)分析,選取均質(zhì)壓力、均質(zhì)次數(shù)、酶添加量 3個(gè)影響顯著的因素,以總得率為評(píng)價(jià)指標(biāo),設(shè)計(jì)三因素三水平正交試驗(yàn)優(yōu)化破壁工藝參數(shù)。其余工藝條件選擇單因素試驗(yàn)最優(yōu)值。
1.11 數(shù)據(jù)處理
每組試驗(yàn)均重復(fù)3次,試驗(yàn)數(shù)據(jù)采用SPSS 22軟件進(jìn)行顯著性分析,Plt;0.05表示差異顯著;折線圖和柱狀圖均采用OriginPro 2018軟件繪制。
1.12 光學(xué)顯微觀察與分析
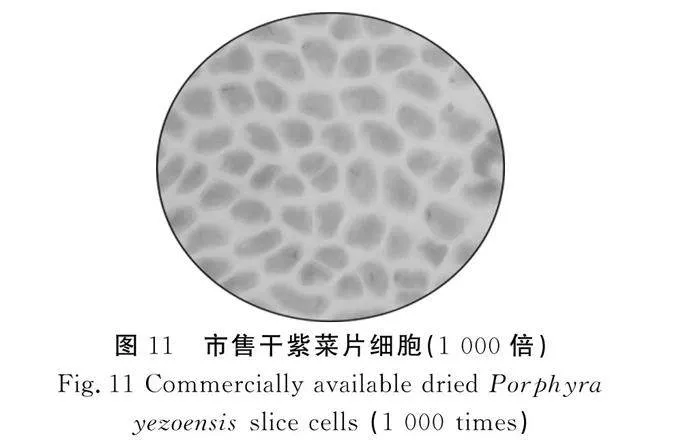
取3組樣品利用顯微鏡在1 000倍油鏡下觀察細(xì)胞壁的破損情況,第一組樣品是未經(jīng)過(guò)粉碎的干條斑紫菜片,首先用鑷子截取一小部分置于載玻片上,然后用滴管滴入適量蒸餾水,蓋上蓋玻片;第二組樣品是經(jīng)過(guò)超微粉碎的條斑紫菜粉,將樣品與蒸餾水均勻混合,用吸管吸取一部分置于載玻片上,蓋上蓋玻片;第三組樣品是經(jīng)過(guò)高壓均質(zhì)聯(lián)合酶法試驗(yàn)得出最佳破壁效果后的紫菜勻漿,用吸管吸取一部分置于載玻片上,為避免細(xì)胞之間重疊,滴入適量蒸餾水稀釋。
2 結(jié)果與分析
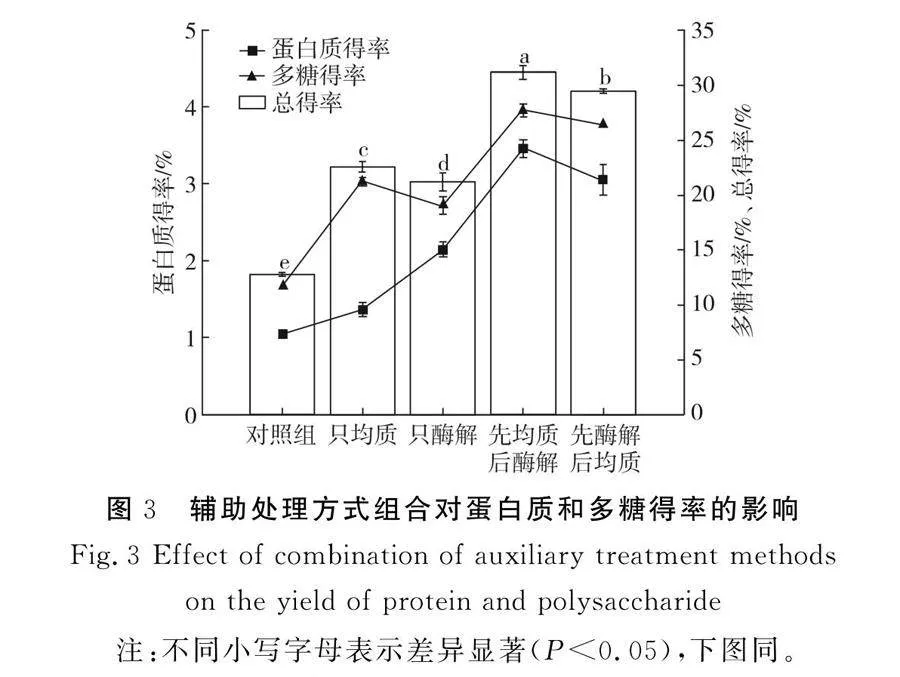
2.1 輔助處理方式組合對(duì)蛋白質(zhì)和多糖得率的影響
由圖3可知,與對(duì)照組相比,選取的4種破壁處理方式對(duì)蛋白質(zhì)和多糖的得率均有影響。由只進(jìn)行酶解和只進(jìn)行高壓均質(zhì)的預(yù)試驗(yàn)可以得出,在一定條件下,只進(jìn)行高壓均質(zhì)的總得率約為只進(jìn)行酶解總得率的1.07倍,條斑紫菜經(jīng)過(guò)高壓均質(zhì)后蛋白質(zhì)的得率高于酶解后蛋白質(zhì)的得率,約為只進(jìn)行酶解后蛋白質(zhì)得率的1.57倍,而經(jīng)過(guò)纖維素酶酶解后多糖的得率高于單純經(jīng)過(guò)高壓均質(zhì)后多糖的得率,約為后者的1.11倍,主要是由于高壓均質(zhì)通過(guò)物理擠壓、沖撞的方式破壞了細(xì)胞壁的結(jié)構(gòu),使大量的細(xì)胞內(nèi)容物包括大量蛋白質(zhì)溶出,從而導(dǎo)致蛋白得率升高[14]。條斑紫菜的細(xì)胞壁主要由纖維素和果膠構(gòu)成,通過(guò)纖維素酶酶解的方式可以有針對(duì)性地酶解細(xì)胞壁的結(jié)構(gòu),產(chǎn)生纖維素、肽聚糖等多糖類物質(zhì),同時(shí)細(xì)胞內(nèi)的一些多糖類物質(zhì)析出,使得多糖含量顯著升高[15]。在后兩組預(yù)試驗(yàn)中,作用條件相同但順序不同,通過(guò)先進(jìn)行高壓均質(zhì)再進(jìn)行纖維素酶酶解的方式,蛋白質(zhì)和多糖的得率均顯著高于先進(jìn)行纖維素酶酶解再進(jìn)行高壓均質(zhì)的方式,根據(jù)蛋白質(zhì)分子結(jié)構(gòu)特征及高壓均質(zhì)處理的原理分析,以上結(jié)果可能是由于高壓均質(zhì)處理所引起的空穴效應(yīng)、高速剪切力和湍流,使蛋白質(zhì)分子的空間結(jié)構(gòu)一定程度地展開,從而使更多原本位于蛋白分子內(nèi)部易于被纖維素酶酶解的氨基酸殘基暴露出來(lái),從而使得總得率均大于后者[16]。
2.2 高壓均質(zhì)聯(lián)合酶法提取蛋白質(zhì)、多糖試驗(yàn)結(jié)果
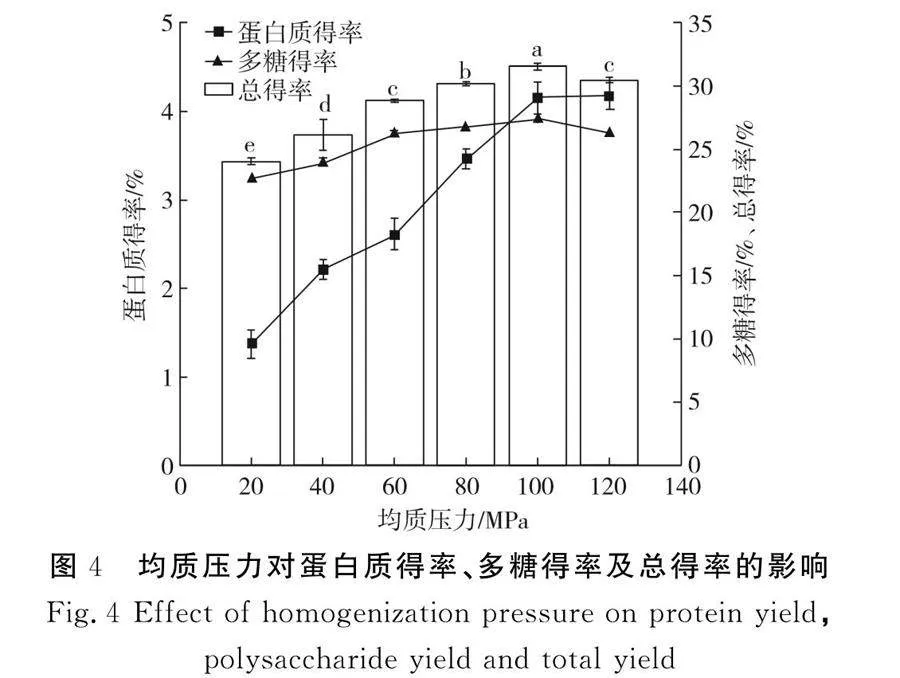
2.2.1 均質(zhì)壓力對(duì)蛋白質(zhì)得率、多糖得率及總得率的影響
由圖4可知,蛋白質(zhì)得率和多糖得率隨著均質(zhì)壓力的增大先上升然后在均質(zhì)壓力超過(guò)100 MPa后逐漸趨于平緩,在100 MPa左右達(dá)到最高值(Plt;0.05),總得率為31.55%。蛋白質(zhì)和多糖的得率在均質(zhì)壓力小于100 MPa時(shí)顯著上升的原因可能是隨著均質(zhì)壓力的增大,紫菜細(xì)胞經(jīng)過(guò)高速碰撞、強(qiáng)力剪切和水力空化后紫菜細(xì)胞壁出現(xiàn)破損[17],細(xì)胞中的蛋白質(zhì)、多糖等物質(zhì)溶出,均質(zhì)壓力大于100 MPa后,對(duì)于細(xì)胞壁的破壞進(jìn)一步加強(qiáng),細(xì)胞中的脂質(zhì)、核酸等物質(zhì)也被釋放出來(lái),導(dǎo)致蛋白質(zhì)和多糖的純度下降[18],同時(shí)均質(zhì)壓力過(guò)大也會(huì)破壞蛋白質(zhì)的結(jié)構(gòu),導(dǎo)致蛋白質(zhì)變性。
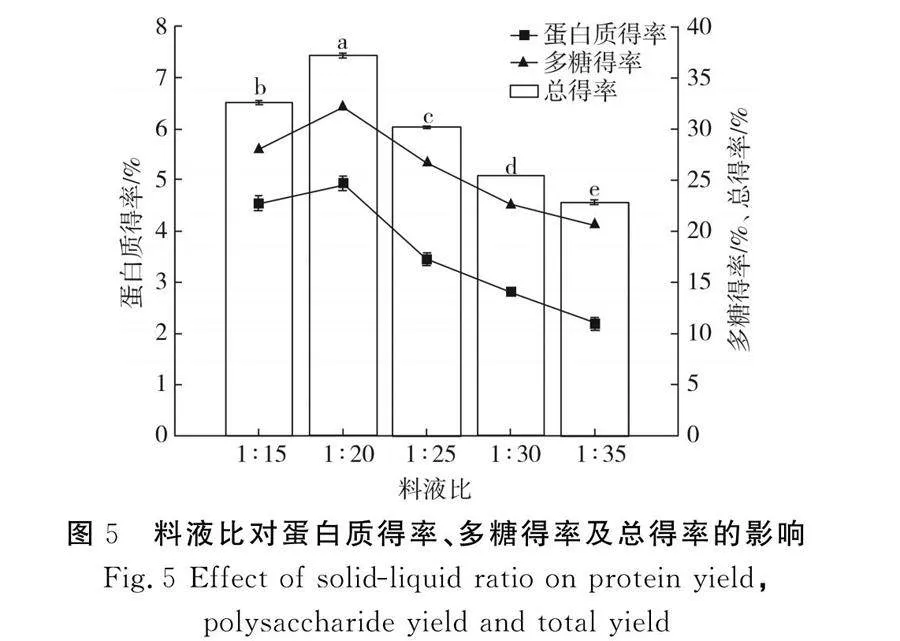
2.2.2 料液比對(duì)蛋白質(zhì)得率、多糖得率及總得率的影響
由圖5可知,不同的底物濃度對(duì)蛋白質(zhì)得率和多糖得率的影響效果十分顯著(Plt;0.05),當(dāng)料液比為1∶15時(shí),紫菜勻漿較黏稠,降低了分子的擴(kuò)散性,不易于利用高壓均質(zhì)機(jī)進(jìn)行均質(zhì),且容易發(fā)生均質(zhì)機(jī)堵塞的情況,底物濃度過(guò)低會(huì)導(dǎo)致酶的接觸面變小,導(dǎo)致酶解效率降低,當(dāng)料液比為1∶20時(shí),蛋白質(zhì)得率和多糖得率均達(dá)到最大值,總得率為37.13%,底物濃度越低,總得率越低,底物濃度在酶解過(guò)程中是影響酶解反應(yīng)的最主要因素[19]。Olmstead等[10]通過(guò)對(duì)微藻料液進(jìn)行均質(zhì),發(fā)現(xiàn)高壓均質(zhì)機(jī)對(duì)濃度范圍為20%~25%的微藻料液具有適用性,結(jié)合本次試驗(yàn),選擇料液比為1∶20。
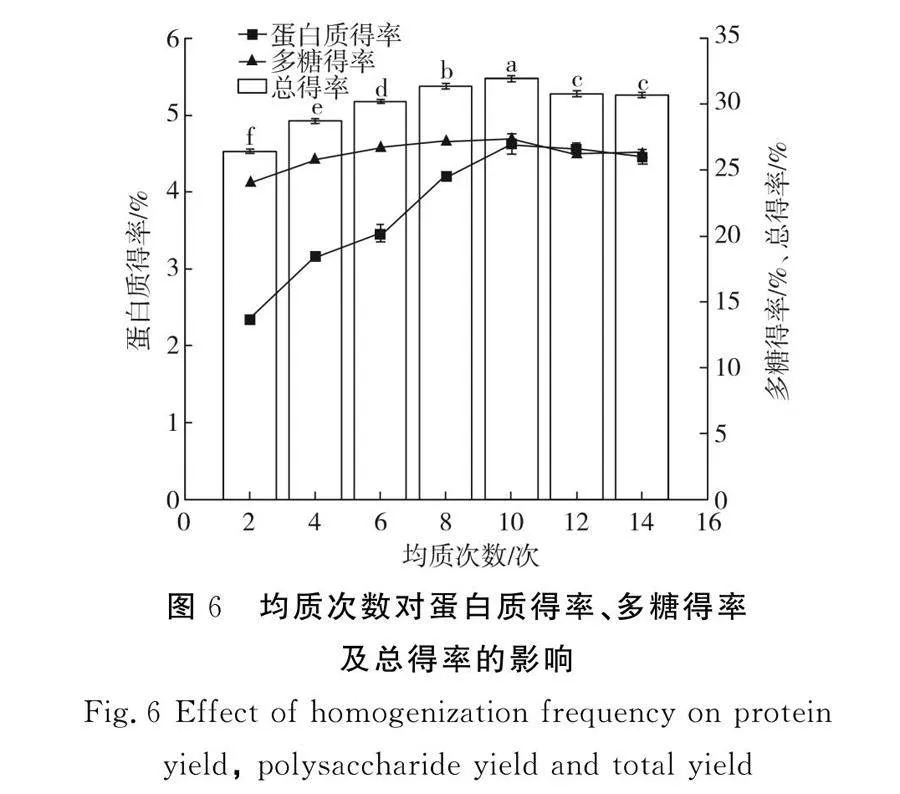
2.2.3 均質(zhì)次數(shù)對(duì)蛋白質(zhì)得率、多糖得率及總得率的影響
由圖6可知,隨著均質(zhì)次數(shù)(0~10次)的增加,蛋白質(zhì)得率和多糖得率均顯著上升(Plt;0.05),對(duì)蛋白質(zhì)得率的影響較明顯,而對(duì)多糖的影響相對(duì)較小,在均質(zhì)壓力的作用下,隨著均質(zhì)次數(shù)的增加,紫菜細(xì)胞受到剪切和撞擊的次數(shù)也相應(yīng)增加,細(xì)胞壁變得非常脆弱,結(jié)構(gòu)更加松散,從而使細(xì)胞內(nèi)的蛋白質(zhì)和多糖更易溶出,細(xì)胞變得越來(lái)越小[20]。細(xì)胞的顆粒大小不同,其作用效果也不同,顆粒較大的物質(zhì)在高強(qiáng)度的能量下破碎程度更高,當(dāng)顆粒小到一定程度時(shí),高壓均質(zhì)機(jī)的能量已經(jīng)不能破碎更小的顆粒,如果想要繼續(xù)獲得更小的顆粒,那么必須要輸入更高的能量,因此在壓力一定的條件下,僅增加次數(shù)對(duì)蛋白質(zhì)和多糖的提取無(wú)明顯的作用[21],因此,本試驗(yàn)條件下最佳的均質(zhì)次數(shù)為10次。
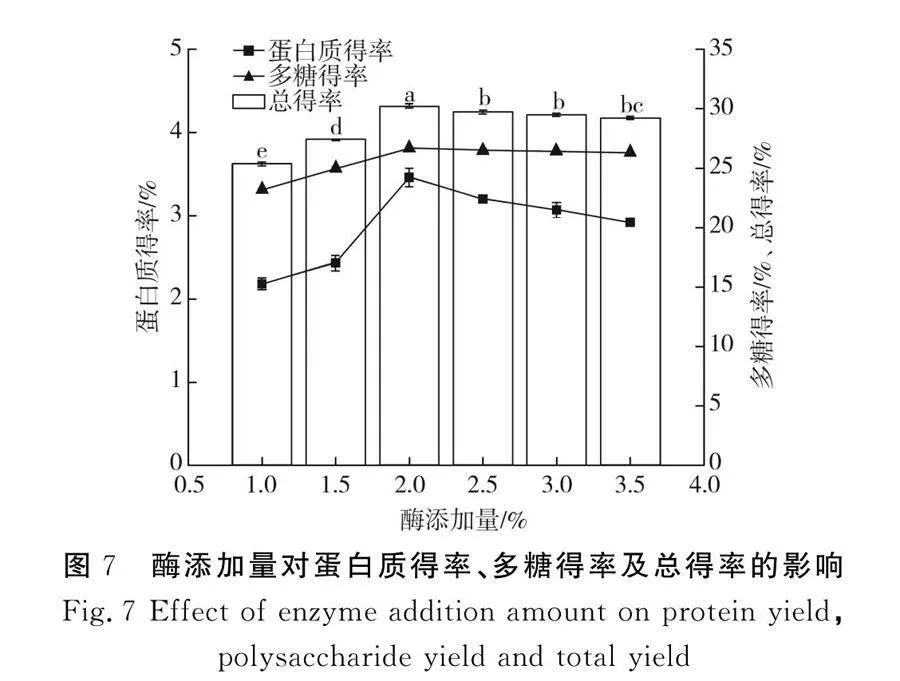
2.2.4 酶添加量對(duì)蛋白質(zhì)得率、多糖得率及總得率的影響
由圖7可知,當(dāng)其他條件一定時(shí),不同的纖維素酶添加量對(duì)紫菜懸濁液的酶解有著顯著的影響,當(dāng)纖維素酶添加量從1%增加到2%時(shí),蛋白質(zhì)得率和多糖得率均顯著上升(Plt;0.05),總得率在酶添加量為2%時(shí)達(dá)到最大值,為31.33%,酶添加量大于2%時(shí),總得率呈下降趨勢(shì)。由于紫菜細(xì)胞壁主要是由纖維素和果膠組成的,通過(guò)添加一定量的纖維素酶可以對(duì)紫菜細(xì)胞壁起到很好的降解作用,利于細(xì)胞內(nèi)蛋白質(zhì)和多糖的溶出,使得蛋白質(zhì)得率和多糖得率顯著提高,當(dāng)纖維素酶與底物反應(yīng)達(dá)到飽和時(shí),蛋白質(zhì)和多糖的得率達(dá)到峰值。隨后,由于底物濃度不變,酶添加量的增加導(dǎo)致酶的競(jìng)爭(zhēng)性受到抑制,從而降低了酶反應(yīng)的效率,并略微降低了蛋白質(zhì)和多糖的得率[22]。因此,在此試驗(yàn)條件下,當(dāng)纖維素酶添加量為2%時(shí),總得率最高。
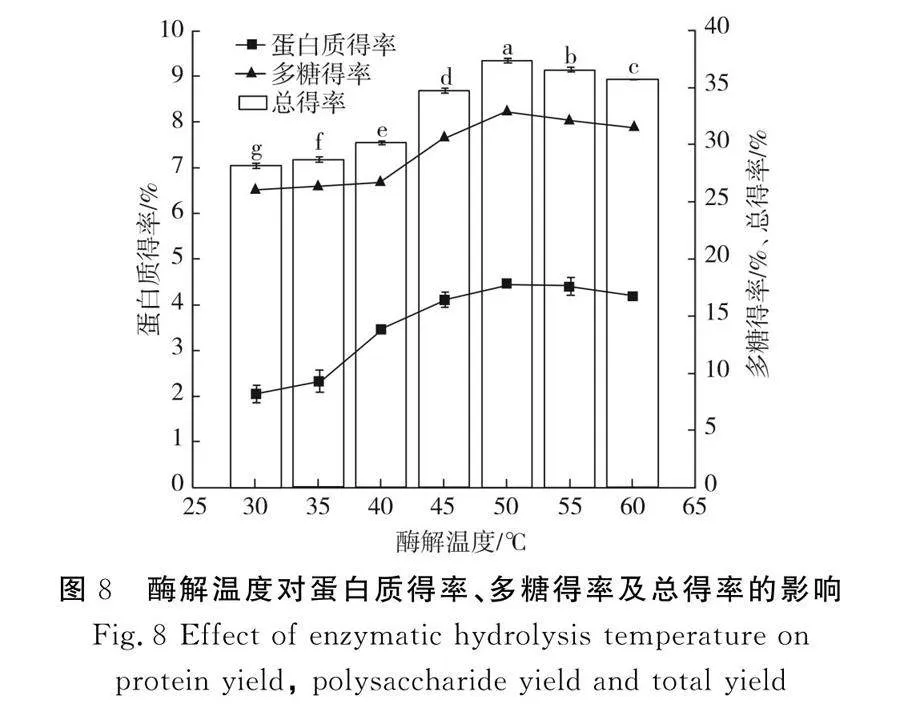
2.2.5 酶解溫度對(duì)蛋白質(zhì)得率、多糖得率及總得率的影響
由圖8可知,酶解溫度對(duì)蛋白質(zhì)和多糖提取效果的影響較明顯,當(dāng)酶解溫度為30~40 ℃時(shí),多糖得率基本穩(wěn)定在26%左右,當(dāng)酶解溫度為40~50 ℃時(shí),多糖得率呈現(xiàn)上升趨勢(shì),且在50 ℃時(shí)達(dá)到最大值,蛋白質(zhì)得率的變化受酶解溫度的影響較大,當(dāng)酶解溫度為30~50 ℃時(shí),變化不明顯,當(dāng)溫度為35~50 ℃時(shí),蛋白質(zhì)得率顯著升高,當(dāng)溫度為50 ℃時(shí)達(dá)到最大值,50 ℃后蛋白質(zhì)得率和多糖得率均呈現(xiàn)下降趨勢(shì),纖維素酶的活性隨著溫度的升高而升高,但是溫度過(guò)高(gt;50 ℃)會(huì)引起酶蛋白變性,導(dǎo)致得率下降。因此,經(jīng)過(guò)均質(zhì)后的紫菜勻漿纖維素酶的最適酶解溫度為50 ℃。
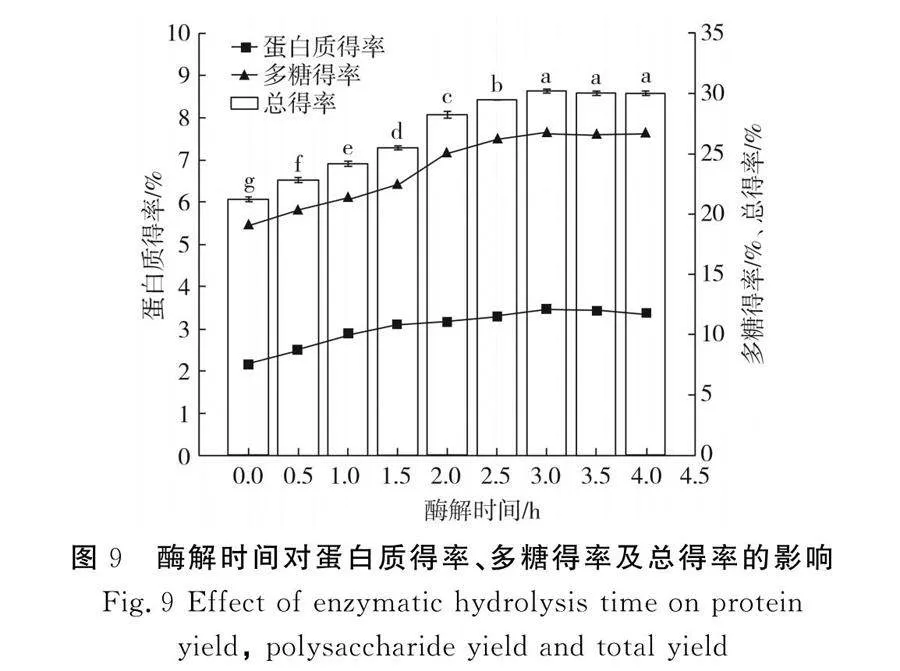
2.2.6 酶解時(shí)間對(duì)蛋白質(zhì)得率、多糖得率及總得率的影響
由圖9可知,在酶解時(shí)間小于3 h時(shí),蛋白質(zhì)和多糖的得率均隨著酶解時(shí)間的增加而增加(Plt;0.05),3 h時(shí)總得率達(dá)到最大值,為30.17%,繼續(xù)延長(zhǎng)酶解時(shí)間至3.5,4.0 h,得率保持不變,說(shuō)明纖維素酶酶促反應(yīng)的最佳時(shí)間為3 h,酶促反應(yīng)需要一定的時(shí)間,當(dāng)時(shí)間較短時(shí),酶分子與底物的結(jié)合程度較低,酶解效果不理想,隨著酶解時(shí)間的延長(zhǎng),酶與底物充分結(jié)合,3 h時(shí)酶解效果最佳。如果繼續(xù)延長(zhǎng)酶解時(shí)間,蛋白質(zhì)和多糖得率的增加會(huì)加速逆反應(yīng)的進(jìn)行,從而導(dǎo)致酶反應(yīng)速度下降,蛋白質(zhì)和多糖的得率降低[23]。
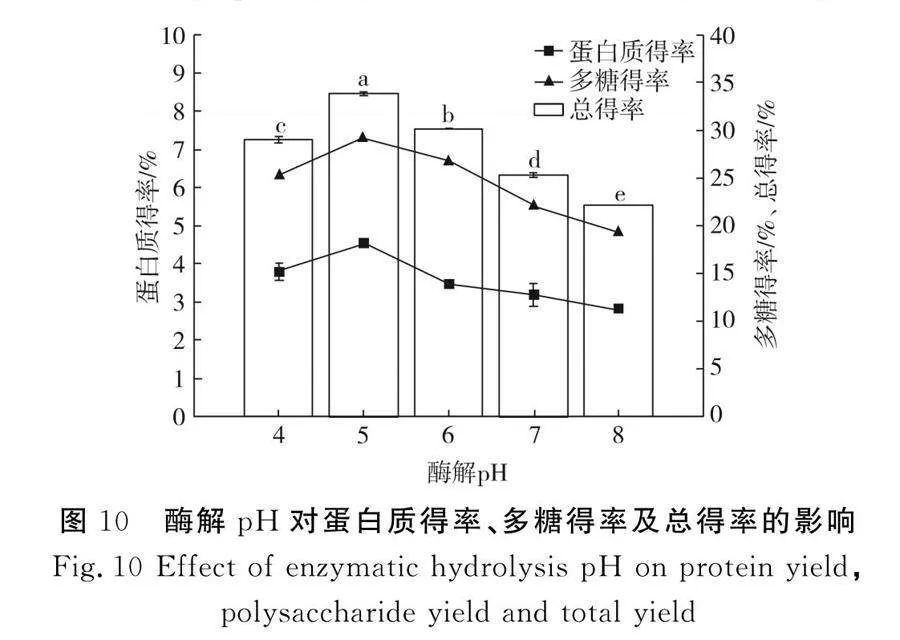
2.2.7 酶解pH對(duì)蛋白質(zhì)得率、多糖得率及總得率的影響
由圖10可知,pH對(duì)蛋白質(zhì)得率和多糖得率的影響較明顯,當(dāng)pH為5時(shí),蛋白質(zhì)得率和多糖得率均達(dá)到最大值,總得率為33.81%,纖維素酶在偏酸性的條件活性較強(qiáng)[24],且在pH為5時(shí),纖維素酶的酶解效果最佳,當(dāng)pH為5~8時(shí),蛋白質(zhì)得率和多糖得率下降,纖維素酶的催化水解能力減弱,因此,pH為5是紫菜勻漿纖維素酶酶解的最佳pH值。
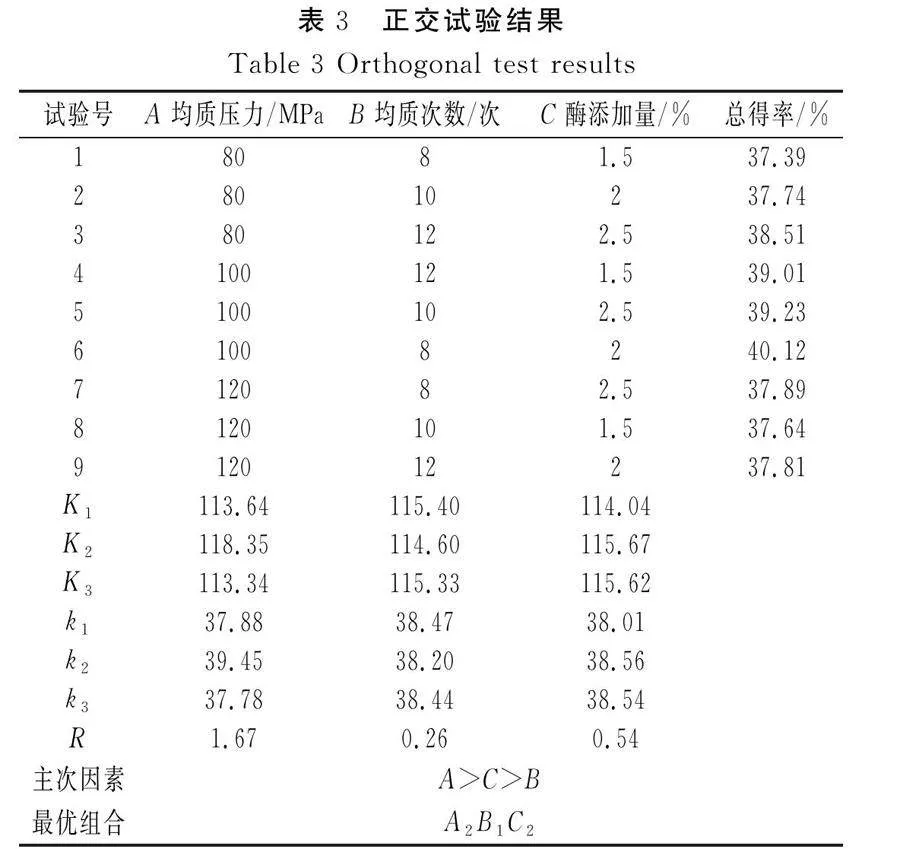
2.3 高壓均質(zhì)聯(lián)合酶法破除條斑紫菜細(xì)胞壁正交試驗(yàn)條件的確定
由于纖維素酶在酶解過(guò)程中最適酶解時(shí)間、溫度、pH較恒定,因此根據(jù)單因素試驗(yàn)結(jié)果,選出最優(yōu)值作為試驗(yàn)條件,紫菜勻漿濃度較高(料液比為1∶15)時(shí)不利于均質(zhì)的進(jìn)行,容易引發(fā)堵塞,濃度較低時(shí)(料液比為1∶25),總得率相對(duì)較低,故選擇料液比為1∶20。因此,進(jìn)一步以均質(zhì)壓力、均質(zhì)次數(shù)、酶添加量為影響因素,以蛋白質(zhì)和多糖的總得率為考察指標(biāo),進(jìn)行L9(33)正交試驗(yàn)。
2.4 正交試驗(yàn)結(jié)果分析
由表3中極差分析可知,影響高壓均質(zhì)法聯(lián)合酶法提取蛋白質(zhì)和多糖效果的主次順序?yàn)榫|(zhì)壓力gt;酶添加量gt;均質(zhì)次數(shù)。正交試驗(yàn)結(jié)果經(jīng)分析驗(yàn)證,得出高壓均質(zhì)法聯(lián)合酶法的最佳工藝條件為均質(zhì)壓力100 MPa、均質(zhì)次數(shù)8次、酶添加量2%,在最優(yōu)組合條件下,條斑紫菜蛋白質(zhì)和多糖的總得率為40.12%。
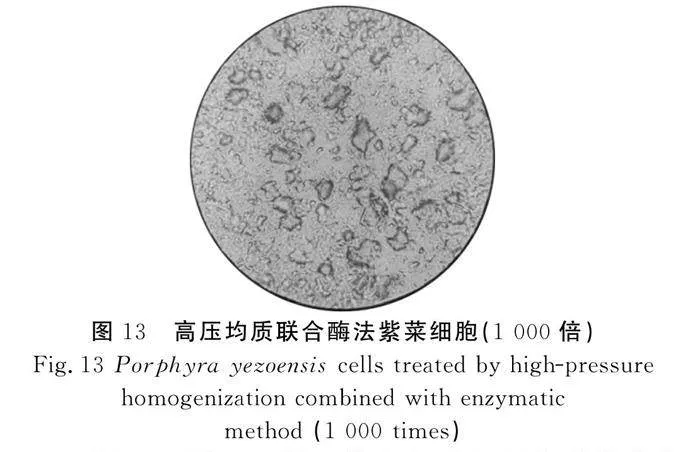
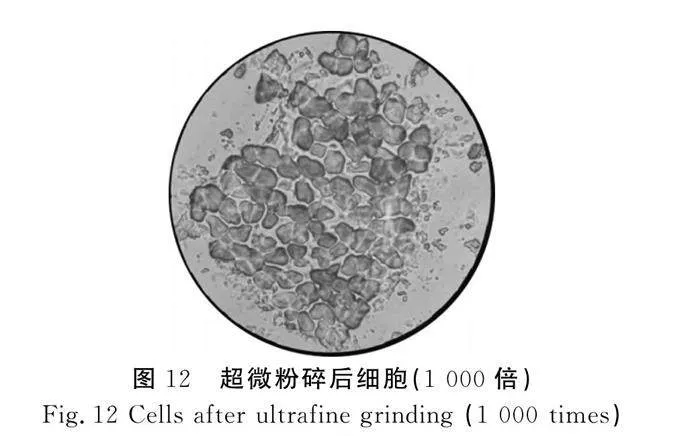
2.5 光學(xué)顯微鏡觀察結(jié)果分析
由圖11~圖13可知,沒有經(jīng)過(guò)任何處理的市售干紫菜細(xì)胞樣品中,細(xì)胞呈不規(guī)則的橢圓形,細(xì)胞體態(tài)完整,細(xì)胞壁輪廓較清晰,細(xì)胞與細(xì)胞之間排列緊密,在經(jīng)過(guò)超微粉碎后的紫菜細(xì)胞樣品中,有少許細(xì)胞碎片存在,但是大部分細(xì)胞沒有發(fā)生破裂。而經(jīng)過(guò)高壓均質(zhì)和酶解后的條斑紫菜細(xì)胞樣品中,細(xì)胞形狀不規(guī)則,細(xì)胞大小各異,破碎情況比較明顯,且有細(xì)胞內(nèi)容物溶出,說(shuō)明細(xì)胞結(jié)構(gòu)遭到了一定的破壞。
3 結(jié)論
文章采用高壓均質(zhì)聯(lián)合酶法的方式對(duì)條斑紫菜細(xì)胞進(jìn)行破壁,通過(guò)單因素試驗(yàn)和正交試驗(yàn)優(yōu)化了最佳工藝條件,并用光學(xué)顯微鏡在1 000倍油鏡下進(jìn)行了觀察分析,研究表明:
第一,通過(guò)蛋白質(zhì)和多糖總得率的數(shù)據(jù)分析可以得出,在一定條件下,高壓均質(zhì)法和酶法均對(duì)條斑紫菜細(xì)胞壁具有一定的破壞效果,只進(jìn)行高壓均質(zhì)破壁的作用效果優(yōu)于只進(jìn)行酶解破壁的作用效果,先進(jìn)行高壓均質(zhì)再進(jìn)行酶解破壁的作用效果優(yōu)于先進(jìn)行酶解再進(jìn)行高壓均質(zhì)的作用效果。
第二,通過(guò)光學(xué)顯微鏡觀察分析可以得出,高壓均質(zhì)聯(lián)合酶法對(duì)條斑紫菜細(xì)胞進(jìn)行破壁效果明顯,且優(yōu)于超微粉碎法的破壁效果。
本文的研究結(jié)果為海洋藻類細(xì)胞的破壁提供了思路和相關(guān)的數(shù)據(jù)參考,提高了條斑紫菜的營(yíng)養(yǎng)利用率,為條斑紫菜產(chǎn)品的進(jìn)一步開發(fā)利用奠定了重要的基礎(chǔ)。
參考文獻(xiàn):
[1]趙玲,曹榮,王聯(lián)珠,等.靖海灣條斑紫菜的營(yíng)養(yǎng)及鮮味評(píng)價(jià)[J].漁業(yè)科學(xué)進(jìn)展,2018,39(6):134-140.
[2]姚興存,蔣棟磊,盤賽昆,等.條斑紫菜蛋白酶解物降血壓活性[J].食品與發(fā)酵工業(yè),2011,37(2):62-64,69.
[3]錢偉靖,胡文彬,施慶忠,等.條斑紫菜提取液的降血脂作用及其臨床觀察[J].中國(guó)海洋藥物,1998(2):43-45.
[4]姚興存,舒留泉,盤賽昆,等.條斑紫菜蛋白提取與抗氧化活性[J].食品科學(xué),2012,33(20):113-118.
[5]顧佳雯,張陸曦,徐紅麗,等.條斑紫菜多糖的分離純化與抗腫瘤活性[J].中國(guó)生物工程雜志,2007,27(7):50-54.
[6]邱偉芬,楊文建,薛梅,等.條斑紫菜多糖的純化、理化性質(zhì)及其免疫活性研究[J].食品科學(xué),2013,34(23):51-56.
[7]GNERKENAB E, D'HONDTA E, EPPINK M H, et al. Cell disruption for microalgae biorefineries[J].Biotechnology Advances,2015,33(2):243-260.
[8]郭鎖蓮,于雪,邊新宇,等.響應(yīng)曲面法優(yōu)化螺旋藻的酶解破壁工藝[J].食品工業(yè),2019,40(10):224-227.
[9]劉春延,張國(guó)財(cái),程方志,等.靈芝孢子粉破壁工藝優(yōu)化及其抗腫瘤作用[J].食品科學(xué),2016,37(14):51-55.
[10]OLMSTEAD I L, KENTISH S E, SCALES P J, et al. Low solvent, low temperature method for extracting biodiesel lipids from concentrated microalgal biomass[J].Bioresource Technology,2013,148:615-619.
[11]鄔應(yīng)龍,鄧紅霞,楊性民,等.紫菜超細(xì)粉體加工技術(shù)及其在食品加工中的應(yīng)用[J].食品研究與開發(fā),2005(6):101-103.
[12]柳蔭,吳鳳智,陳龍,等.考馬斯亮藍(lán)法測(cè)定核桃水溶性蛋白含量的研究[J].中國(guó)釀造,2013,32(12):131-133.
[13]林靖瑩,黃姝玲,孟鵬,等.牡蠣多糖制備工藝研究及體外抗氧化活性評(píng)價(jià)[J].福建師范大學(xué)學(xué)報(bào)(自然科學(xué)版),2023,39(3):70-77.
[14]YAP B H J, DUMSDAY G J, SCALES P J, et al. Energy evaluation of algal cell disruption by high pressure homogenisation[J].Bioresource Technology,2015,184:280-285.
[15]施瑛,裴斐,周玲玉,等.響應(yīng)面法優(yōu)化復(fù)合酶法提取紫菜藻紅蛋白工藝[J].食品科學(xué),2015,36(6):51-57.
[16]李存紅,侯艷,符德學(xué).高壓均質(zhì)、高剪切乳化、微射流均質(zhì)的比較及在食品方面的應(yīng)用[J].焦作大學(xué)學(xué)報(bào),2020,34(2):81-83.
[17]ELAIN A, NKOUNKOU C, FELLIC M L, et al. Green extraction of polysaccharides from Arthrospira platensis using high pressure homogenization[J].Journal of Applied Phycology,2020,32(3):1719-1727.
[18]關(guān)瑞,王玉,曹雷鵬,等.螺旋藻中分析級(jí)藻藍(lán)蛋白的高效制備[J].南昌大學(xué)學(xué)報(bào)(理科版),2023,47(2):157-164.
[19]劉妙蓮,王潔.影響纖維素酶活力測(cè)定的幾個(gè)因素[J].食品與發(fā)酵工業(yè),2000(6):37-39.
[20]馮春連,楊文俠,朱博,等.不同高壓均質(zhì)條件對(duì)臍橙汁穩(wěn)定性及品質(zhì)的影響[J].食品科技,2021,46(11):109-115.
[21]王艷梅,王艷玲,呂立新,等.響應(yīng)面優(yōu)化高壓均質(zhì)法提取五味子籽油工藝[J].糧食與油脂,2021,34(8):57-60,65.
[22]李詩(shī)虹,陳秋如,楊志堅(jiān),等.纖維素酶酶解法提取荷葉堿的工藝優(yōu)化[J].福建農(nóng)業(yè)科技,2023,54(5):37-41.
[23]石亞中,方嬌龍,錢時(shí)權(quán),等.響應(yīng)曲面法優(yōu)化纖維素酶酶解提取工藝[J].食品科學(xué),2013,34(4):75-79.
[24]王星敏,殷鐘意,李鑫,等.纖維素酶酶解醇葛根素研究[J].食品科學(xué),2010,31(24):46-49.
收稿日期:2024-04-16
基金項(xiàng)目:江蘇省普通高校自然科學(xué)研究計(jì)劃項(xiàng)目(21KJA240004)
作者簡(jiǎn)介:高子鑫(1995—),男,山東濰坊人,碩士研究生,研究方向:食品加工與功能性食品。
*通信作者:盤賽昆(1974—),男,瑤族,教授,博士,研究方向:食品加工與功能性食品。

